
Лекции / organic_2011_6
.pdf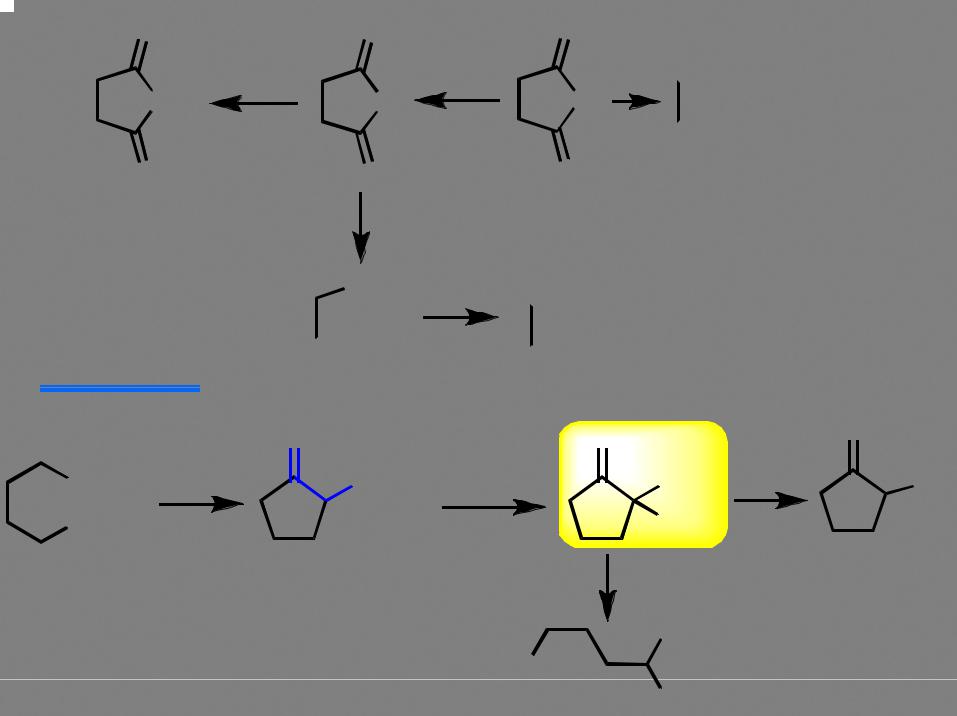
O |
|
O |
|
|
|
|
Br /HO- |
|
|
NH3 |
|
NBr |
2 |
NH |
|
||
0 oC |
t |
||||
|
|
|
|||
|
|
|
|
||
O |
|
O |
|
|
|
NBS |
Br /HO- |
t |
a |
|
|
|
2 |
|
|
|
|
|
CO |
- |
b |
||
|
|
2 |
|
||
 CONH2
CONH2
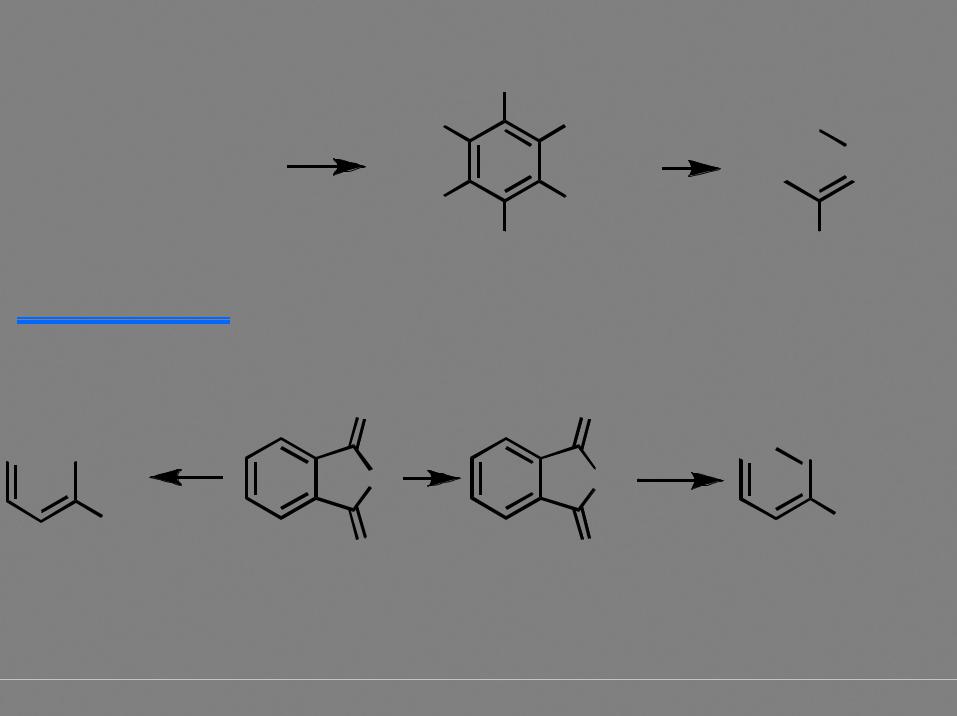
Применение конденсации Дикмана в синтезе
|
|
O |
|
|
CO Et |
EtO- |
CO2Et |
RX/EtO |
- |
2 |
|
|
|
|
CO2Et |
|
|
S 2 |
|
|
|
|
N |
|
|
|
β-кетоэфир |
|
|
O |
51 |
|
NH3  CO2H
CO2H
O
 CONH2
CONH2
O
a - гидролиз
b - расщепление Гофмана
 CO2-
CO2-
 NH2
NH2
O |
|
O |
CO Et |
H O+ |
R |
2 |
3 |
|
R |
t |
|
HO- t
CO2-
-O2C
R

52
реакция конденсации обратима! |
|
|
|
|
|
|
|||
O |
|
|
EtO O R |
|
|
|
|
|
|
R |
EtO- |
|
|
CO2Et |
|
CO2Et |
|||
CO2Et |
t |
|
|
CO Et |
|
CO2Et |
|
CO2Et |
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
R |
|
|
|
R |
|
|
|
|
|
|
|
|
|
более |
|
|
|
|
|
|
|
|
устойчивый анион |
|
R |
|
|
R |
|
R |
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
OEt |
-EtO |
- |
|
1. EtO- |
|
O |
H3O+ |
R' |
|
|
|
O |
2.R'X |
|
t |
R |
|||
O |
|
|
|
|
|
|
|||
|
|
|
|
R' |
|
|
|
|
|
CO2Et |
|
|
CO2Et |
EtO2C |
|
HO- |
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
t |
|
R' |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
R |
|
CO2H |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CO2H |
|

O 53
R
O
 CO2Et EtO-EtO2C
CO2Et EtO-EtO2C
CO2Et
O
Ароматические кислоты
CO2H
O2
Co2+
|
|
|
EtO2C |
O |
|
H O+ |
|
|
|
R |
|||
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
3 |
|
|
|
|||||
|
1. EtO- |
|
|
|
|
|
|
t |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
R |
|
|
|
|
|
R |
O |
|
|
|||
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CO Et 2. RX |
|
|
|
|
|
HO- |
CO2H |
||||||
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|||||||
2 |
|
|
|
|
|
|
|
|
CO2Et |
t |
|
||
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
O |
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
R |
CO2H |
CO2H
O2
Co2+  CO2H
CO2H
толуиловые |
|
фталевые |
кислоты |
|
кислоты |
Br |
CO2H |
CONEt2 |
1. Mg / эфир |
|
|
2. CO2 |
|
ДЭТА |
3. H O+ |
|
|
3 |
|
|
O2
 V2O5
V2O5
CO2H
 CO2H
CO2H
54
O
 CO2H O H3O+
CO2H O H3O+ 


CO2H
Oфталевая кислота: диэтилфталат (репеллент)
CO2H
1. KOH/400o
2. H3O+
HO2C терефталевая кислота
HO2C |
O |
|
|
H2O2 |
CaO |
AcOH |
t |
CO2H |
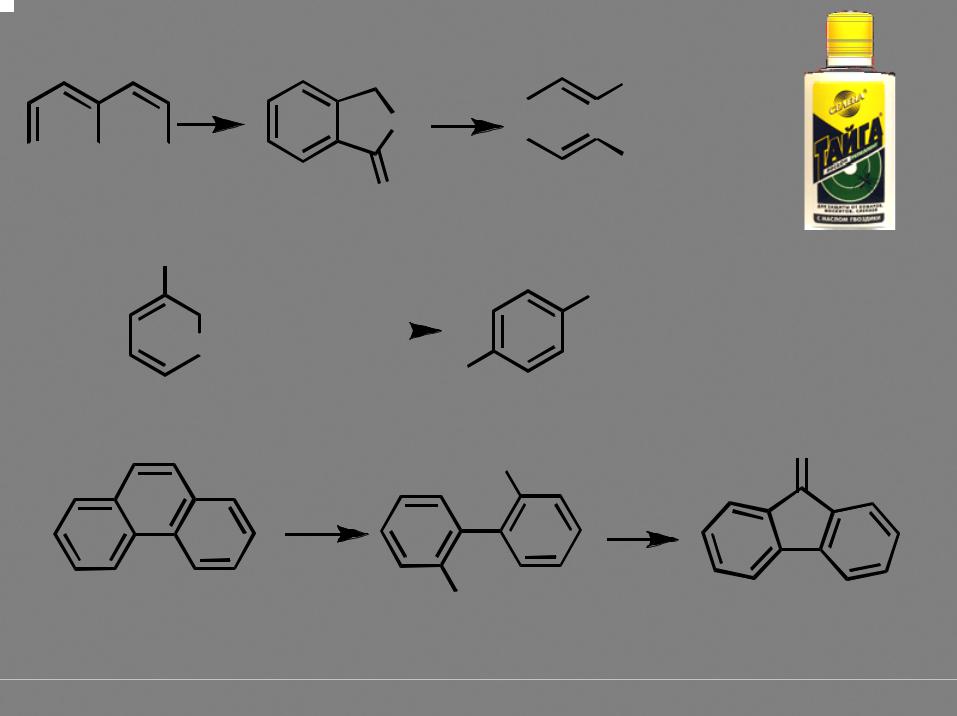
флуоренон |
дифеновая
кислота
графит
Свойства

 CO2H CH3O-
CO2H CH3O-
CO2CH3
55
|
CO2H |
HO2C |
CO2H |
HNO3 |
|
HO2C |
CO2H |
|
CO2H |
|
меллитовая |
|
кислота |
O |
|
O |
|
O |
NH3 |
NH |
|
t |
|||
|
|
||
O |
|
O |
|
|
|
фталимид |
HO2C

 CO2H t
CO2H t 


CO2H
пиромеллитовая
кислота
NaOBr 
 CO2H
CO2H
t
NH2
антраниловая кислота

Ph |
O |
|
O |
|
CO2H |
PhH |
PhOH |
|
AlCl3 |
O |
|
|
|
ZnCl2 |
|
|
O |
Zn |
O |
|
|
|
HO- |
|
O |
|
|
|
|
фталид |
|
HO2C
H2N

 NH2
NH2
O  O
O
HN

 NH
NH 

 n
n
кевлар
HO
O
O
фенолфталеин
COCl
PhH
AlCl3
COCl
 CO2H
CO2H
HO OH
O O

O
лавсан
56
OH
Ph
Ph
O
O
O
 n
n
МОДУЛЬ 5 (Часть 1) |
Галоидкарбоновые кислоты |
57 |
|
|
Синтез – галоидировние карбоновых кислот:
Br
[Br2]
R |
CO2H |
R |
CO2H |
Br2/P (Гель-Фольгардт-Зелинский)
Br2/пиридин
Br2/RCOBr
Br2/hν
NBS
SO2Cl2
SOCl2/hν
Cl |
|
OH HNO |
|
|
|
|
H SO |
Cl |
|
|
|
Cl |
||||||||
|
|
|
|
|
|
3 |
|
ClCH2CO2H |
2 |
4 |
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
t |
|
|
|
|
Cl |
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(CH3CO)2O |
F-/HF |
|
CF3COF |
H2O |
|
CF CO H |
|||||||||||||
|
|
|
|
|
|
|
|
|||||||||||||
|
+ e |
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3 |
2 |
|
|
|||
|
|
|
Cl2 |
|
|
|
OH |
|
|
|
|
|
|
|
|
|
||||
|
OH |
|
|
|
|
|
HNO3 |
|
Cl3CCO2H |
|||||||||||
|
HO- |
|
|
|
|
|
|
|
|
|
||||||||||
|
|
Cl3C |
|
OH |
|
|
|
|
||||||||||||
58
Производные ϖ-галоидкарбоновых кислот
COCl |
|
O |
|
|
SOCl2 |
|
EtOH |
CO2Et |
|
|
O |
|||
|
|
HBr |
|
|
Cl |
ZnCl2 |
|
Br |
|
|
|
|
β-Галоидкарбоновые кислоты
CO2H |
H+ |
HX |
CO2H |
|
|
X = Cl, Br |
|||
|
|
CO2H |
X |
|
|
|
H+ |
|
|
CO2H |
|
- |
|
|
оба катиона |
|
|
X |
|
неустойчивы! |
|
OH |
OH |
|
|
|
OH |
OH |
|
Свойства α-галоидкарбоновых кислот
Повышение кислотности по мере накопления атомов галогена у α-углеродного
атома. Ка CF3CO2H 5.9.10-1 (в 10000 раз более сильная кислота, чем уксусная!)
Использование реакций нуклеофильного замещения |
59 |
Br
R CO2H
HO- H2O
OH
R CO2H
α-гидроксикислоты
CN- |
CN |
|
|
CH2N2 |
CN |
|
|
|
|
|
|||
R |
CO2H |
R |
CO2CH3 |
|||
|
||||||
NH3 |
|
|
|
циануксусный эфир |
||
|
|
H3O |
+ |
LiAlH4 |
||
|
|
|
|
|||
|
NH2 |
|
|
CO2H |
NH2 |
|
|
|
|
|
|||
R |
CO2H |
|
R |
CO2H |
OH |
|
|
R |
|||||
α-аминокислоты |
малоновые |
γ-аминоспирты |
||||
|
||||||
кислоты
H |
O |
- |
- AgBr |
H |
O |
- H+ |
H |
O- |
|
|
|
|
|||||
Ag+ Br |
O |
|
SN2 |
|
|
O SN2 |
HO |
O |
|
|
H2O |
|
|
||||
(S)-бромпропионат |
|
|
|
(R)-лактат |
||||
|
|
|
|
|
|
|||

Реакция Дарзана |
60 |
|
O |
ClCH2CO2Et |
O- |
O |
|
|
CO Et - Cl- |
|
|
NaNH (EtO-) |
|
2 |
|
|
CO Et |
|
|
2 |
|
|
|
|
|
2 |
|
|
|
Cl |
Реакция Реформатского |
|
|
|
O |
|
O- |
|
|
OH |
||||
|
|
|
ClCH2CO2Et |
|
H |
O |
|
|
|
|
|
|
|
|
CO2Et |
2 |
|
|
CO Et |
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|||
|
|
|
Zn |
|
|
2 |
|||
|
|
|
|
|
|
|
|||
Br
|
HBr |
Br |
CO2H EtO- |
CO2H |
CO2H |
активный электрофил в реакции присоединения CO2Et по Михаэлю!
