
Лекции / organic_2011_6
.pdf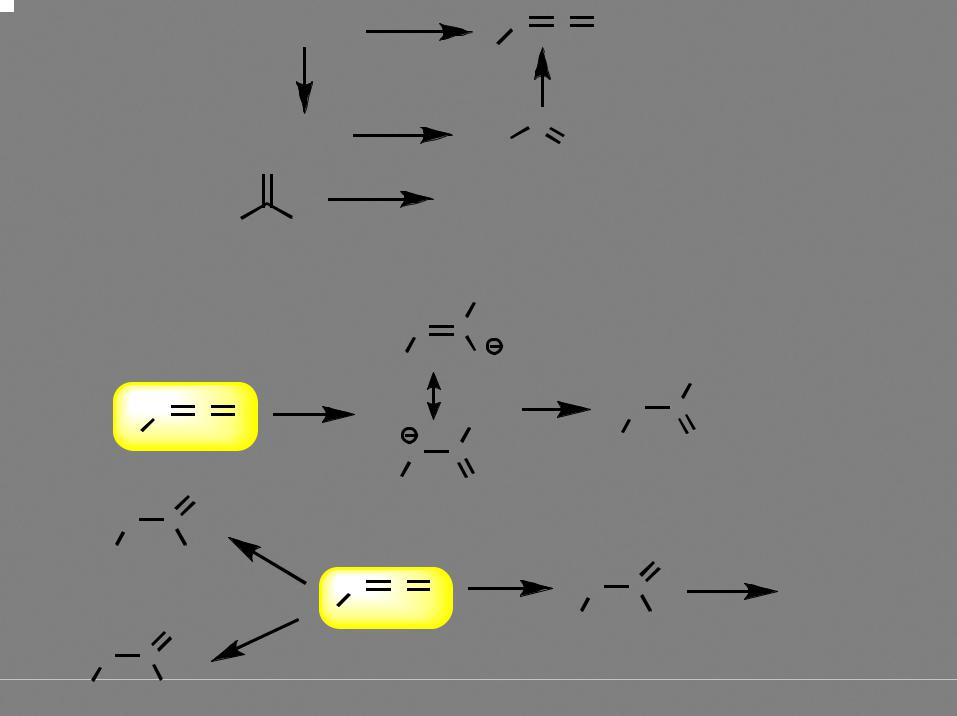
|
|
|
|
|
CSCl2 |
N |
C S |
изотиоцианаты |
41 |
||
|
|
|
|
ArNH2 |
|||||||
1. NaNO /H O+, 0 oC |
|
Ar |
|
|
|
|
|
||||
|
2 |
|
3 |
|
|
CS2 |
|
|
|
|
|
2. NaN3 |
|
|
|
PPh3 |
|
|
|
|
|
||
|
|
|
|
N |
|
|
|
|
|||
|
|
|
|
ArN3 |
Ar |
PPh3 |
|
|
|
||
|
|
|
|
O |
- N2 |
|
|
|
|||
|
|
|
|
|
t |
RNCO Курциус |
|
|
|
|
|
|
|
|
R |
N |
бензол |
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
3 |
|
|
|
|
|
|
|
Взаимодействие с нуклеофильными реагентами |
|
|
|
|
|||||||
|
|
|
|
|
|
Nu |
|
|
|
|
|
|
|
|
|
|
N |
C |
|
|
|
|
|
|
|
|
|
|
R |
X |
|
|
|
Nu |
|
|
|
|
|
Nu- |
|
H+ |
|
|
|
||
|
N |
|
C X |
|
HN |
C |
|
|
|||
|
|
|
|
Nu |
|
|
|
||||
R |
|
|
|
N |
C |
|
R |
|
X |
|
|
|
|
|
|
|
|
|
|
|
|
||
HN |
C |
|
O |
|
R |
X |
X = O, S |
|
|
||
|
|
R'OH |
|
|
|
|
|
|
|||
R |
|
OR' |
H2O |
|
|
O |
|
|
|||
|
|
|
|
|
N C |
HN |
C |
|
|
RNH2 |
|
|
|
|
R'NH |
O |
|
- CO2 |
|||||
|
O |
R |
|
R |
|
OH |
|
||||
|
|
2 |
|
|
|
|
|||||
HN |
C |
|
|
|
|
|
|
|
|
|
|
R |
NHR' |
|
|
|
|
|
|
|
|
||

Промышленно-важные диизоцианаты – мономеры для полимеров (полиуретанов) 42
|
|
OCN |
|
|
|
|
(H2C)6 |
NCO |
|
|
|
|
NCO |
NCO |
|
|
|
|
|
|
|
|
|
OH |
|
NCO |
O |
H |
|
|
N |
|
|||
|
+ |
O |
O |
N |
n |
OH |
|
||||
|
NCO |
|
H |
O
OH
OCN N N NCO
O |
N |
O |
OH |
сетчатый полиуретан |
NCO
Производные тиоугольной кислоты
|
|
|
S |
|
|
|
|
RNH2 |
-S |
N |
R |
R'X |
|
|
|
SN2 |
R'S |
|||
С + S |
|
HO- |
H |
|
||
CS2 |
H+ |
дитиокарбаматы |
||||
|
|
RONa |
S |
|
|
|
|
|
|
|
RX |
|
|
|
|
|
|
R |
R'S |
|
|
|
-S |
O |
S 2 |
||
|
|
|
|
|
N |
|
ксантогенаты
43
S
R
N
H
S
R
O
|
S |
Cl2 |
|
S |
|
R |
R |
S- |
R |
|
S |
N |
|
N |
|
N |
S |
|
R |
|
R |
|
|
R |
|
|
S |
тиурамдисульфиды (R = Et - "эспераль", "торпеда")
|
1. CS2 |
|
|
S |
|
RMgX |
R |
|
|
||
2. H |
O |
|
|
||
2 |
|
|
|
SH |
|
|
|
|
|
|
|
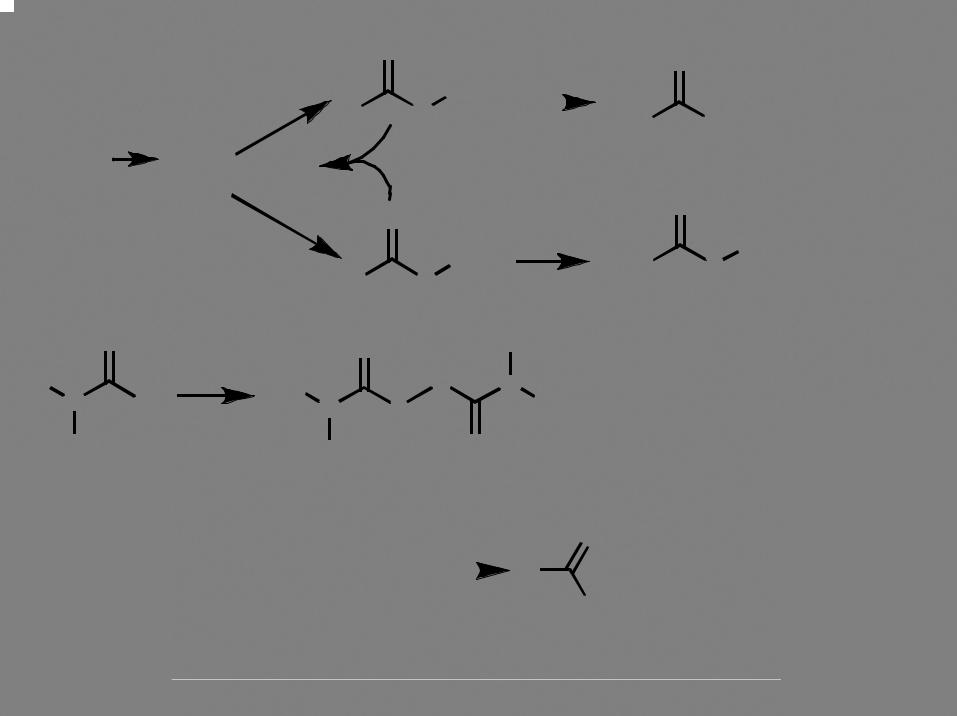
Синтез меркаптанов с использованием тиомочевины |
|
|
44 |
||||||||||
|
|
S |
|
|
RX |
|
S |
|
NH3 |
|
|
NH |
|
|
|
|
|
|
|
|
|
|
RSH |
+ |
|
||
|
|
|
|
|
SN2 |
|
|
|
|
|
|
||
|
H N |
|
NH |
2 |
H N |
NH |
2 X |
- |
|
|
H3N |
NH2 |
|
|
2 |
|
|
|
2 |
|
|
|
|
|
|
||
«Настоящие» дикарбоновые кислоты |
|
|
|
|
|
||||||||
CO2H |
|
|
|
CO H |
|
CO2H |
|
|
CO H |
|
CO H |
||
|
|
|
2 |
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
2 |
|
2 |
CO2H |
|
|
|
|
|
|
|
|
|
CO H |
|
CO H |
|
|
|
|
|
|
CO2H |
|
CO2H |
|
|
2 |
|
2 |
|
Щ |
|
|
|
|
|
г |
|
|
|
А |
|||
авелевая |
|
М |
|
я |
|
|
|
|
|||||
|
|
|
алоновая |
|
нтарная |
|
лутаровая |
|
дипиновая |
||||
|
|
|
|
|
|
|
|||||||
|
|
|
Методы синтеза |
|
|
|
|
|
|
OH |
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
t |
CO2Na |
H3O+ |
CO2H |
+ e |
|
|
|
|
|
|
|
HCO Na |
|
|
|
|
|
||
|
|
|
|
|
|
|
2 |
|
CO2Na |
|
CO2H |
|
|
|
|
|
|
|
|
|
|
|
|
OH |
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH CO H |
Cl |
|
ClCH CO H |
1. NaOH |
CN |
|
H3O+ |
CO2H |
|
|||
|
2 |
|
|
|
|
|
|||||||
|
3 |
2 |
P |
2 |
2 |
2. NaCN |
|
|
|
CO2H |
|
||
|
|
|
|
|
CO2Na |
|
|||||||
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CO2Et |
|
|
+ |
|
CO2H |
45 |
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
+ CH3CO2Et |
EtO- |
|
|
|
H3O |
|
|
|
||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
EtO |
|
|
|
|
OEt |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CO2Et |
|
|
|
|
|
CO2H |
|
||||||
|
|
RCH2CO2H |
|
1. LDA |
R |
|
|
|
CO2H |
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
2. CO2 |
|
|
|
CO2H |
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
3. H2O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
Br |
|
|
|
|
|
|
|
|
|
CN |
H3O+ |
|
|
CO2H |
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
NaCN |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
Br |
|
|
|
|
|
|
|
|
|
CN |
|
|
|
|
|
|
|
|
|
|
|
CO2H |
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O2 |
|
|
|
|
|
|
|
|
|
O |
|
|
|
H2 |
|
|
|
|
O |
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
V2O5 |
|
|
|
|
|
|
Pd/C |
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
O |
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||
|
|
O |
|
OH |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
или |
|
|
|
|
|
|
|
или |
|
|
|
|
|
|
|
[O] |
|
HO2C |
|
|
CO2H |
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(CH2)n |
|
|||||||||||||
(H C) |
|
|
|
|
|
|
(H C) |
|
|
|
|
|
|
|
n(H2C) |
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||
n 2 |
|
|
|
|
|
n 2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
CO2- |
CO2Et |
46 |
+ e |
(CH2)2n+2 |
|
(CH ) |
Кольбе |
|
2 n |
|
|
CO Et |
CO2Et |
|
2 |
|
|
|
|
|
|
|
|
|
HO C |
|
HO2C |
|
N |
N |
O |
CO2Et |
|
2 |
|
|
|
COCl |
|
(CH ) |
1. N H |
(CH2)5 |
|||||
|
|
|
|
(CH2)n |
1. H O+ |
2 5 |
4 |
||
|
|
|
|
|
O |
2 |
|||
(CH2)n + |
|
|
|
|
3 |
|
2. HO- |
|
|
NEt3 |
|
|
|
2. HO |
- |
(CH ) |
(CH2)n |
||
CO2Et |
|
|
|
|
|
2 n |
3. H+ |
HO2C |
|
|
|
|
|
|
|
|
HO C |
|
|
|
|
|
|
|
|
|
2 |
|
|
Свойства дикарбоновых кислот Кислотность
кислота |
рК1 |
рК2 |
щавелевая |
1.27 |
4.23 |
|
|
|
малоновая |
2.87 |
5.70 |
|
|
|
янтарная |
4.16 |
5.61 |
|
|
|
глутаровая |
4.34 |
5.27 |
|
|
|
Причины:
•Индуктивный эффект карбоксильной
группы.
•Внутримолекулярная водородная
связь, стабилизирующая анион.
O |
H |
|
O |
H |
O- |
|
O- |
||
O |
O |
O |
|
O |
|
|
|
оксалат-анион малонат-анион

легкость окисление щавелевой кислоты |
46 |
CO2H |
KMnO |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
4 |
|
CO2 |
+ H2O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
CO2H |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
CO2Et |
диэтилоксалат - сложный эфир, не имеющий атомов водорода у |
|||||||||||||||||||||||||
|
|
α-углеродного атома - активная карбонильная компонента |
||||||||||||||||||||||||
|
|
в перекрестных конденсациях Кляйзена |
|
|
|
|
|
|
||||||||||||||||||
CO2Et |
|
|
|
|
|
|
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H2O |
|
|
|
|
|
|
|
|
|
|
||
|
Дегидратация |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CO2H |
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
O |
|
C |
|
C |
|
C |
|
O |
|
|
P2O5 |
|
~ 100o |
|||||||||
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH3CO2H |
||||||
|
|
|
|
|
|
|
|
|
|
|
t |
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
-CO2 |
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CO2H |
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
O |
H |
O |
|
|
|
|
|
OH |
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
Декарбоксилирование |
|
|
|
|
|
|
|
|
|
|
|
|
|
CH3CO2H |
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
-CO2 |
HO |
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
HO |
|
|
|
|
O |
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
Синтетические применения малонового (натрмалонового) эфира 
CO2H |
CO2Et |
|
EtO C |
устойчивый анион - |
EtOH |
|
EtONa |
2 |
|
H+ |
|
|
|
Na+ индуктивное влияние двух |
CO2Et |
|
EtO C |
акцепторных групп |
|
CO2H |
|
|
||
|
|
|
2 |
|

|
|
CO2H |
t |
R |
|
CO2H |
|
47 |
|
|
R |
|
|
|
|||
|
|
|
|
|
|
|||
|
|
CO2H |
|
|
|
|
|
|
|
|
H O+ |
|
|
|
|
|
|
|
|
3 |
|
|
|
|
|
|
CO2Et |
RX |
CO Et |
1. EtO- |
|
|
CO2Et |
+ |
R |
|
2 |
|
|
|||||
|
|
|
|
R |
|
H3O |
|
|
CO2Et SN2 |
R |
2. R'X |
|
|
CO2H |
|||
CO Et |
|
R' |
CO2Et |
t |
R' |
|||
|
|
2 |
|
|
|
|
||
R, R' = алкил
CO2Et |
|
|
EtO C |
|
ClCH2CO2Et |
2 |
|
|
|
||
|
|
|
|
CO2Et
Br
CO2Et  0.5 M
0.5 M
Br EtO2C

CO2Et |
|
CO2Et |
|
|
Br |
|
|
|
|
|
|
|
0.5 M |
|
CO2Et |
|
Br |
|
|
|
|
|
|
|
EtONa (2 M) |
|
CO2Et |
|
|
||
CO2Et H3O+  CO2H
CO2H
t
CO2Et |
CO2H |
CO2Et
|
H O+ |
|
CO2H |
|
|
||
CO2Et |
3 |
|
CO2H |
t |
|
||
|
H3O+ |
|
|
|
CO2H |
|
|
|
|
|||
|
|
|
|||
t |
|||||
|
|
|
|
Нуклеофильное присоединение к акцептороно-замещенному алкену (Михаэль) |
|
49 |
||||||
|
|
|||||||
|
|
|
|
CO2Et |
|
CO2Et |
X |
|
|
CO2Et |
|
|
|
H3O+ |
|||
|
EtO- (cat) |
CO2Et |
EtOH |
CO2Et |
||||
X |
+ |
EtOH |
EtO- |
t |
||||
CO Et |
X |
X |
|
|||||
|
2 |
|
|
|
|
|
|
|
X = CO Et, COR, NO , C |
N |
|
|
|
|
CO2H |
||
2 |
2 |
|
|
|
|
|
|
|
Например: |
|
|
|
|
|
|
|
|
|
|
|
|
CO2Et |
O |
EtO2C |
CO2Et |
|
|
CO2Et |
- |
|
|||||
|
|
|
|
|
+ |
|||
EtO2C |
+ |
|
EtO (cat) |
CO Et |
|
|
|
H3O |
|
CO2Et |
EtOH |
2 |
|
|
|
t |
|
|
CO2Et |
|
O |
|
||||
|
|
|
|
|
|
CO2Et |
||
CO2H
O
CO2H
CO Et |
|
EtO C |
|
CO Et |
|
|
CO2H |
2 |
I2 |
2 |
2 |
H3O+ |
|
|
|
|
|
|
|
|
|
|
|
CO2Et |
|
EtO2C |
|
CO2Et |
t |
|
CO2H |
|
|
|
|||||
|
|
|
|
||||
|
|
CO2Et |
EtO C |
|||||
|
|
|
|
I2 |
2 |
|||
R |
|
|
|
R |
|
|||
|
|
|
|
|
|
|
||
|
CO2Et |
|
||||||
|
|
EtO C |
||||||
|
|
|
|
|
|
|
2 |
|
|
Янтарная кислота |
O |
||||||
|
|
|
|
|
|
|
||
|
CO2H |
|
|
|||||
|
|
|
P2O5 |
|
|
O |
||
|
|
|
|
|
||||
|
|
|
t |
|
||||
|
|
|
|
|
||||
CO2H
O
n(H2C)
 CO2H P2tO5
CO2H P2tO5  CO2H
CO2H
50
CO2Et |
|
R |
CO2H |
|
H O+ |
|
|||
|
||||
|
R |
3 |
|
|
|
t |
|
||
|
|
|||
CO2Et |
|
|||
|
R |
CO2H |
||
|
|
|
O |
CO2H |
P O |
|
|
|
2 |
5 |
O |
CO2H |
|
t |
|
|
|
||
O
O O
(CH2)nO
Некоторые свойства ангидридов дикарбоновых кислот 
O |
RO |
O |
|
|
|
|
|
|
CO |
- |
|
CO2CH3 |
|
- |
|
|
CH3OH |
|||
|
O |
2 |
|
|||
O RO |
|
CO2CH3 |
H+ |
|
||
|
|
|
CO2CH3 |
|||
|
|
|
|
|||
O |
|
O |
моноэфир |
|
|
|
|
|
|
дикислоты |
|
|
|
