
Лекции / organic_2011_3
.pdf
МОДУЛЬ 2 (Часть 1) |
1 |
Галогенпроизводные |
Алкилгалогениды Методы получения
1.Свободно-радикальное галогенирование алканов
2.Присоединение галогеноводородов к алкенам и алкинам
3. Из спиртов |
ROH |
|
|
|
HX |
|
|
|
|
RX |
|
||||
|
|
|
(PX , PX , SOCl ) |
|
|
||||||||||
|
|
|
|
|
|
3 |
|
5 |
2 |
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
CX4/PPh3 |
|
|
|
|
||||
4. Реакция Бородина-Хунсдиккера |
|
|
|
|
|
|
|
||||||||
RCO2Ag |
|
Br2 |
RCO2 |
|
|
|
R |
|
Br2 |
RBr |
|||||
|
|
|
|
|
|
|
|
|
|
||||||
-AgBr |
- CO |
|
|
-Br |
|||||||||||
|
|
|
|
2 |
|
|
|
|
|||||||
|
|
|
R = алкил, арил) |
|
|
|
|
||||||||
|
|
|
RCO2H |
Br2 |
|
RBr |
|
|
|
||||||
|
|
|
HgO |
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||
2
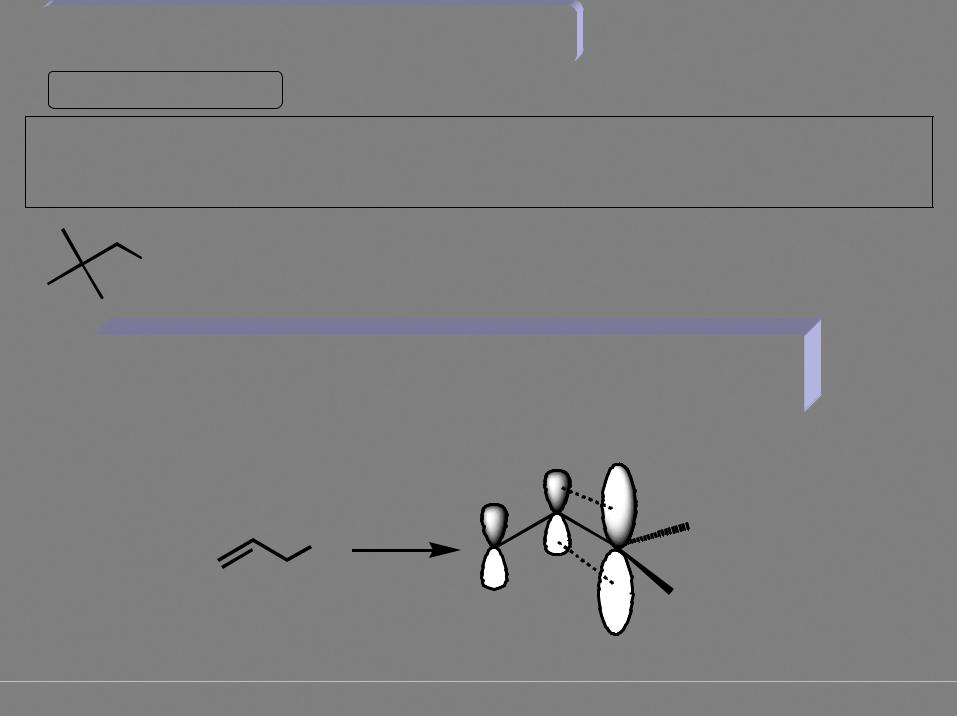
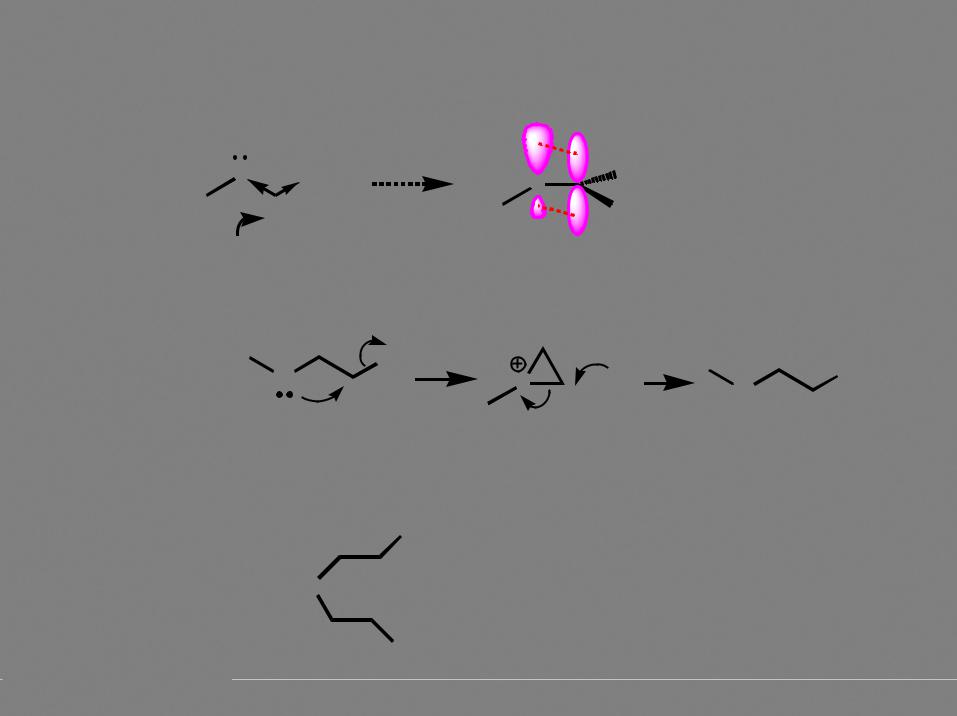
Реакции нуклеофильного замещения
Бимолекулярное нуклеофильное замещение (SN2)
Нуклеофил – молекула или частица, обладающая неподеленной парой электронов (основание Льюиса)
RX + Nu- |
|
|
RNu + X- |
|
|
E |
|
переходное |
||||||
|
|
|
|
|
|
|
||||||||
скорость реакции V = k[RX][Nu-] |
|
|
|
состояние |
||||||||||
|
|
|
|
|
|
|
||||||||
обращение конфигурации |
|
|
|
|
|
|
|
|
|
|||||
|
* |
|
NaI |
|
|
* |
|
|
|
|
|
|
|
|
|
|
ацетон |
|
|
|
|
|
|
|
|
|
|||
Cl |
|
|
|
|
I |
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
||||
R-изомер |
|
|
|
S-изомер |
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
||
Nu- |
δ+ |
δ- |
|
|
|
|
|
|
C |
X |
|
Nu |
|
X |
|
Nu |
|
|
|
|||||||
|
|
|
-X-
переходное состояние
3
Факторы, влияющие на скорость реакции
1. Строение скелета
Скорость реакции алкилгалогенидов изменяется в следующем ряду: первичные > вторичные. Третичные в реакцию по этому механизму не вступают (стерический фактор).
Х |
хотя алкилгалогенид и первичный, он малореакционноспособен |
|
(стерические затруднения у β-углеродного атома |
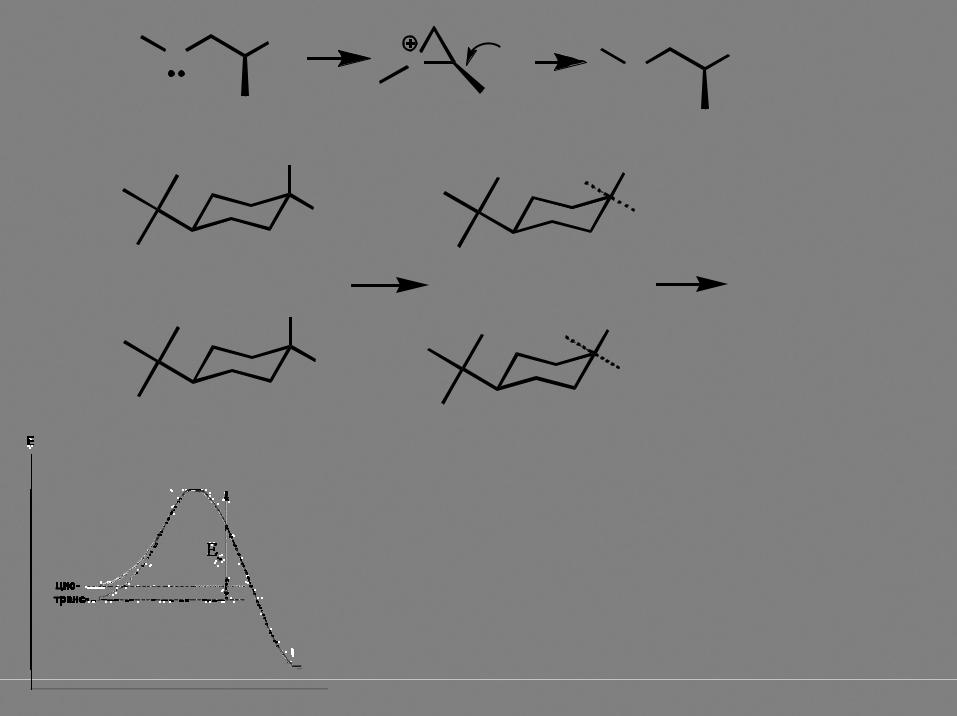
Бензилгалогениды и аллилгалогениды очень активны в реакции (стабилизация переходного состояния).
Nu
X Nu-
X
4
Гетероатомные заместители у того же атома углерода, что и уходящая группа, увеличивают частичный положительный заряд на этом атоме углерода, усиливая электростатическое притягивание нуклеофила к нему.
|
|
X |
|
|
Y δ+ X |
|
Y |
|
|
|
|
|
||
Nu- |
|
Nu |
|
|
стабилизация переходного |
|
|||
Анхимерное содействие |
состояния |
|
||
X |
|
Nu- |
Nu |
|
Y |
Y |
|||
-X- |
|
Y |
||
быстропротекающее |
быстропротекающее |
|||
межмолекулярное |
||||
внутримолекулярное |
||||
SN2-замещение |
||||
SN2-замещение |
|
|||
Cl
S
|
|
Cl |
RN(CH2CH2Cl)2 |
|
|
||
|
|
азотистые иприты |
|
иприт |
(цитостатики, ОВ) |
||

5
Дератизация сухогрузов
EtCl
|
|
X |
|
|
|
|
|
|
6 |
Y |
* |
Y |
* |
Nu- |
|
|
* |
Nu |
|
-X- |
|
Y |
|||||||
|
|
|
|
|
|||||
|
S |
|
|
R |
|
|
|
S |
|
|
|
H |
|
|
|
Nu |
H |
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
Y |
|
|
|
|
Y |
|
|
|
|
|
Nu- |
|
|
|
|
|
продукты |
|
|
Y |
|
|
|
|
|
-Y- |
|
|
|
|
|
|
Y |
H |
|
||
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
H |
|
|
|
|
Nu |
|
|
цис-изомер реагирует быстрее!
|
|
O |
|
|
|
|
|
O |
|
|
|
|
|
|
O |
|
|
|
|
O |
|
7 |
|||||||||
|
|
|
|
|
|
|
X |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
X |
|
|
|
|
|
|
|
|
|
* Nu |
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
* |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
* |
|
|
|
|
* |
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
SN |
Nu |
SN2 |
|
|
-Nu |
- |
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||
Nu- |
|
|
|
|
|
Nu |
|
|
|
|
|
|
Nu |
|
|
||||||||||||||||
|
|
|
|
|
S |
|
|
|
|
|
|
|
|
2 |
|
|
Nu- |
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
S |
|
|
|
|
|
|
R |
|
|
|
|
|
S |
|
|
|
|||
|
|
|
|
|
|
|
нуклеофильное |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
O |
присоединение |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
* |
Nu |
|
сохранение конфигурации асимметрического центра |
|
|
|
|||||||||||||||||||||
|
|
|
|
|
|
||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
S |
|
|
O- |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
O- |
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
H O |
O |
|
|
|
SN2 |
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
O |
|
* |
2 |
|
|
|
|
* |
|
|
|
|
|
|
* |
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
SN |
|
|
|
|
|
-H+ O |
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
X |
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
R |
|
2 |
|
|
H2O |
S |
|
|
|
R |
OH |
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
Ag+ |
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
электрофильный катализатор |
|
|
сохранение конфигурации асимметрического центра |
||||||||||||||||||||||||||||
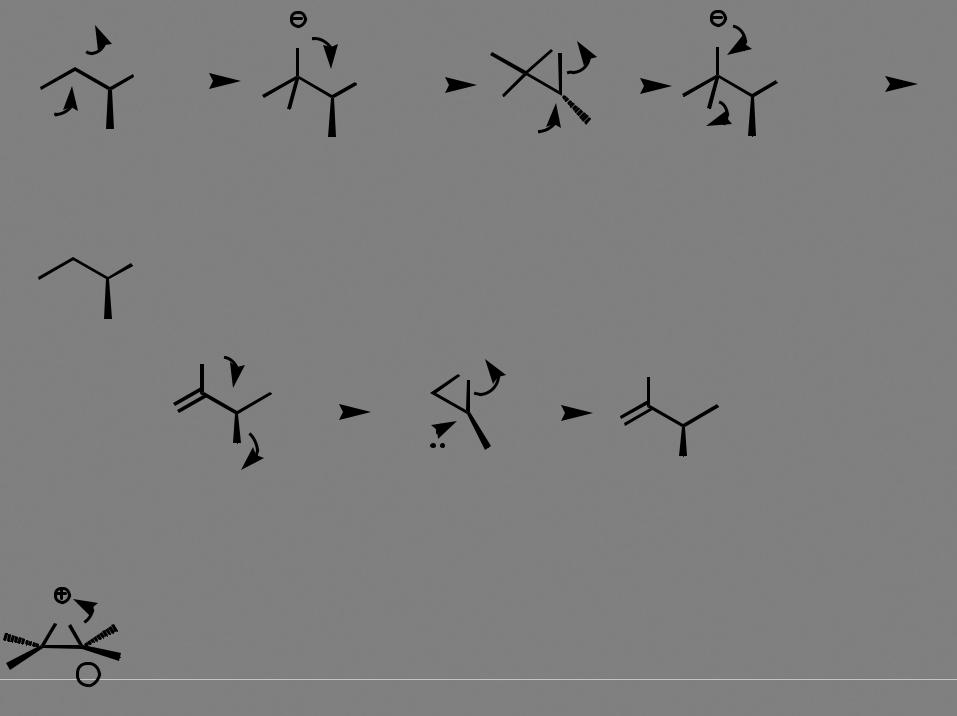
Br |
раскрытие бромониевого катиона (электрофильное присоединение брома к алкенам) |
||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
происходит по бимолекулярному механизму нуклеофильного замещения SN2! |
||||||||||||||||||||||||
Br-
8
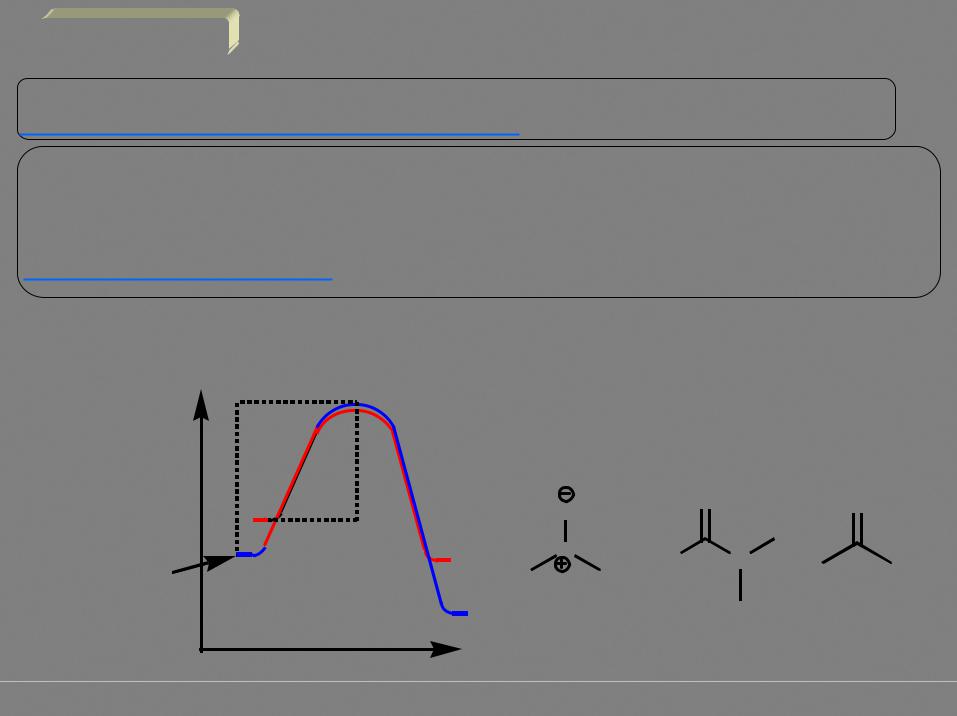
2. Растворитель 
а. Скорость реакции пропорциональна концентрациям реагентов (они должны растворяться в подходящем растворителе)
б. Полярные исходные (нуклеофил) и конечные продукты (уходящая группа) и малополярное переходное состояние – в полярных растворителях (особенно протонных) хорошо сольватируются исходные и конечные, но мало сольватировано переходное состояние, что повышает энергию активации и снижает скорость реакции
|
E |
|
|
|
|
E2 |
|
|
|
|
E1 |
|
O |
O |
|
O |
|
||
более полярный |
S |
H |
N |
|
растворитель |
|
|
||
E2 > E1 |
ДМСО |
|
ДМФА |
ацетон |
|
|
|
H-RX |
|
RX-H |
H-XR |
|
Nu- |
||
|
||
RX-H |
H-XR |
|
|
||
|
RX-H |
сольватация нуклеофила  протонными растворителями
протонными растворителями
в. Природа нуклеофила 
9
S
 O S
O S
 S
S O
O  O
O


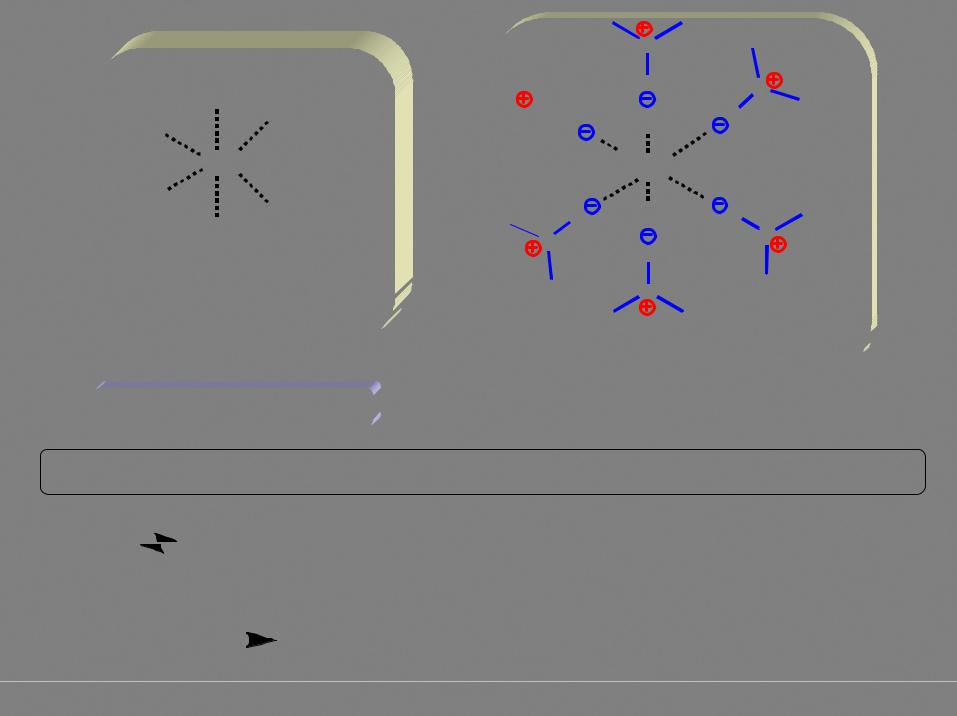
 M+
M+
O  O
O
 S
S O S
O S
S
сольватация катиона апротонным диполярным растворителем
диполярным растворителем 
Нуклеофил = основание, но основность и нуклеофильность могут не совпадать!
|
|
- |
+ |
|
|
|
|
|
|
|
|
|
положение равновесия, определяемое основностью |
|||||||
Nu |
|
+ H |
|
|
|
|
|
|
NuH |
|
(основность - термодинамическая характеристика) |
|||||||||
|
|
|
|
|
|
|
||||||||||||||
Nu |
- |
+ |
|
|
|
|
|
δ+ |
|
|
|
|
|
|
|
нуклеофильность - параметр, определяющий скорость |
||||
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
C |
|
|
X |
|
|
|
C |
|
Nu |
реакции (кинетическая характеристика) |
||||||
|
|
|
|
|
|
- |
||||||||||||||
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
-X |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|

10
кислотность: HI > HBr > HCl > HF
Причина - большая устойчивость большего по размеру аниона
основность - F- > Cl- > Br- > I-
сила нуклеофила впротонном растворителе: I- > Br- > Cl- > F-
Причина - увеличение эффективности сольватации, приводящей к делокализации заряда с уменьшением размера аниона
сила нуклеофила в апротонном растворителе: F- > Cl- > Br- > I-
Причина - отсутствие сольватации аниона приводит к увеличению плотности заряда на анионе с уменьшением его размера
Депротонированная форма является более сильным нуклеофилом, чем протонированная
чем протонированная
H2O более слабый нуклеофил, чем HO-
ROH более слабый нуклеофил, чем RO-
NH3 более слабый нуклеофил, чем NH2-
Сила нуклеофила увеличивается с его поляризуемостью (с увеличением размера атома - нуклеофильного центра
RO- более слабый нуклеофил, чем RS-, NH3 - более слабый, чем PH3
