
- •Р.Б.Николаева, а.С.Казаченко
- •Введение
- •Номенклатура и классификация неорганических соединений Вводная часть
- •Номенклатура неорганических соединений июпак
- •Традиционные названия сложных соединений
- •Классификация неорганических веществ
- •Вопросы к семинару
- •Техника безопасности Общие правила работы в химической лаборатории
- •Общие правила работы с химическими реактивами
- •Ядовитые и вредные вещества
- •Химические ожоги
- •Меры по предупреждению пожаров, возгораний и взрывов
- •Поражение электрическим током
- •Искусственное дыхание
- •Наружный массаж сердца
- •Меры первой помощи при кровотечениях от порезов
- •Меры предосторожности при мытье посуды
- •Вопросы к семинару
- •Правила оформления отчета по лабораторным работам
- •Техника лабораторных работ
- •1. Работа со стеклом и пробками
- •2. Взвешивание
- •3. Определение концентрации раствора. Фильтрование
- •Вопросы к семинару
- •Эквивалент
- •Лабораторная работа «Определение мольной массы эквивалентов»
- •Вопросы к семинару
- •Способы выражения состава раствора
- •Лабораторная работа «Приготовление растворов»
- •Вопросы к семинару
- •Термохимия
- •Лабораторная работа «Определение тепловых эффектов»
- •Вопросы к семинару
- •Химическое равновесие
- •Лабораторная работа «Равновесие»
- •Вопросы к семинару
- •Скорость химических реакций
- •Лабораторная работа «Скорость химических реакций»
- •Вопросы к семинару
- •Вопросы к коллоквиуму I
- •Задачи к коллоквиуму I
- •Растворимость электролитов
- •Лабораторная работа «Растворимость и пр»
- •Вопросы к семинару
- •Электролитическая диссоциация
- •Лабораторная работа «Электролитическая диссоциация»
- •Вопросы к семинару
- •Методика решения задач
- •Гидролиз солей
- •Лабораторная работа «Гидролиз солей»
- •Вопросы к семинару
- •Коллоидные растворы
- •Лабораторная работа «Коллоидные растворы»
- •Вопросы к семинару
- •Редокс-процессы
- •Лабораторная работа «овр»
- •Вопросы к семинару
- •Электрохимия
- •Лабораторная работа «Электрохимия»
- •Вопросы к семинару
- •Комплексные соединения
- •Лабораторная работа «Получение и свойства кс»
- •Вопросы к семинару
- •Вопросы к коллоквиуму II
- •Лабораторная работа «Очистка веществ»
- •Вопросы к семинару
- •Библиографический список
- •Оглавление
Лабораторная работа «Очистка веществ»
1. Очистка воды от растворенных в ней веществ перегонкой. Собрать прибор (рис.15). В колбу Вюрца(1) на 0,5л налить 250мл сульфата меди (предварительно измерив его плотность ареометром) и опустить в раствор несколько кусочков пемзы. (Зачем?)
З охладитель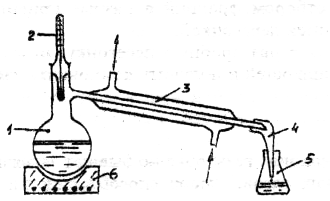
Н
Рис.15.
Прибор для очистки воды от растворенных
в ней нелетучих веществ.
2. Очистка иода возгонкой. В стакан для возгонки поместите 0,3г кристаллического иода и 0,1г иодида калия (для удаления примесей Cl2 и Br2, содержащихся в иоде), и перемешайте стеклянной палочкой. Круглодонной колбой с холодной водой накройте стакан и осторожно нагрейте его через асбестовую сетку (табл.6). После прекращения выделения паров (какого цвета?) отделите кристаллы от колбы, взвесьте их и определите процент выхода иода.
3. Очистка
пятиводного сульфата меди перекристаллизацией.
Рассчитать количество воды и ![]() ,
нужное для приготовления раствора,
насыщенного при 600С,
чтобы при последующем его охлаждении
до 00С
выделилось 7г
кристаллогидрата, используя следующие
данные:
,
нужное для приготовления раствора,
насыщенного при 600С,
чтобы при последующем его охлаждении
до 00С
выделилось 7г
кристаллогидрата, используя следующие
данные:
|
T0C |
0 |
10 |
20 |
30 |
40 |
50 |
60 |
80 |
100 |
|
S, г/100 г H2O |
12.9 |
14.8 |
17.2 |
20.0 |
22.8 |
25.1 |
28.1 |
34.9 |
42.4 |
Обычно пентагидрат содержит примеси хлорида калия, а также песок и кусочки угля. Поэтому для очистки отвесьте исходной соли на 10% больше рассчитанной массы. Отмерьте цилиндром нужный объем воды, вылейте в стакан на 50мл, вскипятите воду и растворите в ней при перемешивании навеску очищаемой соли.
Убедитесь, что хлорид-ионы есть в приготовленном растворе. Для этого к 3каплям его добавьте каплю раствора AgNO3 и две капли азотной кислоты. Что наблюдается? Почему? Затем нагретый до кипения раствор сульфата меди отфильтруйте через складчатый фильтр, приготовленный заранее.
Помешивая фильтрат стеклянной палочкой, охладите его до комнатной температуры, а потом до 00С в кристаллизаторе с водой и льдом. Выпавшие кристаллы отделите от маточного раствора фильтрованием и промойте их (зачем?) 5‑10мл холодной дистиллированной воды. Раствор очищенной соли, маточный раствор, и промывные воды испытайте на хлорид-ионы и сделайте выводы.
Затем снимите кристаллы соли с воронки и отжимайте их между листами фильтровальной бумаги до тех пор, пока они не перестанут прилипать к сухой стеклянной палочке. Взвесьте на технохимических весах полученную соль. Оцените массу соли в процентах по отношению к исходной навеске. Чем объясняется сравнительно низкий выход продукта, очищенного методом перекристаллизации?
4. Очистка углекислого газа. Колбу Вюрца наполнить на 1/5 объема кусочками мрамора, присоединить к ней газоотводную трубку, добавить 30мл 20%-го раствора HCl и сразу закрыть колбу пробкой. Что наблюдается? Чем может быть загрязнен получающийся при этом углекислый газ?
Пропускать выделяющийся газ в течение 10–15мин через склянку Дрекселя с дистиллированной водой и последовательно с ней соединенную хлоркальциевую трубку, наполненную обезвоженным сульфатом меди. (Как изменяется его цвет? Почему?). Испытать содержимое промывной склянки на присутствие ионов Cl– и H+, используя раствор AgNO3 и индикаторную бумагу соответственно. Сделать выводы.
