
- •Р.Б.Николаева, а.С.Казаченко
- •Введение
- •Номенклатура и классификация неорганических соединений Вводная часть
- •Номенклатура неорганических соединений июпак
- •Традиционные названия сложных соединений
- •Классификация неорганических веществ
- •Вопросы к семинару
- •Техника безопасности Общие правила работы в химической лаборатории
- •Общие правила работы с химическими реактивами
- •Ядовитые и вредные вещества
- •Химические ожоги
- •Меры по предупреждению пожаров, возгораний и взрывов
- •Поражение электрическим током
- •Искусственное дыхание
- •Наружный массаж сердца
- •Меры первой помощи при кровотечениях от порезов
- •Меры предосторожности при мытье посуды
- •Вопросы к семинару
- •Правила оформления отчета по лабораторным работам
- •Техника лабораторных работ
- •1. Работа со стеклом и пробками
- •2. Взвешивание
- •3. Определение концентрации раствора. Фильтрование
- •Вопросы к семинару
- •Эквивалент
- •Лабораторная работа «Определение мольной массы эквивалентов»
- •Вопросы к семинару
- •Способы выражения состава раствора
- •Лабораторная работа «Приготовление растворов»
- •Вопросы к семинару
- •Термохимия
- •Лабораторная работа «Определение тепловых эффектов»
- •Вопросы к семинару
- •Химическое равновесие
- •Лабораторная работа «Равновесие»
- •Вопросы к семинару
- •Скорость химических реакций
- •Лабораторная работа «Скорость химических реакций»
- •Вопросы к семинару
- •Вопросы к коллоквиуму I
- •Задачи к коллоквиуму I
- •Растворимость электролитов
- •Лабораторная работа «Растворимость и пр»
- •Вопросы к семинару
- •Электролитическая диссоциация
- •Лабораторная работа «Электролитическая диссоциация»
- •Вопросы к семинару
- •Методика решения задач
- •Гидролиз солей
- •Лабораторная работа «Гидролиз солей»
- •Вопросы к семинару
- •Коллоидные растворы
- •Лабораторная работа «Коллоидные растворы»
- •Вопросы к семинару
- •Редокс-процессы
- •Лабораторная работа «овр»
- •Вопросы к семинару
- •Электрохимия
- •Лабораторная работа «Электрохимия»
- •Вопросы к семинару
- •Комплексные соединения
- •Лабораторная работа «Получение и свойства кс»
- •Вопросы к семинару
- •Вопросы к коллоквиуму II
- •Лабораторная работа «Очистка веществ»
- •Вопросы к семинару
- •Библиографический список
- •Оглавление
Лабораторная работа «Получение и свойства кс»
ПРИМЕЧАНИЕ. При оформлении отчета привести уравнения всех проведенных реакций (указать, к какому типу они относятся) в молекулярном и сокращенном ионном виде, дать названия комплексных соединений, фигурирующих в них.
1). Изомерия комплексных соединений. Несколько кристаллов хлорида хрома(III) растворить в минимальном количестве воды. Отметить цвет полученного раствора (какие частицы обеспечивают окраску?) и разделить его на две пробирки. Одну оставить в качестве контрольной, а вторую нагреть на водяной бане до изменения цвета раствора. Можно ли объяснить изменение окраски с позиции ТКП?
2. Сравнение устойчивости циклических и нециклических КС
а) Получение нециклического КС никеля(II). К 0,5 мл соли никеля(II) добавлять по каплям концентрированный аммиак до растворения выпадающего вначале осадка (какого цвета?). Отметить окраску раствора и сохранить его для опыта «в».
б)Получение циклического комплекса никеля(II). К 2 каплям раствора соли никеля в пробирке добавить 4 капли реактива Чугаева (раствора смеси аммиака и диметилглиоксима С4Н6(NOH)2). Что наблюдается? Полученный раствор диметилглиоксимата никеля:
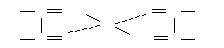

сохранить для опыта «в». Почему в данных условиях не образуется аммиачное КС?
Сравнить цвета комплексов, синтезированных по пунктам «а» и «б» и окраску исходного раствора соли никеля(II). Можно ли объяснить различие с позиции ТКП?
в). Сравнение
устойчивости. К исходному раствору соли
никеля(II) и к растворам,
полученным в опытах «а» и «б» (отобрав
их по 6капель в разные
пробирки), добавить по 4 капли 2М NaOH.
Что наблюдается? Почему? Используя
справочные данные, рассчитать концентрацию
![]() в водном растворе над осадком гидроксида
никеля(II) и в 0,1М растворе
аммиачного комплекса никеля(II),
если
в водном растворе над осадком гидроксида
никеля(II) и в 0,1М растворе
аммиачного комплекса никеля(II),
если ![]() равна 1моль/л. Сделать
вывод. Согласуется ли он с результатами
данного опыта.
равна 1моль/л. Сделать
вывод. Согласуется ли он с результатами
данного опыта.
3. Влияние на устойчивость комплекса:
а) природы
комплексообразователя и природы аниона
внешней сферы. Получить хлорид серебра,
добавив к 10 каплям нитрата серебра 20
капель хлорида натрия. Отделить осадок
от раствора (центрифугированием) и
добавить к нему по каплям 10%-ый аммиак
при тщательном перемешивании до
растворения, не больше! Полученный
раствор разделить на 3 пробирки. В одну
добавить 4 капли сульфата никеля(II).
(Что происходит и почему?1).
В другую – раствора бромида натрия, в
третью – иодида калия. Отметить
наблюдаемые явления и дать им объяснения,
используя справочные величины ПР
соответствующих галидов серебра
(табл.12) и значение
констант нестойкости2
ионов ![]() и
и
![]() .
.
Помните! Все растворы и осадки, содержащие серебро, сливать в специальную банку, приготовленную препаратором!
б) природы лиганда.
0,3г безводной соли
сульфата меди (отметить ее цвет) растворить
в 6мл воды. (Наличие
каких ионов обеспечивает появившуюся
окраску?) Половину полученного раствора
распределить в 4пробирки,
а ко второй половине добавить по каплям
и при перемешивании концентрированный
аммиак до растворения образующегося
вначале осадка ![]() (каков его цвет?). Отметить окраску
раствора. Наличие каких ионов ее
обеспечивает? Полученный раствор разлить
тоже в 4пробирки, но
другого ряда. В первые пробирки обоих
рядов добавить по 6капель
хлорида бария, во вторые – по 2капли
2М щелочи, в третьи – по 6капель
1М серной кислоты, а в четвертые – по
4капли сульфида натрия.
Отметить наблюдаемые внешние эффекты,
объяснить их и сделать вывод о сравнительной
устойчивости гидратных и аммиачных
комплексов меди(II). Почему
сульфид-ионы в отличие от гидроксид-ионов
разрушают оба комплекса?
(каков его цвет?). Отметить окраску
раствора. Наличие каких ионов ее
обеспечивает? Полученный раствор разлить
тоже в 4пробирки, но
другого ряда. В первые пробирки обоих
рядов добавить по 6капель
хлорида бария, во вторые – по 2капли
2М щелочи, в третьи – по 6капель
1М серной кислоты, а в четвертые – по
4капли сульфида натрия.
Отметить наблюдаемые внешние эффекты,
объяснить их и сделать вывод о сравнительной
устойчивости гидратных и аммиачных
комплексов меди(II). Почему
сульфид-ионы в отличие от гидроксид-ионов
разрушают оба комплекса?
в) ионной силы раствора. Налить в пробирку по 1мл хлорида железа и роданида аммония. Отметить интенсивность окраски полученного раствора. Разделить его на 3 пробирки. Первую оставить для сравнения, во вторую насыпать лопаточку хлорида аммония, а в третью – сульфата калия. Отметить изменение интенсивности окраски растворов, объяснить происходящие явления.
г) природы растворителя. Смешать в пробирке по 8капель насыщенных растворов хлорида кобальта(II) и роданида аммония. Отметить цвет раствора. Разделить его на двепробирки. В одну добавить 6капель амилового спирта, в другую – 12капель воды и тщательно перемешать. Объяснить наблюдаемые явления.
Рассчитать
концентрацию ионов кобальта в водном
растворе, одномолярном по роданиду
аммония и по роданидному КС: ![]() ,
если
,
если ![]() .
Отметить, к какому типу соединений
(комплексных или двойных солей) можно
отнести полученное вещество по отношению
к воде. А по отношению к амиловому спирту?
.
Отметить, к какому типу соединений
(комплексных или двойных солей) можно
отнести полученное вещество по отношению
к воде. А по отношению к амиловому спирту?
4. Процессы, протекающие без разрушения комплекса
а). Цианидные комплексы железа.
(1)
К 2каплям раствора
желтой кровяной соли ![]() добавить 3капли раствора
сульфата меди(II). Отметить
и объяснить внешний эффект реакции.
добавить 3капли раствора
сульфата меди(II). Отметить
и объяснить внешний эффект реакции.
(2)
Прибавлять (по каплям и при перемешивании)
раствор желтой кровяной соли ![]() к кристаллику иода в пробирке до полного
его растворения. Как доказать, что при
этом произошла ОВР?
к кристаллику иода в пробирке до полного
его растворения. Как доказать, что при
этом произошла ОВР?
(3)
К 4каплям раствора
иодида калия добавить по 3капли
2М HCl, бензина и раствора
красной кровяной соли![]() .
Тщательно перемешать, дождаться
расслоения жидкостей. Изменилась ли
окраска слоя бензина? Почему?
.
Тщательно перемешать, дождаться
расслоения жидкостей. Изменилась ли
окраска слоя бензина? Почему?
б). Аквакомплексы железа. Повторить опыты (2) и (3), взяв вместо желтой и красной кровяных солей соответственно растворы соли Мора и хлорида железа(III).
Рассчитать ![]() проведенных процессов
и сделать выводы.
Можно ли снижение ОВП, наблюдаемое при
переходе от аквакомплексов железа(II)
и (III) к их цианидным
комплексам, объяснить с позиции ТКП?
проведенных процессов
и сделать выводы.
Можно ли снижение ОВП, наблюдаемое при
переходе от аквакомплексов железа(II)
и (III) к их цианидным
комплексам, объяснить с позиции ТКП?
