
- •Р.Б.Николаева, а.С.Казаченко
- •Введение
- •Номенклатура и классификация неорганических соединений Вводная часть
- •Номенклатура неорганических соединений июпак
- •Традиционные названия сложных соединений
- •Классификация неорганических веществ
- •Вопросы к семинару
- •Техника безопасности Общие правила работы в химической лаборатории
- •Общие правила работы с химическими реактивами
- •Ядовитые и вредные вещества
- •Химические ожоги
- •Меры по предупреждению пожаров, возгораний и взрывов
- •Поражение электрическим током
- •Искусственное дыхание
- •Наружный массаж сердца
- •Меры первой помощи при кровотечениях от порезов
- •Меры предосторожности при мытье посуды
- •Вопросы к семинару
- •Правила оформления отчета по лабораторным работам
- •Техника лабораторных работ
- •1. Работа со стеклом и пробками
- •2. Взвешивание
- •3. Определение концентрации раствора. Фильтрование
- •Вопросы к семинару
- •Эквивалент
- •Лабораторная работа «Определение мольной массы эквивалентов»
- •Вопросы к семинару
- •Способы выражения состава раствора
- •Лабораторная работа «Приготовление растворов»
- •Вопросы к семинару
- •Термохимия
- •Лабораторная работа «Определение тепловых эффектов»
- •Вопросы к семинару
- •Химическое равновесие
- •Лабораторная работа «Равновесие»
- •Вопросы к семинару
- •Скорость химических реакций
- •Лабораторная работа «Скорость химических реакций»
- •Вопросы к семинару
- •Вопросы к коллоквиуму I
- •Задачи к коллоквиуму I
- •Растворимость электролитов
- •Лабораторная работа «Растворимость и пр»
- •Вопросы к семинару
- •Электролитическая диссоциация
- •Лабораторная работа «Электролитическая диссоциация»
- •Вопросы к семинару
- •Методика решения задач
- •Гидролиз солей
- •Лабораторная работа «Гидролиз солей»
- •Вопросы к семинару
- •Коллоидные растворы
- •Лабораторная работа «Коллоидные растворы»
- •Вопросы к семинару
- •Редокс-процессы
- •Лабораторная работа «овр»
- •Вопросы к семинару
- •Электрохимия
- •Лабораторная работа «Электрохимия»
- •Вопросы к семинару
- •Комплексные соединения
- •Лабораторная работа «Получение и свойства кс»
- •Вопросы к семинару
- •Вопросы к коллоквиуму II
- •Лабораторная работа «Очистка веществ»
- •Вопросы к семинару
- •Библиографический список
- •Оглавление
Вопросы к семинару
1. Техника лабораторных работ со стеклом (разрезание, сгибание, оплавление, запаивание трубок, изготовление капилляров).
2. Правила подбора и сверления пробок.
3. Химическая посуда, указать назначение каждой. Мытье химической посуды. Как проверить ее чистоту?
4. Какую посуду называют мерной, а какую – измерительной? Правила работы с нею. Устройство и назначение промывалки.
5. Схема конструкции лабораторных весов. Правила взвешивания.
6. Какое физическое свойство в жидкостных термометрах используется при определении температуры? Какие жидкости, кроме ртути, можно применять для этой цели?
7. Ареометры. Их назначение, точность определения с помощью денсиметра. Правила пользования ареометром.
8. Различные способы отделения осадка от раствора: фильтрование (для чего используют складчатый фильтр?), декантация, центрифугирование. Указать недостатки и преимущества каждого. Что такое центрифугат, фильтрат? Виды фильтров. Фильтрование с обогревом, под вакуумом. Как провести фильтрование, если имеется всего 3 капли мутного раствора?
Эквивалент
Эквивалентом
вещества в реакциях
обмена называется его
реальная
частица (атом, ион, молекула) или условная
(нереальная) частица (доля атома, иона,
молекулы), которая равноценна иону ![]() .
Реальные частицы – это, в частности,
однозарядные ионы
.
Реальные частицы – это, в частности,
однозарядные ионы ![]() ,
,
![]() ,
,
![]() и т.п., а условная – например, треть
молекулы фосфорной кислоты
и т.п., а условная – например, треть
молекулы фосфорной кислоты ![]() (т.е. ее фактор эквивалентности (f)
равен 1/3) [8].
(т.е. ее фактор эквивалентности (f)
равен 1/3) [8].
В окислительно-восстановительных реакциях (ОВР) эквивалент – это частица вещества, участвующая в передаче 1 электрона (е):
![]() или
или ![]() .
.
Данные
частицы – реальные;
а условной
в ОВР является, например, ![]() при осуществлении процесса в нейтральной
среде. (В этих условиях перманганат-ион
принимает 3 электрона, следовательно,
1е присоединяется к
1/3 данного аниона, т.е.
при осуществлении процесса в нейтральной
среде. (В этих условиях перманганат-ион
принимает 3 электрона, следовательно,
1е присоединяется к
1/3 данного аниона, т.е. ![]() [8]). Мольная масса эквивалентов вещества
рассчитывается по формуле:
[8]). Мольная масса эквивалентов вещества
рассчитывается по формуле: ![]() ,
и может быть определена экспериментально,
как описано ниже.
,
и может быть определена экспериментально,
как описано ниже.
Лабораторная работа «Определение мольной массы эквивалентов»
С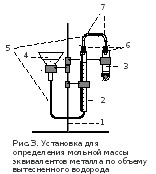 обрать
установку (рис.3). Она
состоит из штатива(1),
на котором крепятся бюретка на 50мл(2),
реакционная пробирка(3)1
и стеклянная воронка(4),
соединенные между собой резиновыми
шлангами(5), пробками
с отверстиями(6) и
стеклянными трубками(7).
обрать
установку (рис.3). Она
состоит из штатива(1),
на котором крепятся бюретка на 50мл(2),
реакционная пробирка(3)1
и стеклянная воронка(4),
соединенные между собой резиновыми
шлангами(5), пробками
с отверстиями(6) и
стеклянными трубками(7).
Бюретку укрепить на штативе так, чтобы нулевое деление оказалось на уровне глаз наблюдателя. Не присоединяя пробирку, заполнить установку (через воронку) водой. Уровень ее в бюретке должен быть на нулевом делении, а в воронке – находиться в средней ее части.
Проверить установку на герметичность. Для этого присоединить пробирку и опустить воронку вниз на 15–20см. Уровень воды в бюретке несколько опустится и останется постоянным (если установка негерметична, то уровень воды в бюретке будет непрерывно опускаться, приближаясь к уровню воды в воронке).
После проверки герметичности отсоединить пробирку, на дно ее поместить взвешенную (с точностью до 0,001г) навеску исследуемого металла (около 0,02г Zn или 0,009г Mg или Al). Затем быстро, чтобы избежать потерь водорода, прилить двукратный избыток 1М H2SO4 к навеске цинка или магния, а в случае алюминия – 10% щелочь и сразу же плотно присоединить пробирку к установке.
Взаимодействие кислоты с цинком идет при комнатной температуре, а с железом требует нагрева (для чего погружают реакционный сосуд в стакан с горячей водой). Реакцию алюминия со щелочью следует ускорить нагреванием в конце опыта.
Водород, выделяющийся в результате взаимодействия металла с раствором кислоты или щелочи, вытесняет из бюретки воду. Воронку при этом надо опускать и стараться держать воду в ней и в бюретке на одном уровне, чтобы давление газа внутри установки было все время близким атмосферному.
Когда весь металл растворится, прекратится и понижение уровня воды в бюретке, однако окончательный отсчет показаний делается лишь после того, как пробирка охладится до комнатной температуры, и только после приведения к одному уровню жидкости в бюретке и в воронке.
Записать в отчет массу металла – m, г; объем вытесненного газа в условиях опыта – V, мл; температуру опыта – t, 0C; давление по барометру – p, атм.; давление насыщенного пара воды при температуре опыта – h, ммрт.ст. (см.табл.7).
Таблица 7. Зависимость давления водяного пара (в миллиметрах рт.ст.) от t (0С)
|
Температура |
Давление |
Температура |
Давление |
Температура |
Давление |
|
1 |
4,93 |
11 |
9,84 |
21 |
18,65 |
|
2 |
5,29 |
12 |
10,52 |
22 |
19,83 |
|
3 |
5,68 |
13 |
11,23 |
23 |
21,07 |
|
4 |
6,10 |
14 |
11,99 |
24 |
22,38 |
|
5 |
6,54 |
15 |
12,79 |
25 |
23,76 |
|
6 |
7,01 |
16 |
13,63 |
26 |
25,21 |
|
7 |
7,51 |
17 |
14,53 |
27 |
26,74 |
|
8 |
8,05 |
18 |
15,48 |
28 |
28,35 |
|
9 |
8,61 |
19 |
16,48 |
29 |
30,04 |
|
10 |
9,21 |
20 |
17,54 |
30 |
31,82 |
Привести объем выделившегося водорода к нормальным условиям (н.у.), при этом надо учесть, что общее давление газа в бюретке, равное атмосферному р, складывается из парциальных давлений водорода и водяного пара. Таким образом, объем водорода при н.у. определяется по формуле1:
![]() .
.
Затем
рассчитать мольную массу эквивалентов
металла, соответствующую 1,008г
водорода (по объему – 11200мл
![]() ),
используя равенство:
),
используя равенство: ![]() .
.
Опыт
провести два раза, величину ![]() найти как среднее из двух определений.
Сравнить полученное ее значение с
рассчитанным по формуле:
найти как среднее из двух определений.
Сравнить полученное ее значение с
рассчитанным по формуле: ![]() и оценить абсолютную и относительную
ошибку эксперимента. Чем она обусловлена?
и оценить абсолютную и относительную
ошибку эксперимента. Чем она обусловлена?
