
- •Р.Б.Николаева, а.С.Казаченко
- •Введение
- •Номенклатура и классификация неорганических соединений Вводная часть
- •Номенклатура неорганических соединений июпак
- •Традиционные названия сложных соединений
- •Классификация неорганических веществ
- •Вопросы к семинару
- •Техника безопасности Общие правила работы в химической лаборатории
- •Общие правила работы с химическими реактивами
- •Ядовитые и вредные вещества
- •Химические ожоги
- •Меры по предупреждению пожаров, возгораний и взрывов
- •Поражение электрическим током
- •Искусственное дыхание
- •Наружный массаж сердца
- •Меры первой помощи при кровотечениях от порезов
- •Меры предосторожности при мытье посуды
- •Вопросы к семинару
- •Правила оформления отчета по лабораторным работам
- •Техника лабораторных работ
- •1. Работа со стеклом и пробками
- •2. Взвешивание
- •3. Определение концентрации раствора. Фильтрование
- •Вопросы к семинару
- •Эквивалент
- •Лабораторная работа «Определение мольной массы эквивалентов»
- •Вопросы к семинару
- •Способы выражения состава раствора
- •Лабораторная работа «Приготовление растворов»
- •Вопросы к семинару
- •Термохимия
- •Лабораторная работа «Определение тепловых эффектов»
- •Вопросы к семинару
- •Химическое равновесие
- •Лабораторная работа «Равновесие»
- •Вопросы к семинару
- •Скорость химических реакций
- •Лабораторная работа «Скорость химических реакций»
- •Вопросы к семинару
- •Вопросы к коллоквиуму I
- •Задачи к коллоквиуму I
- •Растворимость электролитов
- •Лабораторная работа «Растворимость и пр»
- •Вопросы к семинару
- •Электролитическая диссоциация
- •Лабораторная работа «Электролитическая диссоциация»
- •Вопросы к семинару
- •Методика решения задач
- •Гидролиз солей
- •Лабораторная работа «Гидролиз солей»
- •Вопросы к семинару
- •Коллоидные растворы
- •Лабораторная работа «Коллоидные растворы»
- •Вопросы к семинару
- •Редокс-процессы
- •Лабораторная работа «овр»
- •Вопросы к семинару
- •Электрохимия
- •Лабораторная работа «Электрохимия»
- •Вопросы к семинару
- •Комплексные соединения
- •Лабораторная работа «Получение и свойства кс»
- •Вопросы к семинару
- •Вопросы к коллоквиуму II
- •Лабораторная работа «Очистка веществ»
- •Вопросы к семинару
- •Библиографический список
- •Оглавление
Лабораторная работа «Растворимость и пр»
ПРИМЕЧАНИЕ. При оформлении отчета привести уравнения равновесий всех проведенных в работе процессов в сокращенном ионном виде.
1. Влияние температуры на растворимость соли.
а) Ацетат кальция. В сухую пробирку налить насыщенный раствор ацетата кальция (прозрачный) и нагреть его почти до кипения. Что наблюдается? Сделать вывод. Охладить содержимое пробирки струей водопроводной воды. Что при этом происходит? Каков знак теплового эффекта растворения данной соли?
б) Алюмокалиевые квасцы. Отвесить в пробирке 2г алюмокалиевых квасцов, добавить 3мл воды и тщательно перемешать (в течение 5мин.). Происходит ли при этом полное растворение квасцов? Нагреть содержимое пробирки почти до кипения. Что наблюдается? Каков знак теплового эффекта растворения данного вещества?
Часть раствора отлить в пробирку и быстро охладить под краном. Остальной раствор оставить охлаждаться медленно. Рассмотреть под микроскопом и зарисовать форму кристаллов, полученных при быстрой и медленной кристаллизации. Как следует охлаждать насыщенный раствор для получения крупных кристаллов?
2. Определение растворимости хлорида натрия (1 опыт на группу). В стакане на 100мл смешать 20г хлорида натрия и 30мл воды. Нагреть смесь почти до кипения (при перемешивании). Осторожно слить прозрачный раствор в сухой стакан на 100мл и наблюдать явления, происходящие при его охлаждении.
Взвесить фарфоровую чашку (с точностью до 0,01г.) Измерив температуру остывающего раствора, часть его сразу же слить его в фарфоровую чашку (так, чтобы кристаллы не попали в нее!). После остывания взвесить чашку с раствором и выпарить досуха раствор в сушильном шкафу. (Рассмотреть кристаллы хлорида натрия, выпавшие в стакане, под микроскопом и зарисовать их форму.) После выпаривания охладить фарфоровую чашку с кристаллами в эксикаторе и взвесить ее. Рассчитать растворимость хлорида натрия при измеренной температуре, сравнить со справочными данными, оценить и объяснить возможную ошибку опыта.
3. Осаждение катионов бария. Переосаждение. Растворение. К 1мл хлорида бария добавить 2мл раствора оксалата аммония. Отметить цвет осадка. Разделить его на 2 пробирки и отфуговать. Центрифугат слить в 2 другие пробирки и в одну добавить 1мл оксалата аммония (для чего?), а в другую – 1мл раствора дихромата калия. Дать объяснение происходящему. Какой из анионов более полно осаждает ионы бария и почему? (Сравните с данными табл.12).
Таблица 12. Значения ПР некоторых малорастворимых электролитов при 250С
|
Вещество |
ПР |
Вещество |
ПР |
|
AgCl AgBr AgI BaC2O4 BaSO4 BaCrO4 |
1,6 .10-10 7,7 .10-13 1,5 .10-16 1,2 .10-7 1,1 .10-10 2,4 .10-10 |
CaSO4 CaC2O4 Mg(OH)2 PbSO4 PbCrO4 HgS |
6,1.10-5 2,6.10-8 5,0.10-12 2,0.10-8 1,8.10-14 4,0.10-53(при 180С) |
В обе пробирки с осадками оксалата бария пролить по 1мл дихромата калия. Что наблюдается? Объяснить полученный результат. Затем в одну пробирку добавить 1мл 1М Н2SO4, а в другую – такое же количество уксусной кислоты и тщательно перемешать. Отметить наблюдение, прилить в обе пробирки по 1мл 1М HCl и перемешать. Происходит ли растворение осадков? Почему? Указать, при добавлении каких реагентов происходят явления, перечисленные в названии данного опыта.
4. Осаждение сульфат-анионов. Влияние природы осадителя и растворителя на полноту осаждения. Приготовить насыщенный водный раствор сульфата кальция и разлить в 3 пробирки. В одну добавить равный объем раствора хлорида бария, а в другую – хлорида кальция (зачем?). Отметить наблюдение. Какой из катионов осаждает сульфат-ионы более полно? В третью пробирку прилить равный объем этилового спирта. Объяснить наблюдение, учитывая разную полярность молекул воды и спирта, а также то, что диэлектрическая проницаемость последнего (равная 25) значительно ниже, чем у воды (80).
5. Приготовление пересыщенного раствора. Наполнить 1/3пробирки сухим ацетатом натрия и добавить 1мл воды. В стакане с кипящей водой нагреть содержимое пробирки до полного растворения соли (следить, чтобы и на стенках не осталось кристалликов). Затем закрыть пробирку влажным тампоном (для чего?) и осторожно охладить до комнатной температуры. Образуется ли осадок?
Внести в пробирку кристаллик ацетата натрия. Что наблюдается? Зафиксировать тепловой эффект процесса (проба рукой). Объяснить наблюдаемые явления.
6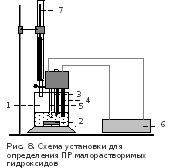 .Определение значения
ПР гидроксида магния
(1 опыт на группу). Ознакомиться с
правилами работы на рН-метре; включить
его в сеть. Через 10–15 минут проверить
правильность показаний прибора по
буферным смесям с рН 1,68 и 9,18.
.Определение значения
ПР гидроксида магния
(1 опыт на группу). Ознакомиться с
правилами работы на рН-метре; включить
его в сеть. Через 10–15 минут проверить
правильность показаний прибора по
буферным смесям с рН 1,68 и 9,18.
Собрать установку (рис.8). В стакан(1) на 200мл опустить магнитную мешалку(2) и налить 50 мл 0,1н хлорида магния. В раствор погрузить (на 2 см) термометр(3) и электроды (4 и 5) рН-метра(6). Бюретку(7) наполнить 1М щелочью.
Измерить рН исходного раствора в стакане, а затем, включив мешалку, определять рН, спустя минуту после каждого добавления щелочи. Вначале добавлять ее по каплям (до 0,5мл суммарного объема, измеренного по бюретке), затем по 1,0мл (до 4мл) и, наконец, по 0,5мл (до 7мл).
На основании
полученных данных построить кривую
титрования хлорида магния щелочью в
координатах «рН раствора – объем
добавленной щелочи». Примерный ход
кривой показан на рис.9.
Участок «аб» на этой кривой (с малым
углом наклона) соответствует процессу
осаждения гидроксида магния, а ![]() –
объем щелочи, пошедшей на образование
данного осадка. Объясните, почему в
точках «а» и «б» резко изменяется
характер зависимости рН от V добавляемой
щелочи.
–
объем щелочи, пошедшей на образование
данного осадка. Объясните, почему в
точках «а» и «б» резко изменяется
характер зависимости рН от V добавляемой
щелочи.
О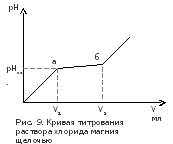 пределив
по графику значение рН, при котором
пределив
по графику значение рН, при котором![]() ,
рассчитать
,
рассчитать ![]() по формуле (как она
получена?):
по формуле (как она
получена?):
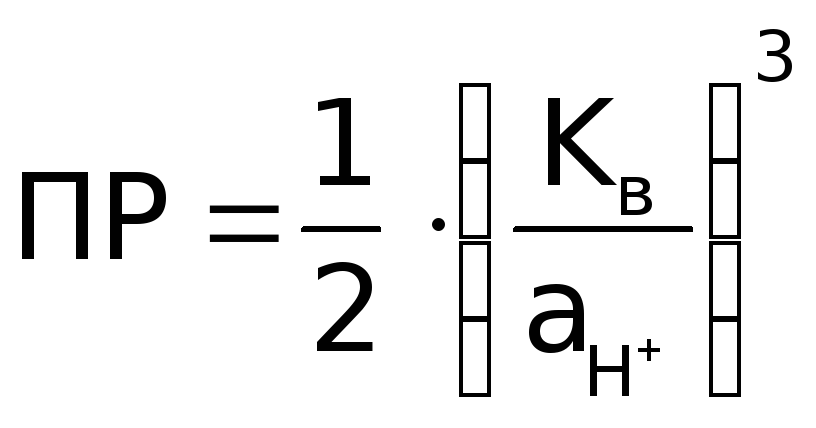 .
.
Сравнить найденное значение ПР с табличным. Объяснить возможное несовпадение этих величин.
