
БИОХИМИЯ
.pdfПопова Ольга Владимировна Самарцев Виктор Николаевич
БИОХИМИЯ малый практикум
учебно-методическое пособие
ВВЕДЕНИЕ
Биохимия – наука о химическом строении и функциях веществ, входящих в состав живой материи, и их превращениях в процессах жизнедеятельности.
Биохимия изучает различные структуры, свойственные живым организмам, и
химические реакции, протекающие на клеточном и организменном уровнях.
Биохимия изучает процессы, лежащие в основе обмена веществ.
В биохимии выделяют два раздела:
1.СТАТИЧЕСКАЯ биохимия – изучает состав живых организмов.
2.ДИНАМИЧЕСКАЯ биохимия – изучает обмен веществ.
Статическая биохимия выявила характерную черту живых клеток – их сложность и высокий уровень молекулярной организации, переход от более простых компонентов клетки к более сложным. Структурную организацию живой клетки можно представить в виде следующей схемы: неорганические вещества (H2O, N2, CO2, O2, P, S) → мономеры (нуклеотиды, аминокислоты,
моносахариды, жирные кислоты, глицерин) → макромолекулы (нуклеиновые кислоты, белки, полисахариды, липиды) → сложные макромолекулы
(нуклеопротеины, гликопротеины, липопротеины) → комплексы (рибосомы,
ядрышко, мембраны, сократительные системы) → органеллы (ядро,
митохондрии, лизосомы) → клетка.
Переход от простых биомолекул к сложным биологическим структурам основывается на физико-химических принципах самоорганизации.
Задачей динамической биохимии является изучение обмена веществ, или метаболизма клетки. Обмен веществ – это совокупность двух диаметрально противоположных, но гармонически сочетающихся процессов – синтеза
(анаболизма) и распада (катаболизма) веществ. Обмен веществ в клетке не отделим от обмена энергии, т.к. синтез веществ невозможен без затраты энергии.
Другой чертой обмена веществ является тонкое регулирование скорости протекания отдельных химических реакций. Важную роль в регулировании
2
процессов метаболизма играют биологические катализаторы – ферменты.
Регуляция клеточного метаболизма может осуществляться либо путем активации или подавления действия ферментов, либо за счет изменения скорости их биосинтеза в клетке.
3
Раздел 1. БЕЛКИ
Тема 1
АМИНОКИСЛОТНЫЙ СОСТАВ БЕЛКА. КЛАССИФИКАЦИЯ И СВОЙСТВА АМИНОКИСЛОТ. КАЧЕСТВЕННЫЕ РЕАКЦИИ НА БЕЛКИ И АМИНОКИСЛОТЫ
Белок – высокомолекулярное азотистое природное соединение,
распадающееся в ходе гидролиза на аминокислоты.
Белки содержат углерода - 50-55 %, водорода - 6,5-7,3 %, азота - 15-18 %,
кислорода - 21-24 %, серы - до 2,4 % и золы - до 0,5 %.
Для построения всех белков используется один и тот же набор из 20
различных аминокислот, ковалентно связанных друг с другом в определенной,
характерной только для данного белка последовательности.
Общей структурной особенностью аминокислот является наличие карбоксильной и аминогруппы, связанных с одним и тем же атомом углерода.
Различаются аминокислоты боковыми цепями (R-группами), которые у разных аминокислот неодинаковы по структуре, электрическому заряду и растворимости в воде. Карбоксильные и аминогруппы аминокислот участвуют в образовании пептидных связей.
Помимо 20 стандартных, основных или нормальных аминокислот,
входящих в состав белков, существуют другие аминокислоты, присутствующие в живых организмах, но не встречающиеся в белках.
Стандартные аминокислоты имеют трехбуквенные и однобуквенные условные обозначения (таблица 1).
4
|
|
|
|
Таблица 1 |
|
Сокращенные обозначения аминокислот |
|
||
|
|
|
|
|
№ |
Аминокислота |
Трехбуквенное сокращенное |
Однобуквенное |
|
|
|
обозначение |
обозначение |
|
|
|
|
|
|
1 |
Аланин |
ала |
Ala |
A |
|
|
|
|
|
2 |
Аргинин |
арг |
Arg |
R |
|
|
|
|
|
3 |
Аспарагин |
асн |
Asn |
N |
|
|
|
|
|
4 |
Аспарагиновая кислота |
асп |
Asp |
D |
|
|
|
|
|
5 |
Валин |
вал |
Val |
V |
|
|
|
|
|
6 |
Гистидин |
гис |
His |
H |
|
|
|
|
|
7 |
Глицин |
гли |
Gly |
G |
|
|
|
|
|
8 |
Глутамин |
глн |
Gln |
Q |
|
|
|
|
|
9 |
Глутаминовая кислота |
глу |
Glu |
E |
|
|
|
|
|
10 |
Изолейцин |
иле |
Ile |
I |
|
|
|
|
|
11 |
Лейцин |
лей |
Leu |
L |
|
|
|
|
|
12 |
Лизин |
лиз |
Lys |
K |
|
|
|
|
|
13 |
Метионин |
мет |
Met |
M |
|
|
|
|
|
14 |
Пролин |
про |
Pro |
P |
|
|
|
|
|
15 |
Серин |
сер |
Ser |
S |
|
|
|
|
|
16 |
Тирозин |
тир |
Tyr |
Y |
|
|
|
|
|
17 |
Треонин |
тре |
Thr |
T |
|
|
|
|
|
18 |
Триптофан |
три |
Trp |
W |
|
|
|
|
|
19 |
Фенилаланин |
фен |
Phe |
F |
|
|
|
|
|
20 |
Цинтеин |
цис |
Cys |
C |
|
|
|
|
|
Протеиногенные аминокислоты делят на 4 группы по полярности радикалов: 1) неполярные (гидрофобные) (рисунок 1); 2) полярные
(гидрофильные) незаряженные (рисунок 2); 3) отрицательно заряженные
(рисунок 3); 4) положительно заряженные (рисунок 4).
5
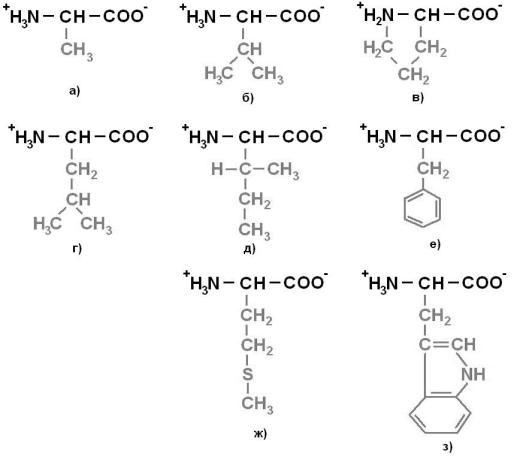
Рисунок 1. Неполярные (гидрофобные) аминокислоты: а) Аланин (Ala) – Ала;
б) Валин (Val) – Вал; в) Пролин (Pro) – Про; г) Лейцин (Leu) – Лей; д)
Изолейцин (Ile) – Иле; е) Фенилаланин (Phe) – Фен; ж) Метионин (Met) – Мет;
з) Триптофан (Trp) – Три.
6
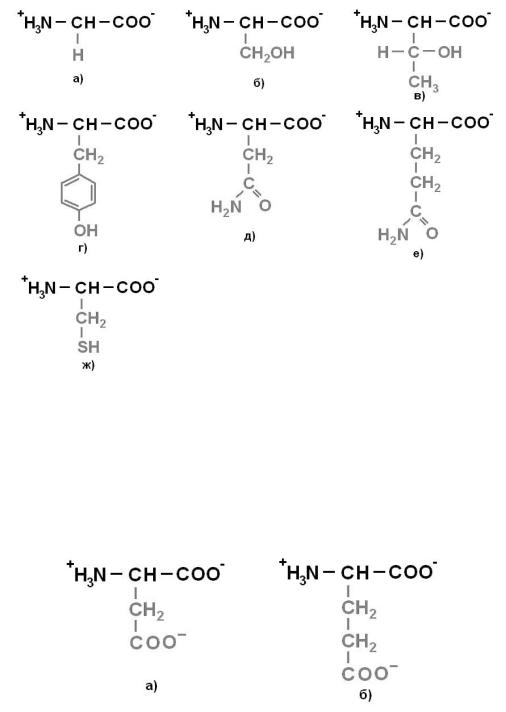
Рисунок 2. Незаряженные полярные аминокислоты: а) Глицин (Gly)- Гли; б)
Серин (Ser) – Сер; в) Треонин (Thr) – Тре; г) Тирозин (Tyr) – Тир; д) Аспарагин
(Asn) – Асн; е) Глутамин (Gln) – Глн; ж) Цистеин (Cys) - Цис
Рисунок 3. Отрицательно заряженные аминокислоты: а) Аспарагиновая кислота
(Asp) – Асп; б) Глутаминовая кислота (Glu) – Глу.
7
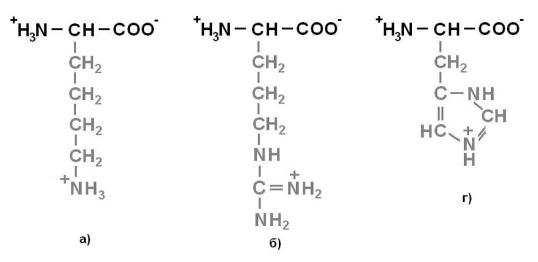
Рисунок 4. Положительно заряженные аминокислоты: а) Лизин (Lys) – Лиз; б)
Аргинин (Arg) – Арг; г) Гистидин (His) – Гис.
Радикалы аминокислот участвуют в образовании связей: 1) гидрофобные радикалы участвуют в гидрофобных взаимодействиях; 2) гидрофильные радикалы формируют водородные связи; 3) полярные (заряженные) радикалы образуют ионные связи; 4) сближение двух радикалов цистеина цис-SH + цис-
SH ведет к образованию дисульфидной связи цис-S–S-цис.
Лабораторная работа №1
ЦВЕТНЫЕ РЕАКЦИИ НА БЕЛКИ И АМИНОКИСЛОТЫ
ПРИНЦИП РАБОТЫ:
Цветные реакции дают возможность обнаружить присутствие белка в биологических жидкостях и получить представление о его аминокислотном составе.
1.1 Биуретовая реакция открывает пептидную связь в белке. Ее способны давать вещества, которые содержат не менее двух пептидных связей. При добавлении сернокислой меди к сильнощелочному раствору белка или полипептида образуются соединения меди с пептидной группировкой,
окрашенные в красноили сине-фиолетовый цвет в зависимости от длины
8
полипептидной цепи. Раствор белка дает сине-фиолетовое окрашивание, а
продукты неполного его гидролиза (пептоны) - розовое или красное.
1.2 Нингидриновая реакция характерна для α-аминогрупп. Растворы белка, α-аминокислот и пептидов при нагревании с нингидрином дают синее или фиолетовое окрашивание. В этой реакции α-аминокислоты и пептиды окисляются нингидрином и подвергаются окислительному дезаминированию и декарбоксилированию с образованием аммиака, альдегида и СО2. Нингидрин восстанавливается и связывается со второй молекулой нингидрина посредством молекулы аммиака, образуя продукты конденсации, окрашенные в синий цвет
(комплекс Руэмана). Нингидриновая реакция используется для количественного определения α-аминокислот в аминокислотных анализаторах.
1.3 Ксантопротеиновая реакция открывает наличие в белках циклических аминокислот - триптофана, фенилаланина, тирозина, содержащих бензольное ядро. Большинство белков при нагревании с концентрированной азотной кислотой дает желтое окрашивание, переходящее в оранжевое при подщелачивании вследствие образования натриевой соли динитротирозина.
Реакция обусловлена нитрованием бензольного кольца этих аминокислот с образованием нитросоединений желтого цвета.
1.4 Реакция на серусодержащие аминокислоты (реакция Фоля).
Реакция указывает на присутствие в белке аминокислот цистина и цистеина, содержащих слабосвязанную серу. Метионин, хотя и является содержащей серу аминокислотой, этой реакции не дает, поскольку сера в нем связана прочно. Реакция состоит в том, что при кипячении белка под действием щелочи от цистеина или цистина легко отщепляется сера в виде сернистого натрия, который с плюмбитом дает черный или бурый осадок сернистого свинца.
1.5 Реакция Паули. Эта реакция на аминокислоту гистидин основана на взаимодействии гистидина с диазобензолсульфоновой кислотой с образованием соединения вишнево-красного цвета.
9
РЕАКТИВЫ и ОБОРУДОВАНИЕ:
1) NaOH, 10 %, 30 %; 2) CuSO4, 1 %; 3) раствор нингидрина, 0,1 % водный раствор; 4) HNO3, конц.; 5) (CH3COO)2Pb, 5 %; 6) сульфониловая кислота, 1 %
раствор в 5 % растворе НСl; 7) NaNO2, 0,5 %; 8) Na2CO3, 10 %; 9) раствор яичного белка для цветных реакций; 10) дистиллированная вода; 11) пробирки,
пипетки, спиртовки, держатели.
ХОД РАБОТЫ:
В четыре пробирки наливают по 5 капель раствора белка.
1.В первую пробирку добавляют 3 капли 10 % раствора NaOH и 2 капли 1
%раствора CuS04; содержимое перемешивают. Развивается фиолетовая окраска характерная для биуретовой реакции. Проделывают эту же реакцию с водой.
Какая окраска?
2. Ко второй пробирке приливают 5 капель 0,1 % водного раствора нингидрина и кипятят 1-2 минуты. Наблюдают за развитием окраски,
свойственной нингидриновой реакции. Проделывают эту же реакцию с водой.
Какая окраска?
3.К третьей пробирке добавляют 5 капель концентрированной азотной кислоты и осторожно кипятят. Вначале появляется осадок свернувшегося белка, который при нагревании окрашивается. После охлаждения в пробирку наливают по каплям 10 % раствора едкого натра. Наблюдают за изменением цвета. Проделывают эту же реакцию с водой. Какая окраска?
4.К четвертой пробирке добавляют 5 капель 30 % раствора NaOH и 5
капель 5 % раствора (CH3COO)2Pb, содержимое доводят до кипения.
Появляется бурый или черный осадок сульфида свинца. Проделывают эту реакцию с волосом и кусочком ногтя. Проделывают эту же реакцию с водой.
Какая окраска?
5. В пятую пробирку наливают 5 капель 1 % раствора сульфаниловой кислоты в 5 % растворе НСl. Затем приливают 10 капель 0,5 % раствора NaNO2,
сильно встряхивают и немедленно добавляют 10 капель раствора белка, а после перемешивания 30 капель 10 % раствора Na2CO3. После смешивания растворов
10
