
БИОХИМИЯ
.pdf
Тема 8
ВИТАМИНЫ, КАК СТРУКТУРНЫЕ КОМПОНЕНТЫ ФЕРМЕНТОВ
К витаминам относятся вещества различного химического строения. Всех их объединяет то, что они необходимы для нормального течения процессов обмена веществ и не синтезируются в организме человека (а если некоторые из них и синтезируются, то в недостаточном количестве). Поэтому они должны поступать с пищей. Отсутствие витаминов в пище приводит к развитию авитаминозов. Чаще встречаются гиповитаминозы – относительная недостаточность какого-либо витамина. Некоторые витамины входят в состав
простетических групп ферментов, являются коферментами.
Витамины делятся на растворимые в воде и растворимые в жирах.
ЗАДАНИЕ: заполнить таблицу 17.
|
|
|
|
|
|
Таблица 17 |
|
|
|
|
|
|
|
|
|
|
Формула |
|
|
|
|
|
|
Название |
кофермента, в |
Биологическая |
Признаки |
Суточная |
|
Источники |
|
|
|
|
|
|
|
|
|
витамина, |
|
роль |
|
|
потребность, |
|
витамина |
состав к-ого |
гипо- |
гипер- |
|
||||
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
формула |
входит |
|
витами- |
витами- |
мг |
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
данный |
|
ноза |
ноза |
|
|
|
|
|
|
|
|
|
|
|
|
витамин |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
I. Жирорастворимые витамины |
|
|
|
||
II. Водорастворимые витамины
51
Лабораторная работа №21
КАЧЕСТВЕННЫЕ РЕАКЦИИ НА ЖИРОРАСТВОРИМЫЕ ВИТАМИНЫ
ПРИНЦИП РАБОТЫ:
Витамин А. Если рыбий жир содержит витамин А, то при добавлении серной кислоты, обладающей водоотнимающим свойством, возникает фиолетово-красное окрашивание, быстро переходящее в бурое.
Витамин D. Витамин D при взаимодействии с анилиновым реактивом при нагревании окрашивается в красный цвет.
Витамин Е. Спиртовой раствор витамина Е в присутствии концентрированной азотной кислоты окисляется в хиноидное соединение,
окрашенное в красный цвет.
Витамин К. Витамины этой группы обладают группы выраженным антигеморрагическим действием. Обнаруживают по цветной реакции с щелочным раствором цистеина.
РЕАКТИВЫ и ОБОРУДОВАНИЕ:
1) раствор рыбьего жира в обезвоженном хлороформе; 2) масляный раствор эргокальциферола - 1,25 г/л; 3) витамин Е, 0,1 % спиртовой раствор; 4)
викасол, 0,1 % спиртовой раствор; 5) H2SO4, конц.; 6) НNO3, конц.; 7) сахароза в порошке; 8) анилиновый реактив (15 частей анилина и 1 часть концентрированной соляной кислоты); 9) хлороформ; 10) цистеин, 0,025 %; 11) NaOH, 10 %; 12) часовое стекло или чашка Петри; пробирки; пипетки обычные и глазные; держатели; спиртовки.
ХОД РАБОТЫ:
1. Качественная реакция на витамин А. На сухое стекло наносят 5
капель раствора рыбьего жира в хлороформе и 1 каплю концентрированной серной кислоты. Образуется красно-фиолетовое окрашивание.
Результат занести в таблицу 18.
2. Качественная реакция на витамин D. В сухую пробирку вносят 2
капли масляного раствора эргокальциферола, 10 капель хлороформа и 1-2
52
капли анилинового реактива, осторожно нагревают при постоянном
помешивании. Отмечают результат реакции.
Результат занести в таблицу 18.
3. Качественная реакция на витамин Е. В сухую пробирку вносят 6
капель 0,1 % раствора витамина Е. Затем туда добавляют несколько крупинок сахарозы и 10 капель концентрированной HNO3 (осторожно по стенке пробирки!). Пробирки слегка встряхивают. Через 1-2 мин наблюдают развитие окрашивания.
Результат занести в таблицу 18.
4. Качественная реакция на витамин К. В сухую пробирку наливают 1мл
0,1% спиртового раствора викасола, добавляют 2 капли 0,025 % раствора цистеина и 2 капли 10 % раствора NaOH. Наблюдают за развитием окрашивания.
Результат занести в таблицу 18.
|
|
Таблица 18 |
|
|
|
Определяемый |
Используемые реактивы |
Цветовое окрашивание |
витамин |
|
|
|
|
|
А |
|
|
|
|
|
D |
|
|
|
|
|
Е |
|
|
|
|
|
К |
|
|
|
|
|
Лабораторная работа №22
КАЧЕСТВЕННЫЕ РЕАКЦИИ НА ВИТАМИНЫ ГРУППЫ В
ПРИНЦИП РАБОТЫ:
Витамин В1. В щелочной среде тиамин с диазореактивом образует сложное комплексное соединение оранжевого цвета.
Витамин В2. Окисленная форма витамина В2 представляет собой желтое флюоресцирующее в ультрафиолетовых лучах вещество. Реакция на витамин
53
В2 основана на его способности легко восстанавливаться; при этом раствор витамина В2, имеющий желтую окраску, приобретает сначала розовый цвет (за счет образования промежуточных соединений), а затем обесцвечивается
(восстановленная форма витамина В2 бесцветна).
Витамин В5 (РР). Витамин РР при нагревании с раствором ацетата меди образует плохо растворимый синий осадок медной соли никотиновой кислоты.
Витамин В6. Витамин В6 при взаимодействии с раствором хлорного железа образует комплексную соль типа фенолята железа красного цвета.
РЕАКТИВЫ и ОБОРУДОВАНИЕ:
1) витамина В1, 5 %; 2) витамин В2, 0,025 % раствор (перед определением раствор можно развести в 5 раз); 3) витамин РР, 3 % раствор в 10 % растворе уксусной кислоты; 4) витамин В6, 1 %; 5) сульфаниловая кислота, 1 %; 6)
NaNО2, 5 %; 7) Na2CO3, 10 %; 8) HCl, конц.; 9) металлический цинк; 10) FeCl3, 1 %; 11) (CH3COO)2Cu, 5 %; 12) сухие пробирки, держатели, спиртовки; 13)
флуороскоп.
ХОД РАБОТЫ:
1. Качественная реакция на витамин В1. В пробирку к 5 каплям 1 %
раствора сульфаниловой кислоты добавляют 5 капель 5 % раствора NaNО2. К
полученному диазореактиву добавляют 2 капли 5 % раствора витамина В1 и 5-7
капель 10 % раствора Na2СО3 (осторожно по стенке пробирки !). На границе двух жидкостей появляется кольцо оранжевого цвета.
Результат занести в таблицу 19.
2. Качественная реакция на витамин В2. В пробирку приливают 10
капель раствора витамина В2, добавляют туда 5 капель концентрированной HCl.
В пробирку опускают 1 горошинку металлического цинка. Начинается выделение пузырьков водорода, жидкость постепенно розовеет, затем обесцвечивается. Сравнивают обе формы витамина В2 по флюоресценции,
поместив пробирки у флуороскопа.
Результат занести в таблицу 19.
54
3. Качественная реакция на витамин В5 (РР). Перед определением раствор витамина РР взбалтывают! В пробирку вносят 20 капель витамина РР.
Нагревают до кипения. Взбалтывают раствор ацетата меди (!) и прибавляют 20
капель его к нагретому раствору. Содержимое пробирки доводят до кипения и охлаждают под струей холодной воды. Наблюдают выпадение осадка медной
соли никотиновой кислоты.
Результат занести в таблицу 19.
4. Качественная реакция на витамин В6. В пробирку вносят 5 капель 1 %
раствора витамина В6 и |
добавляют 5 капель 1 % раствора хлорного железа. |
||
Пробирки встряхивают. Наблюдают развитие окрашивания. |
|||
Результат занести в таблицу 19. |
|
||
|
|
|
Таблица 19 |
|
|
|
|
Определяемый |
|
Используемые реактивы |
Цветовое окрашивание |
витамин |
|
|
|
|
|
|
|
В1 |
|
|
|
|
|
|
|
В2 |
|
|
|
|
|
|
|
В5 (РР) |
|
|
|
|
|
|
|
В6 |
|
|
|
|
|
|
|
Лабораторная работа №23
КАЧЕСТВЕННЫЕ РЕАКЦИИ НА ВИТАМИН С
ПРИНЦИП РАБОТЫ:
Витамин С. Обнаружение аскорбиновой кислоты основано на ее способности вступать в окислительно-восстановительные реакции. Окисляясь,
аскорбиновая кислота восстанавливает такие вещества, как железосинеродистый калий, метиленовый синий, молекулярный йод.
РЕАКТИВЫ и ОБОРУДОВАНИЕ:
1) аскорбиновая кислота, 1 %; 2) NaOH, 10 %; 3) HCl, 10 %; 4)
железосинеродистый калий, 5 %; 5) FeCl3, 1 %; 6) метиленовый синий, 0,01 %;
55

7) Na2CO3, 10 %; 8) раствор Люголя (0,1 % раствор йода в растворе йодистого калия); 9) пробирки, держатели, спиртовки.
ХОД РАБОТЫ:
1. Реакция с железосинеродистым калием. В пробирку приливают 1
каплю 10 % раствора NaOH, добавляют 1 каплю 5 % раствора железосинеродистого калия. Затем прибавляют 5 капель раствора аскорбиновой кислоты. Пробирку встряхивают и добавляют в нее 3 капли 10 % раствора HCl
и 1 каплю 1 % раствора FeCl3. В пробирке образуется осадок берлинской лазури.
В другой пробирке проделывают эту же реакцию с водой. Наблюдается бурое окрашивание, обусловленное образованием железосинеродистой соли окиси железа.
Результат занести в таблицу 20.
2. Реакция с метиленовым синим. В пробирку вносят 1 каплю 0,01 %
раствора метиленового синего и 1 каплю 10 % раствора Na2СО3. Затем добавляют 3-5 капель раствора аскорбиновой кислоты. Нагревают на спиртовке. Происходит обесцвечивание метиленового синего. В другой пробирке проделывают эту же реакцию с водой.
Результат занести в таблицу 20.
3. Реакция с раствором Люголя. В пробирку приливают 10 капель дистиллированной воды, добавляют 2 капли раствора Люголя и 10 капель раствора аскорбиновой кислоты. Раствор Люголя обесцвечивается в результате восстановления йода до йодисто-водородной кислоты. В другой пробирке проделывают эту же реакцию с водой.
Результат занести в таблицу 20.
Таблица 20
Аскорбиновая кислота |
Вода |
Наблюдаемое окрашивание
56
Лабораторная работа №24
КОЛИЧЕСТВЕННОЕ ОПРЕДЕЛЕНИЕ ВИТАМИНА С
ПРИНЦИП РАБОТЫ:
Количественно витамин С определяют титрованием 0,001 н раствором 2,6-
дихлорфенолиндофенола.
РЕАКТИВЫ и ОБОРУДОВАНИЕ:
1) картофель; 2) 2,6-дихлорфенолиндофенола, 0,001 н; 3) H2SО4, 10 %; 4)
дистиллированная вода; 5) бюретка или мерная пипетка для титрования; 6)
мерный цилиндр, воронка, фильтр; 7) весы.
ХОД РАБОТЫ:
1. Приготовление экстракта из растительного материала. Тщательно промытый и очищенный от кожуры картофель нарезают на мелкие кусочки. 5 г
картофеля растирают в ступке, приливая туда 15 мл дистиллированной воды.
Далее фильтруют вытяжку и измеряют объем.
2. Титрование. 10 мл фильтрата подкисляют 2-3 каплями 10 % H2SО4 и
титруют 0,001 н раствором 2,6-дихлорфенолиндофенола до розового цвета, не исчезающего в течение 30 сек. Проводят расчет:
X = (0,088 х А х Б х 100) / В х Г = мг %, где
А - количество 2,6-дихлорфенолиндофенола, пошедшего на титрование
(мл),
Б - общий объем вытяжки (мл),
В - количество вещества, взятое для анализа (г),
Г - объем вытяжки взятый для титрования (мл),
0,088 - коэффициент, соответствующий содержанию витамина С в 1мл
0,001 н раствора.
РЕЗУЛЬТАТЫ и ВЫВОД:
57
КОНТРОЛЬНЫЕ ВОПРОСЫ:
Что такое витамины?
Классификация витаминов.
Объясните принципы качественных реакций на исследованные водорастворимые витамины.
В состав каких ферментов входят рассмотренные витамины?
58
Раздел 3. НУКЛЕИНОВЫЕ КИСЛОТЫ И ИХ ОБМЕН
Тема 9
СТРУКТУРА И ФУНКЦИИ НУКЛЕИНОВЫХ КИСЛОТ. НУКЛЕОПРОТЕИДЫ
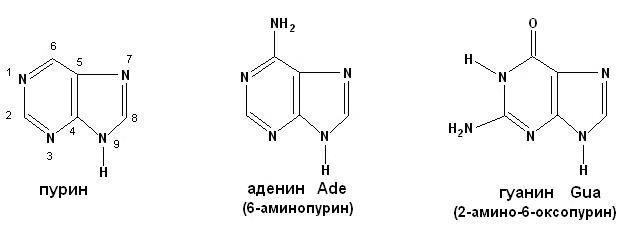
Нуклеиновые кислоты – биополимерные молекулы, основная биологическая роль которых состоит в хранении и реализации генетической информации. Два вида нуклеиновых кислот – ДНК и РНК. Полимерная цепочка нуклеиновой кислоты состоит из мономерных звеньев – нуклеотидов, которые в свою очередь состоят из трех частей: азотистого основания (пуриновое:
аденин, гуанин; пиримидиновое: урацил, цитозин, тимин) (рисунок 6, 7);
остатка сахара (D-рибозы или D-дезоксирибозы); остатка фосфорной
кислоты.
Пуриновые и пиримидиновые циклические соединения, входящие в состав нуклеиновых кислот, называют просто основаниями. N-гликозиды оснований,
содержащие рибозу или дезоксирибозу, называются нуклеозидами (таблица
21). Фосфатные эфиры нуклеозидов – нуклеотидами (рисунок 8). Нуклеотиды связаны друг с другом фосфодиэфирными связями.
Рисунок 6. Пурин и его производные.
59
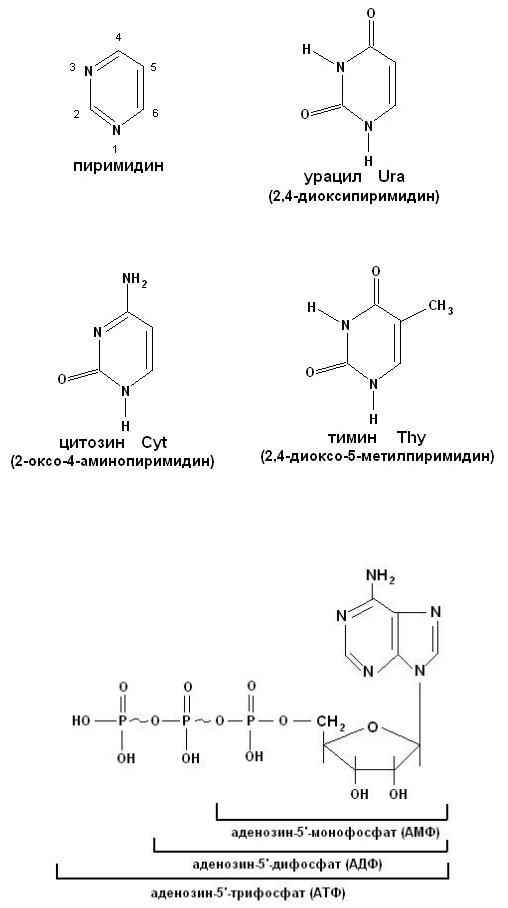
Рисунок 7. Пиримидин и его производные.
Рисунок 8. Структурная формула нуклеотида АТФ.
60
