
БИОХИМИЯ
.pdfЧем обусловлены реакции осаждения белков? При каких температурных условиях возможно осаждение белков?
Что такое обратимое и необратимое осаждение белков?
Что такое денатурация белка? Дайте характеристику денатурирующим агентам?
Что происходит с белковой молекулой при высаливании?
21
Тема 3
КОЛИЧЕСТВЕННОЕ ОПРЕДЕЛЕНИЕ БЕЛКА. ОЦЕНКА НА ОСНОВАНИИ ФОТОМЕТРИИ ПРОДУКТОВ ЦВЕТНОЙ РЕАКЦИИ. ПОСТРОЕНИЕ КАЛИБРОВОЧНЫХ ГРАФИКОВ
Наиболее распространенным методом количественного определения белка является метод, основанный на биуретовой реакции, с последующей фотометрией цветных продуктов реакции. Биуретовая реакция открывает пептидную связь в белке.
Метод оценки количества вещества базируется на использовании
калибровочного графика, а также концентрации стандартных проб,
обрабатываемых параллельно с опытными в одинаковых с ними условиях.
Построение калибровочного графика:
1. Построение калибровочной кривой начинается с приготовления ряда разведений стандартного раствора исследуемого вещества. Стандартный раствор содержит вещество в известной концентрации. Разведения стандартного раствора должны охватывать диапазон физиологических концентраций и выходить за пределы их минимальных и максимальных величин.
(!) Например, при исследовании содержания белка в сыворотке крови концентрация стандартного вещества (альбумина) должна быть в интервале от
40 до 120 г/л (при физиологической концентрации общего белка 65-85 г/л).
Ряд калибровочных разведений получают путем разбавления основного стандартного раствора.
2. Затем ведут обработку стандартных растворов аналогично опытным пробам. Измеряют оптическую плотность калибровочных растворов и опытной пробы на одном и том же приборе. Измерения оптической плотности начинают со стандартного раствора наименьшей концентрации.
22
3. Усредненные (соответствующие отдельным концентрациям) значения оптической плотности - D (абсорбции - А, экстинкции - Е) наносят на миллиметровую (калибровочную) бумагу. На оси абсцисс (горизонтальной) с
соблюдением одинаковых интервалов в равномерно возрастающей концентрации откладывают показатели содержания вещества в стандартном растворе; на оси ординат (вертикальной) - соответствующие им величины оптической плотности (рисунок 5).
Зависимость между концентрацией вещества в стандартных
(калибровочных) пробах и оптической плотностью, соответствующей этим пробам, отражается линией, построенной по точкам. Строить калибровочный график следует не менее чем по пяти точкам.
Калибровочная кривая прокладывается таким образом, чтобы по возможности большее число точек (например, 3 из 5) лежало на линии, а
остальные располагались близ нее, равномерно отклоняясь в ту и другую стороны. Отдельные точки, значительно смещающиеся от калибровочной кривой и обычно являющиеся результатом грубой ошибки в определении,
исключаются из учета.
Расположение кривой определяют так, чтобы она исходила из нулевой отметки под углом ~45 ° к осям координат: при этом достигается наибольшая точность измерений. Последней способствует также выбор оптимального,
достаточно крупного масштаба.
Определение количества вещества в опытной пробе с использованием
калибровочного графика:
1. Определение оптической плотности раствора вещества с неизвестной концентрацией (опытной пробы). Исследование проводят против контроля,
либо, если опытная проба слабоокрашенная, смотрят против дистиллированной воды.
2. Полученное значение откладывают на калибровочном графике путем опускания перпендикуляров: - с оси ординат на калибровочную кривую; - с
кривой на ось абсцисс.
23
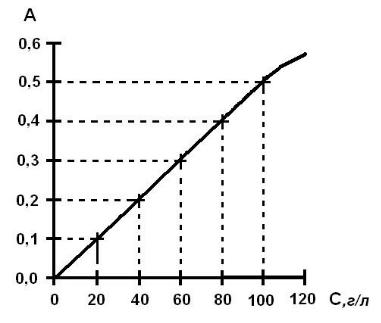
3. Полученное в результате значение концентрации на оси абсцисс и является искомой концентрацией.
Рисунок 5. Схема построения калибровочного графика.
Лабораторная работа №8
КОЛИЧЕСТВЕННОЕ ОПРЕДЕЛЕНИЕ БЕЛКА
ПРИНЦИП МЕТОДА:
Белки реагируют в щелочной среде с сернокислой медью с образованием соединений, окрашенных в фиолетовый цвет (биуретовая реакция). Реакция обусловлена образованием биуретового комплекса в результате соединения меди с пептидной группировкой белка.
РЕАКТИВЫ и ОБОРУДОВАНИЕ:
1) NaCl, 0,9 %; 2) биуретовый реактив: 0,15 г CuSO4 · 5H2O и 0,6 г
NaKC4H4O6 · 4H2O (виннокислый натрий-калий, или сегнетова соль)
растворяют в 50 мл Н2О, при энергичном перемешивании приливают туда 30
мл 10%-ого раствора NaOH (свободного от Na2CO3), добавляют 0,1 г KI и
раствор доводят водой до 100 мл. Хранят в полиэтиленовой склянке; 3)
стандартный раствор альбумина (БСА – бычий сывороточный альбумин), 10 мг
24
белка в 1 мл; 4) раствор сыворотки с разведением в 10 раз: взять 1 мл сыворотки крови довести дистиллированной водой или 0,9 % раствором NaCl
до объема 10 мл. Полученная концентрация белка будет соответствовать 6,5-8,5
г/л; 5) пробирки, пипетки; 6) ФЭК.
ХОД РАБОТЫ:
1.Опытная проба: к 4 мл биуретового реактива добавляют, избегая образования пены, 1 мл приготовленного раствора сыворотки крови с 10-ти кратным разведением.
2.Контрольная проба: к 1 мл раствора хлорида натрия приливают 4 мл биуретового реактива.
Пробы делают в 2-х повторениях!
Через 45-50 мин опытную пробу колориметрируют на ФЭКе при длине волны 540 нм против контрольной пробы (либо против дистиллированной воды).
3. Расчет ведут по калибровочной кривой. Данные для построения калибровочного графика приведены в таблице 4.
|
|
|
|
|
|
Таблица 4 |
|
Данные для построения калибровочного графика |
|
||||
|
|
|
|
|
|
|
№ |
Рабочий р-р |
Стандартный р-р |
0,9 % р-р |
Содержание |
|
Концентрация |
пробы |
биуретового |
белка (мл) |
NaCl или |
белка в пробе (г) |
|
белка (г/л) |
|
реактива (мл) |
|
дист Н2О |
|
|
|
|
|
|
(мл) |
|
|
|
|
|
|
|
|
|
|
1. |
4 |
0,2 |
0,8 |
0,002 |
|
2,0 |
|
|
|
|
|
|
|
2. |
4 |
0,4 |
0,6 |
0,004 |
|
4,0 |
|
|
|
|
|
|
|
3. |
4 |
0,6 |
0,4 |
0,006 |
|
6,0 |
|
|
|
|
|
|
|
4. |
4 |
0,8 |
0,2 |
0,008 |
|
8,0 |
|
|
|
|
|
|
|
5. |
4 |
1,0 |
0 |
0,010 |
|
10,0 |
|
|
|
|
|
|
|
При построении калибровочной кривой серию стандартных растворов
обрабатывают так же, как и опытные пробы. Пробы перемешивают и оставляют
25
при комнатной температуре на 30 мин, после чего колориметрируют на ФЭКе при 540 нм против дистиллированной воды.
Измерения оптической плотности стандартных растворов начинают с растворов наименьшей концентрации.
Пробы делают в 2-х повторениях!
По результатам измерений строится калибровочная кривая. Средние значения оптической плотности (А) 2-х повторений (соответствующие различным концентрациям) наносят на миллиметровую бумагу на оси ординат,
на оси абсцисс откладывают значения концентрации стандартных растворов белка (С).
Полученную по графику концентрацию белка в исследуемой опытной пробе умножают на величину разведения (х10).
Значения концентрации общего белка в сыворотке крови практически здоровых людей составляет 65-85 г/л.
РЕЗУЛЬТАТЫ и ВЫВОД:
КОНТРОЛЬНЫЕ ВОПРОСЫ:
Опишите физико-химическую характеристику пептидной связи. Почему пептидные связи являются основой строения белка?
Как определить количество вещества с использованием калибровочной кривой?
Какова концентрация общего белка в сыворотке крови здорового человека?
26
Тема 4
ГИДРОЛИЗ БЕЛКА. ХАРАКТЕРИСТИКА ПЕПТИДНОЙ СВЯЗИ
Гидролиз – распад сложного вещества на более простые составные части,
связанный с присоединением воды по месту разрыва связей. В зависимости от применяемого катализатора различают кислотный, щелочной и ферментативный гидролиз. При гидролизе простого белка конечными продуктами являются только аминокислоты. В организме гидролиз белка постоянно происходит в процессе, как пищеварения, так и жизнедеятельности клеток под действием протеолитических ферментов.
При кислотном гидролизе белка разрушаются некоторые аминокислоты:
триптофан подвергается полному разрушению, а серин, треонин, цистин,
тирозин, фенилаланин – частичному. Однако процент разрушения этих аминокислот невелик. При щелочном гидролизе белка отмечается более сильное разрушение аминокислот. Гидролизаты белка применяются в качестве лечебных препаратов.
Лабораторная работа №9
КИСЛОТНЫЙ ГИДРОЛИЗ ПРОСТОГО БЕЛКА
ПРИНЦИП РАБОТЫ:
При кислотном гидролизе белки распадаются сначала на высокомолекулярные пептиды, затем на низкомолекулярные пептиды,
дипептиды и, наконец, на аминокислоты.
Полный гидролиз белка протекает при многочасовом кипячении раствора в круглодонной колбе с воздушным холодильнике в присутствии соляной или серной кислоты.
27
РЕАКТИВЫ и ОБОРУДОВАНИЕ:
1) раствор яичного белка; 2) HCl, конц.; 3) NaOH, 10 %; 4) H2SO4, 1 %; 5)
круглодонная колба с воздушным холодильником; 6) электрическая плитка с асбестовой сеткой; 7) штатив.
ХОД РАБОТЫ:
1. Кислотный гидролиз простого белка. Для гидролиза в круглодонную колбу отмеривают 20 мл раствора яичного белка и 5 мл концентрированной соляной кислоты, колбу закрывают пробкой с длинной стеклянной трубкой и закрепляют на штативе с асбестовой сеткой. Содержимое кипятят (под тягой)
45-90 мин.
2. Открытие промежуточных продуктов распада белка в гидролизате при помощи биуретовой реакции. По окончании кипячения в пробирку наливают 5 капель гидролизата белка и нейтрализуют 10 % раствором щелочи по красному лакмусу (опускают кусочек лакмуса в пробирку и помешивают стеклянной палочкой). После нейтрализации гидролизата (при посинении лакмуса) проводят биуретовую реакцию, прибавляя 2 капли CuSO4.
Промежуточные продукты распада белка – пептоны – при проведении биуретовой реакции дают розовое или красное окрашивание, а белки – сине-
фиолетовое.
При полном гидролизе белка (2,5 часа до аминокислот биуретовая реакция с гидролизатом белка отрицательная.
По окончании гидролиза гидролизат используют для лабораторной работы №10.
Лабораторная работа №10
ФОРМОЛОВОЕ ТИТРОВАНИЕ (по Серенсену)
ПРИНЦИП РАБОТЫ:
При гидролизе белка вследствие разрыва пептидных связей в нем происходит нарастание одновременно карбоксильных и аминных групп в
28
эквивалентных количествах. Для определения количества карбоксильных групп используется метод Серенсена.
Аминокислоты в водных растворах образуют внутримолекулярные соли,
поэтому без предварительного блокирования аминогрупп формальдегидом непосредственно титровать карбоксильные группы аминокислот щелочью невозможно. В процессе реакции с формальдегидом аминогруппа теряет свои основные свойства.
Образующееся метиленовое соединение (метиленаминокислота) легко может быть оттитровано щелочью.
Определяя количество карбоксильных групп титрованием, одновременно можно судить и о содержании аминных групп, так как количество титруемых карбоксильных групп эквивалентно количеству связанных формальдегидом аминных групп. Метод формолового титрования позволяет следить за ходом гидролиза белка и изучать действие протеолитических ферментов.
Конец гидролиза белка совпадает с моментом, когда количество аминных и карбоксильных групп в гидролизате перестанет увеличиваться и наблюдается отрицательная биуретовая реакция.
РЕАКТИВЫ и ОБОРУДОВАНИЕ:
1) животный уголь, тщательно измельченный; 2) CH3COOH, 1 %; 3)
формалин нейтральный, 20 %; 4) фенолфталеин; 5) NaOH, 0,005 н.; 6) HCl или
CH3COOH, 1 %; 7) конические колбы на 50 мл; 8) пипетки на 1 и 2 мл; 9)
микробюретки; 10) цилиндр мерный на 25 мл.
ХОД РАБОТЫ:
1. Титрование карбоксильных групп в растворе белка до гидролиза.
Отмеривают в колбочку 1 мл раствора яичного белка, приливают 5 капель 20 %
нейтрального раствора формалина и 3 капли 0,5 % раствора фенолфталеина.
Титруют из микробюретки 0,005 н. раствором NaOH до устойчивой бледно-
розовой окраски.
2. Титрование карбоксильных групп после гидролиза белка (т.е. в
гидролизате). Через 45 или 90 минут гидролиз прерывают, а в колбочку
29
всыпают (на кончике ножа) животный уголь для обесцвечивания буроватого раствора, взбалтывают и кипятят 5 минут. Затем гидролизат охлаждают,
выливают в цилиндр, доводят объем жидкости до 25 мл дистиллированной водой и фильтруют.
Отмеривают в колбочку 1,25 мл гидролизата, добавляют 3 капли раствора фенолфталеина и нейтрализуют 10 % раствором NaOH из макробюретки до слабо-розовой окраски. Если при нейтрализации окраска делается ярко-красной, то добавляют до обесцвечивания по каплям 1 % раствор уксусной кислоты, избыток которой нейтрализуют 1 % раствором NaOH до слабо-розовой окраски. Затем приливают 5 капель нейтрального 20 % раствора формалина и обесцвеченный раствор титруют 0,005 н. раствором NaOH до бледно-розового цвета и точно отмечают количество затраченной щелочи.
3. Расчет азота аминогрупп производят по количеству затраченной
щелочи, исходя из ее нормальности.
Заполнить таблицу 5.
|
|
|
|
Таблица 5 |
|
|
|
|
|
Ход работы |
Количество мл |
Количество мл |
Количество мл |
Расчет азота |
|
щелочи (до |
щелочи (после |
щелочи (после |
аминогрупп по |
|
гидролиза белка) |
45 минут |
90 минут |
количеству |
|
|
гидролиза белка) |
гидролиза белка) |
затраченной |
|
|
|
|
щелочи |
|
|
|
|
|
|
|
|
|
|
ВЫВОД: |
|
|
|
|
КОНТРОЛЬНЫЕ ВОПРОСЫ:
Что такое гидролиз белка и как его производят?
Как установить конец гидролиза белка?
30
