
- •Предмет электрохимии.
- •Проводники первого и второго рода.
- •Электрохимические реакции.
- •Законы электролиза (законы фарадея).
- •Причины электролитической диссоциации.
- •Подвижность ионов.
- •Подвижность ионов гидроксония и гидроксила.
- •Числа переноса ионов.
- •Недостатки теории аррениуса.
- •Теория электролитов дебая и гюккеля.
- •Диссоциация воды. РН растворов.
- •Диссоциация слабых электролитов.
- •Гидролиз солей.
- •Буферные растворы.
- •Произведение растворимости.
- •Гальванические элементы. Эдс.
- •Термодинамика гальванического элемента.
- •Измерение эдс.
- •Строение границы электродраствор. Двойной электрический слой.
- •Электродный потенциал.
- •Классификация электродов.
- •Электроды первого рода.
- •Электроды второго рода.
- •Газовые электроды.
- •Амальгамные электроды.
- •Физические цепи.
- •Концентрационные цепи.
- •Химические цепи.
- •Аккумуляторы.
- •Кинетика электрохимических процессов.
- •Концентрационная поляризация.
- •Электрохимическое перенапряжение.
- •Напряжение разложения.
- •Закономерности перенапряжения выделения водорода.
- •1. Влияние плотности тока
- •2. Влияние природы металла
- •3. Влияние природы и состава раствора
- •4. Влияние температуры и некоторых других факторов
- •Теории водородного перенапряжения.
- •Теория замедленной рекомбинации
- •Теория замедленного разряда
- •Электроосаждение металлов.
- •Анодное растворение и пассивность металлов.
- •Коррозия металлов. Борьба с коррозией.
Диссоциация воды. РН растворов.
Диссоциация воды протекает по схеме :
Н2О Н+ + ОН-
Константу диссоциации можно выразить как
![]() =
=
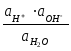
Т.к.
степень диссоциации воды очень мала,
то
![]() можно считать постоянной и ввести ее в
значение константы диссоциации :
можно считать постоянной и ввести ее в
значение константы диссоциации :
![]()
При Т = const Kw = const и не зависит от концентрации ионов Н+ и ОН- ; Kw называется ионным произведением воды. При 25оС Kw = 10-14.
В
нейтральном растворе
![]() = 10-7
моль/л.
= 10-7
моль/л.
рН
=
lg
![]()
водородный
показатель,
введенный Зеренсеном (1909). РН = 7 отвечает
нейтральному раствору только при 25оС.
Kw
очень
сильно зависит от Т (увеличивается в
100 раз в интервале 20-100оС),
т.е. с ростом Т концентрация образующихся
ионов Н+
и ОН-
будет увеличиваться, и при t
25оС
рН = 7 будет соответствовать кислому
раствору, а при t
25оС
щелочному.
водородный
показатель,
введенный Зеренсеном (1909). РН = 7 отвечает
нейтральному раствору только при 25оС.
Kw
очень
сильно зависит от Т (увеличивается в
100 раз в интервале 20-100оС),
т.е. с ростом Т концентрация образующихся
ионов Н+
и ОН-
будет увеличиваться, и при t
25оС
рН = 7 будет соответствовать кислому
раствору, а при t
25оС
щелочному.
Кислые растворы такие, в которых Н+ОН-; щелочные ОН-Н+. Т.к. мерой кислотности служит Н+, то в ряду кислот более сильной будет та, у которой при одинаковой аналитической концентрации Н+ выше (т.е. больше степень диссоциации).
Следует помнить, что величины концентраций ионов Н+ в выражении для рН можно использовать взамен активностей только в случае достаточно разбавленных растворов.
Диссоциация слабых электролитов.
При диссоциации слабых электролитов устанавливается равновесие между недиссоциированными молекулами и ионами. Рассмотрим простейший пример, когда молекула распадается только на два иона :
СН3СООН + Н2О СН3СОО- + Н3О+
На основании закона действующих масс напишем выражение для константы равновесия Ка :
Ка
=

Активность растворителя (воды) в разбавленных растворах можно считать постоянной :
Ка
![]() =
Кд
=
=
Кд
=

Величина Кд называется термодинамической константой диссоциации (или просто константой диссоциации).
Ка зависит от Т, но не зависит от концентрации растворенного вещества.
Заменив активности произведениями аналитических концентраций на соответствующие коэффициенты активности, получим, например, пользуясь моляльностью :
Кд
=

 =Кm
=Кm

Можно выразить Кд через молярность с и соответствующие коэффициенты активности :
Кд
=
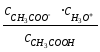
 =Кс
=Кс

Кс классическая константа диссоциации.
Для
точных расчетов ионных равновесий
необходимо пользоваться термодинамической
константой диссоциации Кд.
Коэффициенты активности можно рассчитать
по уравнениям Дебая-Гюккеля.![]()
Гидролиз солей.
Гидролизом называется обменная реакция вещества с водой. В результате гидролиза солей сильных кислот и слабых оснований (NH4Cl) или слабых кислот и сильных оснований (СН3СООNa) образуются слабодиссоциированные кислоты или основания, что приводит к нарушению равенства концентраций ионов Н+ и ОН- в растворе и раствор приобретает кислую или щелочную реакцию.
СН3СОО- + Н2О СН3СООН + ОН-
Ка
=

В
разбавленных растворах
![]() можно считать постоянной :
можно считать постоянной :
Ка
![]() =Кг
=
=Кг
=

Кг константа гидролиза.
Константа диссоциации уксусной кислоты :
Кд,к
=
 ;
;![]() =
=![]() /Кд,к
/Кд,к
После
подстановки (учитывая, что
![]() =Кw
) :
=Кw
) :
Кг = Кw / Кд,к
Аналогично для соли сильной кислоты и слабого основания (NH4Cl) можно получить :
Кг = Кw / Кд,о
Для соли слабой кислоты и слабого основания :
CH3COO- + NH4+ + H2O CH3COOH + NH4OH
Кг
=

![]() =
=
![]() /Кд,к
;
/Кд,к
;
![]() =
=![]() /Кд,о
/Кд,о
Кг
=
![]() /Кд,к
Кд,о
= Кw
/ Кд,к
Кд,о
/Кд,к
Кд,о
= Кw
/ Кд,к
Кд,о
Т.о., константы гидролиза солей можно рассчитать, зная константы диссоциации соответствующих слабых кислот и оснований.
Наряду с константой гидролиза реакции гидролиза характеризуются также степенью гидролиза. Степень гидролиза доля молекул соли, подвергшихся гидролизу, от общего числа молекул соли.
Для гидролиза CH3COONa :
=
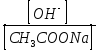
Кг
=
![]() =
=![]()
где с исходная концентрация CH3COONa.
В случае гидролиза соли слабого основания и сильной кислоты связь между Кг и точно такая же. Зная Кг ,можно рассчитать , решая уравнение :
с2 + Кг Кг = 0
При
малых значениях
(
1 и 1
1) Кг
= с2
и
=
![]() .
.
Если соль образована слабой кислотой и слабым основанием,
Кг
=
![]() =
=![]()
При
1 Кг
= 2
и
=
![]() .
.
Анализ уравнений показывает, что степень гидролиза солей слабых кислот и сильных оснований и солей сильных кислот и слабых оснований уменьшается с ростом концентрации соли и увеличивается при разбавлении растворов; степень гидролиза солей слабого основания и слабой кислоты от концентрации раствора практически не зависит.
Зависимость Кг от температуры : Кw возрастает с ростом Т очень значительно, Кд от Т почти не зависит, следовательно, Кг с повышением Т увеличивается, соответственно возрастает и .
