
- •Предмет электрохимии.
- •Проводники первого и второго рода.
- •Электрохимические реакции.
- •Законы электролиза (законы фарадея).
- •Причины электролитической диссоциации.
- •Подвижность ионов.
- •Подвижность ионов гидроксония и гидроксила.
- •Числа переноса ионов.
- •Недостатки теории аррениуса.
- •Теория электролитов дебая и гюккеля.
- •Диссоциация воды. РН растворов.
- •Диссоциация слабых электролитов.
- •Гидролиз солей.
- •Буферные растворы.
- •Произведение растворимости.
- •Гальванические элементы. Эдс.
- •Термодинамика гальванического элемента.
- •Измерение эдс.
- •Строение границы электродраствор. Двойной электрический слой.
- •Электродный потенциал.
- •Классификация электродов.
- •Электроды первого рода.
- •Электроды второго рода.
- •Газовые электроды.
- •Амальгамные электроды.
- •Физические цепи.
- •Концентрационные цепи.
- •Химические цепи.
- •Аккумуляторы.
- •Кинетика электрохимических процессов.
- •Концентрационная поляризация.
- •Электрохимическое перенапряжение.
- •Напряжение разложения.
- •Закономерности перенапряжения выделения водорода.
- •1. Влияние плотности тока
- •2. Влияние природы металла
- •3. Влияние природы и состава раствора
- •4. Влияние температуры и некоторых других факторов
- •Теории водородного перенапряжения.
- •Теория замедленной рекомбинации
- •Теория замедленного разряда
- •Электроосаждение металлов.
- •Анодное растворение и пассивность металлов.
- •Коррозия металлов. Борьба с коррозией.
Причины электролитической диссоциации.
Твердые вещества, при растворении которых в воде и других полярных растворителях образуются электролиты, являются, как правило, кристаллическими телами, имеющими ионные или близкие к ионным решётки. В чисто ионных решётках не существует молекул вещества. Ионы противоположных знаков, составляющие такую решётку, связаны между собой большими электростатическими силами. При переходе ионов в раствор энергии электростатического взаимодействия ионов в решётке противопоставляется энергия взаимодействия ионов с дипольными молекулами растворителя, который втягивает ионы решётки в раствор. При этом ионы окружаются молекулами растворителя, образующими вокруг иона сольватную (в частном случае гидратную) оболочку. Энергия взаимодействия ионов различных знаков, перешедших в раствор и окружённых сольватными оболочками, уменьшается по сравнению с энергией их взаимодействия в решётке обратно пропорционально диэлектрической проницаемости растворителя D в соответствии с законом Кулона :
E
=
![]()
где z1 и z2 число элементарных зарядов катиона и аниона; r расстояние между катионом и анионом.
Если энергия взаимодействия ионов с растворителем становится соизмеримой с энергией ионов в кристаллической решётке, то происходит растворение с диссоциацией.
Надо помнить при этом, что при растворении должен уменьшиться изобарный потенциал G системы, а внутренняя энергия (и энтальпия) может как уменьшаться, так и увеличиваться (отрицательная и положительная теплоты растворения).
Взаимодействие дипольных молекул растворителя с элементами кристаллической решётки может привести к образованию электролита даже при растворении веществ, имеющих молекулярную решётку, решётку промежуточного типа или находящихся в газообразном состоянии (атомы в молекулах газа связаны ковалентно).
Ясно, что для осуществления электролитической диссоциации определяющую роль играет взаимодействие ионов с растворителем (в водных растворах гидратация, в общем случае сольватация). На важное значение гидратации ионов впервые указали И.А.Каблуков и В.А.Кистяковский. Они положили начало развитию теории электролитов в направлении, которое указывал Д.И.Менделеев, то есть объединили так называемую сольватную теорию и физическую теорию Вант-Гоффа Аррениуса.
Связь между диэлектрической проницаемостью D растворителя и его способностью образовывать растворы, проводящие электрический ток, отмечалась давно. Вода, диэлектрическая проницаемость которой D = 81 при 18C, а также HCN (D=107 при 25C) и HCOOH (D=57 при 25С) принадлежат к растворителям, вызывающим сильную диссоциацию. Низшие спирты и кетоны, уксусная кислота, пиридин имеют диэлектрические проницаемости в пределах 2035 и также способны образовывать электролиты, хотя и в меньшей степени, чем вода.
Кроме величины диэлектрической проницаемости важное значение имеет взаимодействие молекул растворителя с молекулами растворённого вещества. Это взаимодействие нередко приводит к образованию новых молекул или молекулярных комплексов, которые в данном растворителе способны диссоциировать на ионы.
Лекция 41
Электропроводность (удельная и эквивалентная), ее зависимость от концентрации и температуры. Методы измерения электропроводности.
Подвижность ионов, закон Кольрауша, аномальная подвижность ионов Н3О+ и ОН-.
Электропроводность
К
величина, обратная электрическому
сопротивлению R.
Так как R
=
![]() , то К =
, то К =
![]()
![]() =
=
![]()
![]()
где удельное электрическое сопротивление; l расстояние между электродами; S площадь электрода; удельная электропроводность.
Удельная электропроводность жидкости это электропроводность одного кубического сантиметра раствора, заполняющего пространство между плоскими электродами одинаковой, очень большой площади, находящимися на расстоянии 1 см. Кубический сантиметр раствора должен находиться вдали от границ электрода. = Ом-1 см-1.
По закону Ома : R = U/I ; U = E l (Е напряженность поля, или падение напряжения на 1 см расстояния; l расстояние между электродами); I = i S (i плотность тока, или ток, приходящийся на 1 см2 поверхности электрода; S площадь электрода). Тогда :
![]()
![]() =
=
![]() ;i
=
E
;i
=
E
При Е = 1 В/см i = .
I
=
![]() ; i
=
; i
=
![]()
Таким образом, это количество электричества, которое проходит в единицу времени через единицу поперечного сечения проводника при напряженности электрического поля 1 В/см.
Кривая зависимости удельной электропроводности растворов от концентрации обычно имеет максимум (четко выраженный для сильных электролитов и сглаженный для слабых). Наличие максимумов на кривых с можно объяснить следующим образом. В разбавленных растворах сильных электролитов ( = 1) электропроводность растет пропорционально числу ионов, которое, в свою очередь, растет с концентрацией. В концентрированных растворах сильных электролитов ионная атмосфера существенно уменьшает скорость движения ионов, и электропроводность падает. В слабых электролитах плотность ионной атмосферы мала и скорость движения ионов мало зависит от концентрации, однако с увеличением концентрации раствора заметно уменьшается степень диссоциации, что приводит к уменьшению концентрации ионов и падению электропроводности.
Удельная электропроводность зависит от температуры. Зависимость дается эмпирическим уравнением :
t = 18 1 + (t - 18)
температурный коэффициент электропроводности; 18 (25) стандартное значение.
|
слабый эл-т
Зависимость удельной электропроводности от концентрации электролита |
сильный эл-т
слабый эл-т
С Зависимость эквивалентной электропроводности от концентрации электролита |
Эквивалентная электропроводность в см2/(г-эквОм) это электропроводность такого объема ( см3) раствора, в котором содержится 1 г-экв растворенного вещества, причем электроды находятся на расстоянии 1 см друг от друга.
Найдем связь между и . Представим себе погруженные в раствор параллельные электроды на расстоянии 1 см, имеющие весьма большую площадь. Электропроводность раствора, заключенного между поверхностями таких электродов, имеющими площадь, равную см2, и есть эквивалентная электропроводность раствора. Объем раствора между этими площадями электродов равен см3 и содержит 1 г-экв соли. Величина , равная 1000/с см3/г-экв, называется разведением. Таким образом :
=
;
=
![]()
Мольная электропроводность электролита это произведение эквивалентной электропроводности на число грамм-эквивалентов в 1 моль диссоциирующего вещества.
Зависимость эквивалентной электропроводности от концентрации :
Зависимость с : с увеличением с величина уменьшается сначала резко, а затем более плавно.
Зависимость
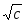 : для сильных электролитов соблюдается
медленное линейное уменьшение
с увеличением
: для сильных электролитов соблюдается
медленное линейное уменьшение
с увеличением
 ,
что соответствует эмпирической формуле
Кольрауша :
,
что соответствует эмпирической формуле
Кольрауша :
= А

предельная эквивалентная электропроводность при бесконечном разведении : с 0 , .
3. Зависимость : значение сильных электролитов растет с увеличением и асимптотически приближается к . Для слабых электролитов значение также растет с увеличением , но приближение к пределу и величину предела в большинстве случаев практически нельзя установить.
|
слабый эл-т |
слабый эл-т
|
Все вышесказанное касалось электропроводности водных растворов. Для электролитов с другими растворителями рассмотренные закономерности сохраняются, но имеются и отступления от них, например, на кривых с часто наблюдается минимум (аномальная электропроводность).
Способы измерения электропроводности самостоятельно.


 сильный
эл-т
сильный
эл-т 

 С
С





 сильный
эл-т
сильный
эл-т



 сильный
эл-т
сильный
эл-т 


