
- •Курс лекций Технология и оборудование для переработки плодов, овощей, мяса и гидробионтов
- •Содержание
- •Глава 1. Теоретические основы технологии пищевых производств . . 6
- •Глава 2. Характеристика растительного сырья . . . . . . . . . . . . . . . . . . . 65
- •Глава 3. Характеристика мясного сырья . . . . . . . . . . . . . . . . . . . . . . . . 85
- •Глава 4. Характеристика гидробионтов . . . . . . . . . .. . . . . . . . . . . . . . . . 118
- •Глава 5. Холодильная (низкотемпературная) обработка плодов, овощей, мяса и рыбы . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 143
- •Глава 1. Теоретические основы технологии пищевых производств
- •1.1. Биохимические основы технологии пищевого сырья
- • Кислота // o
- •1.2. Микробиологические основы технологии переработки пищевого сырья
- •1.2.1. Морфология микроорганизмов
- •1.2.2. Физиология микроорганизмов
- •1.2.3. Влияние факторов внешней среды на микроорганизмы
- •1.3. Принципы и способы консервирования
- •1.3.1. Принципы консервирования
- •1.3.2. Классификация способов консервирования
- •Физические способы консервирования
- •Химические способы консервирования
- •Биологические способы консервирования
- •Комбинированные способы консервирования
- •1.4. Пищевая ценность продуктов
- •Вопросы для самопроверки
- •Глава 2. Характеристика растительного сырья
- •2.1. Классификация растительного сырья
- •2.2. Строение растительной ткани Растительная клетка
- •Тургор и плазмолиз растительной клетки
- •Виды растительной ткани
- •2.3. Химический состав растительного сырья
- •Минеральные вещества
- •2.4. Характеристика стадии зрелости растительного сырья
- •2.5. Хранение плодов и овощей
- •2.6. Первичная переработка растительного сырья
- •Вопросы для самопроверки
- •Глава 3. Характеристика мясного сырья
- •3.1. Товарная классификация мяса теплокровных животных
- •3.2. Характеристика тканей сельскохозяйственных животных.
- •3.2.1. Гистологическая структура
- •3.2.2. Морфологический и химический состав
- •Пищевые субпродукты
- •Состав и свойства крови
- •3.3. Пищевая ценность мяса
- •3.4. Требования к мясу, поступающему на переработку
- •3.5. Изменения в мясе после убоя животных
- •Вопросы для самопроверки
- •Глава 4. Характеристика гидробионтов
- •4.2. Рыба как промышленное сырье
- •Химический состав
- •4.3. Физические, структурно-механические и биохимические свойства
- •4.3.1. Физические свойства
- •4.3.2.1. Морфометрические характеристики рыбы
- •4.4. Посмертные изменения рыбы
- •4.5. Требования к качеству рыбного сырья и его первичная переработка
- •Хранение и транспортировка живой рыбы
- •Глава 5. Холодильная (низкотемпературная) обработка плодов, овощей, мяса и рыбы
- •5.1. Теоретические основы холодильной обработки пищевых продуктов
- •5.1.1. Влияние низких температур на микроорганизмы
- •5.1.2. Влияние низких температур на клетки и ткани пищевого сырья
- •5.1.3. Изменение температурных коэфициентов реакций при воздействии холода.
- •5.1.4. Переохлаждение и замерзание воды
- •5.2. Охлаждение пищевого сырья
- •5.2.1. Изменение свойств пищевого сырья в процессе охлаждения
- •5.2.2. Производство охлажденных продуктов растительного происхождения
- •5.2.3. Производство охлажденного мяса и птицы
- •Изменения, происходящие при хранении охлажденного мяса
- •5.2.4. Производство охлажденной рыбы
- •5.3. Подмораживание пищевого сырья
- •5.4. Замораживание пищевого сырья
- •5.4.1. Изменение свойств пищевого сырья при замораживании
- •5.4.2. Расчет расхода холода на замораживание пищевого сырья
- •5.4.3. Способы замораживания пищевых продуктов
- •5.4.4. Производство мороженых плодов и овощей
- •5.4.5. Производство мороженого мяса
- •5.4.6. Производство мороженой рыбы
- •5.4.7. Холодильное хранение пищевого сырья
- •5.4.8. Увеличение сроков хранения охлажденного и мороженого пищевого сырья
- •Вопросы для самопроверки
1.1. Биохимические основы технологии пищевого сырья
Биологическое значение веществ, входящих в состав пищевых продуктов, различно. Группу главных пищевых веществ (по международной классификации «макронутриентов») составляют белки, жиры, углеводы и макроэлементы. В группу биологически активных веществ входят витамины, микроэлементы, ферменты и др.
Под элементарным понимают химический состав сырья или продукта, выраженный в виде содержания в них отдельных химических макро-, микро- и ультрамикроэлементов.
Однако соотношением элементов можно выражать химический состав вещества, молекула которого содержит не более пяти-шести отдельных элементов. В пищевом сырье обнаружено более 60 элементов, входящих в состав разных соединений. В связи с этим химический состав животного и растительного сырья принято оценивать по соотношению групп различных химических соединений – молекул. Такой химический состав называется молекулярным.
Молекулярный химический состав пищевого сырья как правило включает содержание воды, белка, небелковых азотистых веществ, жиров, витаминов и углеводов. Ферменты – катализаторы всех биологических процессов в химическом составе отдельно не учитывается, но играют огромную роль при решении вопроса о рациональном использовании пищевого сырья.
Минеральные вещества.К группе макроэлементов относятся такие, содержание которых в сухой субстанции варьирует от nּ10-2до nּ10 %. Это С, О, Н, N, S и Р, входящие в молекулярный состав основных веществ и Ca, Na, Cl, К, Mg, входящие в состав опорных тканей, крови, лимфы и др. тканей.
Элементы, содержание которых в сухом субстрате изменяется в пределах от nּ10-5до nּ10-3% относятся к группе микроэлементов. Например, Сu, Br, J, Zn, As, В и др.
К группе ультрамикроэлементов относятся элементы, содержание которых ниже nּ10-5% (Sb, Нg, Вi, Рb и др.).
Установлено, что большинство элементов являются биогенными, имеющими огромное значение для обеспечения нормального развития биохимических жизненных процессов, причем наиболее важные биогенные элементы входят в IV (С); V (W, P) и VI (O, S) группы таблицы Менделеева. Элементы VII (Сl, J, Мn) и VIII (Fe, Со) группы участвуют в образовании веществ с высокой биологической ценностью.
Микроэлементный состав сырья зависит от среды обитания или произрастания. В зависимости от концентрации отдельных элементов в окружающей среде и в пище, доступности их, а также от избирательной способности отдельных видов организмов изменяется и степень использования отдельных элементов при процессах ассимиляции.
Белки. Из органических веществ, входящих в состав живых организмов, наиболее важным в биологическом отношении и наиболее сложными по структуре являются белки. Почти все проявления жизни (пищеварение, раздражительность, сократимость, рост и размножение, движение, обмен веществ и др.) связаны с белковыми веществами. Белки играют важную роль как в построении живой материи, так и в осуществлении процессов ее жизнедеятельности.
Специфические катализаторы белковой природы - ферменты - ускоряют химические реакции, протекающие в организме. Различные соединения белковой природы осуществляют транспортную функцию, снабжая организм кислородом и питательными веществами. Распад 1 г белка до конечных продуктов обеспечивает организм энергией 4,27 ккал.
Выделенные из органов и тканей белки при нагревании дают осадок белого цвета и обладают теми же физическими свойствами, как белок куриного яйца. Поэтому их стали называть белками. Синонимом слова "белок" является слово «протеин» (от греческого "протеус" - первый, главный).
Белки - это высокомолекулярные полимеры различных аминокислот. На рис. 1 представлены формулы различных аминокислот.
__
 R
R
COOH CH2
// \\
R
R
COOH CH2
// \\
\\ __ //
 CH
NH2
CH
NH2
CH
NH2
CH
NH2
CH
NH2
CH
NH2
COOH COOH COOH
моноамино- моноамино- циклическая
карбоновая дикарбоновая
Рис. 1. Формулы некоторых аминокислот.
Аминокислоты подразделяются на 2 большие группы: заменимые и незаменимые. Большинство аминокислот образуется в организме животных и человека в результате гидролиза белков пищи и биосинтеза. Но как минимум, восемь аминокислот не синтезируются в организме. Это валин, лейцин, изолейцин, треонин, лизин, фенилаланин, триптофан и метионин, называемые незаменимыми. Белки, в которых отсутствует одна или несколько этих аминокислот, называют биологически неполноценными. Животные белки, в том числе белки гидробионтов, содержат все незаменимые аминокислоты.
Аминокислоты, входящие в состав белка, соединяются между собой пептидными связями, образующимися между аминной группой одной аминокислоты и карбоксильной группой другой. Механизм этого процесса показан на рис.2.

R1 OH H R2
/ /
H2N СH C + N CH СООН
O H
R1 R2

H2N C C N СН СООН + H2О
O H
Рис. 2. Образование первичной структуры белка.
Образующиеся полипептиды являются основой всех белков, а заложенная в них определенная последовательность аминокислот характеризует первичную структуру белка.
Таким образом, поскольку макромолекулы белка построены из многих сотен аминокислот, в природе существует безграничное количество их изомеров, и каждый вид живых существ может иметь свой только ему присущий белок.
Полипептидные цепи в свою очередь могут соединяться, образуя вторичные структуры белка, главным образом за счет связей, возникающих между различными группами полипептидов. Это схематично показано на рис. 3.
R2 R3
HN С CН N C СН N C
O H О Н О
Н R1 O H R4 O
N СН C N СН C
а) образование водородных связей

б) образование -спирали из полипептидной цепочки
Рис. 3. Схема образования вторичной структуры белка.
Пространственное расположение полипептидных цепей молекулы белка определяет третичную структуру белковой молекулы.
Собственно белки - высокомолекулярные соединения сложной структуры, различаются как по физиологическим функциям, так и по химическим свойствам. Белки пищевого сырья находятся преимущественно в коллоидном состоянии – в виде гелей и золей, что предопределяет неустойчивость и изменчивость свойств (денатурацию) белковых веществ при изменении условий среды.
При подкислении белковых растворов до рН 4,5-5,0 (например, при мариновании) белки утрачивают растворимость и осаждаются (коагулируют). Многие белки утрачивают растворимость при насыщении растворов хлористым натрием (при посоле). В частности, основные мышечные белки, хорошо растворимые в растворах хлористого натрия концентрацией 7,5-10 %, при повышении его концентрации до 15 % осаждаются (высаливаются). При нагревании (во время варки, обжаривания, пропекания) белки свертываются (коагулируют). Термическая денатурация белков начинается с 28-35 оС. Денатурация белков имеет место и при обезвоживании (дегидратации) их систем (при сушке и замораживании).
При осаждении (высаливании, коагуляции) белков нарушается их связь с водой.
В результате пространственного трехмерного строения "на поверхности" белковой молекулы оказываются химически активные группы – NН2; -COOH; - ОН. В водном растворе эти группы находятся в ионизированном состоянии с зарядами различного знака. Белковая молекула приобретает соответствующий знак и величину заряда в зависимости от соотношения положительно и отрицательно заряженных групп. Заряд белковой молекулы зависит от ее состояния. Всякое изменение структуры белковой молекулы приводит к изменению ее заряда, в частности, потеря заряда приводит к денатурации белка. Наличием этих зарядов обуславливаются также гидратные свойства белков. Например, к положительно заряженной белковой молекуле присоединяются молекулы воды своими отрицательно заряженными концами, и образуется структура, центром которой является белковая молекула, а вокруг нее находится мономолекулярная оболочка воды. Так как все отрицательно заряженные концы молекул воды обращены к белковой молекуле, то на поверхности структуры белок - вода сохраняется тот же заряд. К этой поверхности в свою очередь присоединяются новые группы молекул воды и т.д. При этом вокруг каждой молекулы белка образуется электростатически связанный гидратный слой. Сила связи с белком уменьшается пропорционально квадрату расстояния от центра, т.е. от белковой молекулы, и на достаточно большом в масштабах размеров молекулы расстоянии эта связь настолько мала, что собственное тепловое движение молекул препятствует действию электростатических сил. Это и ограничивает количество воды, удерживаемой поверхностью белка.
По существующим воззрениям белковую ткань можно рассматривать как коллоидное и капиллярно-пористое коллоидное тело очень сложного строения, основу которого составляет структурная сетка из находящихся в набухшем состоянии белков, заключающая вязкие растворы, содержащие растворимые белки и другие азотистые и минеральные вещества, которые обладают гидрофильными свойствами. При этом часть воды, входящей в состав мышечной ткани, прочно удерживается белками структурной сетки, а также молекулами растворенных белков и других гидрофильных веществ.
Наряду с водой, удерживаемой силовым полем на внешней и внутренней поверхности белковых частиц, в мышечной ткани присутствует вода, удерживаемая осмотически и силами механической связи (капиллярноудерживаемая вода). Эта вода находится в жидкостях (растворах), содержащих различные азотистые и органические вещества и минеральные соли, заключенные в замкнутых ячейках (микропорах) внутри белковых структур и пронизывающих последние микро- и макрокапиллярах. По имеющимся в литературе данным, 1 г белка при гидратации связывает в среднем 0,3 г воды.
Все методы обработки, технологические режимы направлены на изменение воды в тканях сырья (насыщение ее солью, превращение в лед, нагрев до температуры, близкой к температуре кипения, испарение). Изменение внутренней энергии воды приводит к нарушению равновесного состояния между белком и водой, образующей гидратную оболочку. Белковая молекула реагирует на это перестройкой собственной структуры и соответственно изменением величины заряда. Когда эти изменения завершаются резким снижением или полным исчезновением заряда наступает денатурация белка.
В зависимости от интенсивности и продолжительности внешнего воздействия денатурация белка может быть или обратимой, иди частично обратимой, или необратимой.
Глубину денатурации можно определить по способности мышечной ткани восстанавливать полностью или частично связь с водой.
Применяемые в настоящее время методы обработки пищевого сырья с высоким содержанием белка приводят в основном к изменениям, которые можно охарактеризовать как частичную денатурацию. Схема денатурации белковой молекулы представлена на рис. 4.
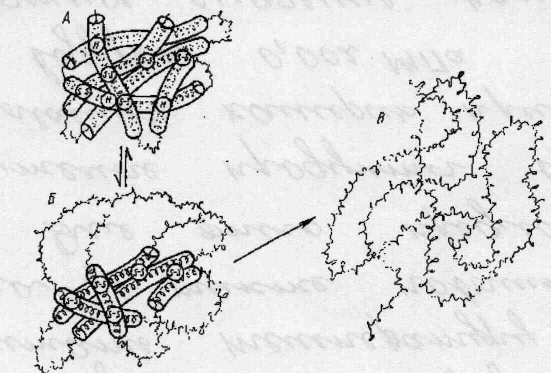
Рис. 4. Схема денатурации белковой молекулы:
А - исходное состояние, Б - начинающееся обратимое развертывание,
В - далеко зашедшее необратимое развертывание.
Наиболее характерными изменениями белка при тепловой денатурации (температура 70-100°С) являются потеря им нативных свойств (способности растворяться в воде, растворах солей и спиртов), а также снижение способности к набуханию.
Изменения белка, связанные с тепловой денатурацией, тем значительнее, чем выше температура и продолжительность нагревания, действие давления, причем в водном растворе белок денатурирует быстрее, чем находясь в высушенном состоянии.
Денатурация белков играет важную роль в ряде технологических процессов: при выпечке хлеба, кондитерских изделий, при сушке мяса, рыбы, овощей, молока и яичного порошка, при изготовлении консервов и т.д.
В условиях доведения продукта до полной готовности обычно при продолжительном воздействии температур близких к 100°С, белки подвергаются дальнейшим изменениям, связанным с разрушением их макромолекул, - гидролизу.
В начале процесса от белковых молекул могут отщепляться летучие продукты: углекислый газ, сероводород, аммиак, фосфористый водород и другие вещества, участвующие в образовании вкуса и аромата готовых изделий. При длительном воздействии воды и тепла происходит образование водорастворимых азотистых веществ вследствие деполимеризации белковой молекулы, что имеет место, например, при переходе коллагена в глютин.
Гидролиз белков можно вызвать с помощью протеолитических ферментов, используемых для интенсификации некоторых технологических процессов (размягчение жесткого мяса, приготовление дрожжевого теста и др.).
Азотосодержащие небелковые вещества.В мышечной ткани наряду с белковыми веществами присутствуют и нерастворимые в воде небелковые азотистые вещества. Это в основном продукты распада белка, образующиеся как в процессах обмена веществ в живом организме, так и в процессах посмертных изменений, главным образом при автолизе и гниении.
В эти продукты хорошо растворяются в воде, в связи с чем носят название экстрактивных веществ. Они в большей степени, чем белки подвержены действию микроорганизмов, поэтому от их содержания зависит стойкость сырья при хранении.
К экстрактивным веществам относятся аммиак, свободные аминокислоты, производные гуанидина, пурина, имидазола, а также аминокислоты, амиды кислот и азотистые основания.
Экстрактивные вещества участвуют в образовании вкуса продукта, вступая в реакции с другими продуктами распада углеводов и жиров, поэтому в процессе обработки стремятся, по возможности их сохранить, за исключением карбамида, который перед обработкой экстрагируют из тканей.
Углеводы— широко распространенные в природе органические вещества. Они составляют значительную часть тканей растительного происхождения (80— 90% сухого вещества) и содержатся в тканях животного происхождения (не более 2%).
Зеленые растения обладают способностью синтезировать углеводы из углекислоты и воды при поглощении световой энергии, создавая высокомолекулярные вещества с большим содержанием химической энергии. Таким образом, растения накапливают огромные запасы органической материи на земле.
Углеводы преобладают в пище человека. Они являются основным источником необходимой организму энергии (при окислении в организме 1 г углеводов выделяется 3,75 ккал тепла). Кроме того, углеводы участвуют в построении липоидов, сложных белков-ферментов и т.п.
Источником углеводов служат главным образом продукты растительного происхождения — хлеб, крупа, картофель, овощи, фрукты, ягоды.
Углеводы подразделяют на три основных класса:
1) моносахариды, или простые сахара, представляющие собой основные структурные единицы — мономеры;
2) олигосахариды, содержащие относительно небольшое количество моносахаридных единиц;
3) полисахариды — высокомолекулярные вещества, состоящие из сотен и тысяч моносахаридов.
Представителями наиболее распространенных моносахаридов являются глюкоза, фруктоза, галактоза; олигосахаридов — дисахарид сахароза (свекловичный или тростниковый сахар), лактоза (молочный сахар) и трисахарид - рафиноза. К полисахаридам относятся крахмал, клетчатка, гликоген, пектиновые вещества и др.
Моносахариды сладки на вкус и растворимы в воде. Сладость сахаров различна. Если сладость сахарозы принять за 100, то сладость фруктозы составит 173, инвертного сахара 130, глюкозы 74, галактозы 32, рафинозы 23, лактозы 16. Полисахариды труднорастворимы или нерастворимы в холодной воде и не обладают сладким вкусом.
Глюкоза, фруктоза и сахароза. Эти сахара легко усваиваются организмом. Первые два содержатся в свободном виде в плодах и овощах.
Сахароза под действием ферментов и кислот распадается на равные количества глюкозы и фруктозы. Смесь вращает плоскость поляризации не вправо, как сахароза, а влево. Поэтому такое преобразование носит название инверсии, а полученная смесь — инвертного сахара.
Сахароза в растворе может гидролизоваться, образуя инвертный сахар:
С12Н22О11 + Н2О С6Н12О6 + С6Н12О6
Сахароза Глюкоза Фруктоза
(инвертный сахар)
Инверсия сахарозы протекает в живых растительных клетках под действием фермента инвертазы. В растениях наблюдается и обратный процесс — синтез сахарозы и) инвертного сахара.
Инвертный сахар образуется при варке киселей, компотов, запекании яблок с сахаром и т.д., он содержится в меде, а также в карамели и других кондитерских изделиях. Продукты, содержащие инвертный сахар, обладают высокой гигроскопичностью, т. е. способностью поглощать воду из воздуха и быстро отсыревать.
При значительном нагревании происходит карамелизация (неполный распад) сахаров. Продукты карамелизации носят название “кулера”. На первых стадиях распада сахаров образуются вещества, которые обусловливают приятный вкус (например, вкус обжаренных овощей). Однако при более высоких температурах богатые сахаром продукты темнеют и приобретают горький вкус.
Карамелизация сахарозы происходит следующим путем:
С12Н22О11 - Н2О С6Н10О5 + С6Н10О5
Сахароза Глюкозан Левулезан
С6Н10О5 + С6Н10О5 С12Н20О10
Глюкозан Левулезан Изосахарозан
2С12Н20О10 - 2Н2О С24Н36О18
Изосахарозан Карамелан
С12Н20О10 + С24Н36О18 - 3Н2О С36Н50О25
Изосахарозан Карамелан Карамелен
При более высокой температуре нагревания среди продуктов распада сахарозы появляется карамелин - С24Н26О13.
Потемнение и ухудшение аромата продуктов, содержащих сахара, нередко вызывается происходящим при нагревании взаимодействием сахаров и аминокислот с образованием меланоидинов.
Интенсивную меланоидиновую реакцию дают сахара, имеющие свободную карбонильную группу (ксилоза, фруктоза, глюкоза, мальтоза). Из аминокислот наиболее сильно реагируют глицин и другие растворимые аминокислоты (аланин, аспарагин). Менее активно действуют слаборастворимые аминокислоты (цистин, тирозин). Меланоидиновая реакция идет наиболее энергично при молярном соотношении между аминокислотами и сахарами 1:2.
Сахар реагирует с аминокислотой по следующей схеме:
О Н
// \
СН2ОН(СНОН)4 С + N СН2СООН
\ /
Н Н
Н
/
СН2ОН(СНОН)4 С NНСН2СООН.
\
ОН
Меланоидиновая реакция сопровождается образованием ряда промежуточных соединений: альдегидов, циклических группировок фурфурольного, а затем и пиррольного характера. В частности, может образоваться ядовитый оксиметилфурфурол
СНСН Н
/
НОН2 С С С С
\ / \\
О О
Меланоидиновые реакции активируются при повышенных температурах, особенно в случае многократного подогрева. Меланоидины могут образоваться не сразу после подогрева, а в процессе хранения консервов.
Гликоген.Из сложных углеводов животного происхождения наибольшее значение имеет гликоген. Он откладывается в основном в печени (в пределах 2—10%) и служит запасным питательным веществом. Из гликогена постепенно освобождается и поступает в кровь глюкоза, которая служит источником углеводов для всех тканей.
Крахмал. Наиболее важным углеводом для человека является крахмал. В дневном рационе он обычно составляет 80—85% общего количества углеводов.
Крахмал - один из продуктов фотосинтеза, протекающего в зеленых листьях растений. Он откладывается в растительных тканях в форме своеобразных зерен, имеющих слоистое строение и размеры от долей до 100 мкм и более.
Различают клубневое крахмалосодержащее сырье (клубни картофеля, батата, маниока и др.) и зерновое (зерно кукурузы, пшеницы, риса, сорго, ячменя и др.) и в соответствии с этим клубневый и зерновой крахмалы.
Молекулы крахмала состоят из огромного количества молекул глюкозы; различаются они размерами, а также структурой и формой цепей. Полисахариды, составляющие крахмал, подразделяются на две фракции - амилозу и амилопектин.
В амилозную фракцию (молекулярная масса 160 тыс. и выше, а по некоторым данным, более 1 000 000) входят молекулы с линейной структурой; различаются молекулы по длине.
Амилопектиновая фракция включает полисахариды с молекулярной массой порядка 5-108, структура которых мало изучена.
Крахмальное зерно представляется в виде биологического образования с хорошо организованными формой и структурой. Оно содержит более или менее центрально расположенное ядро, называемое зародышем, или точкой роста. Вокруг ядра часто видны ряды концентрических слоев «колец роста», которые особенно характерны для картофельного крахмала.
Расположение молекул амилозы и амилопектина в слое крахмального зерна представлено на рис. 5.
Качественное и количественное содержание в составе полисахаридов амилозы и амилопектина в определенной степени сказывается на физико-химических свойствах крахмала, а следовательно, и на качестве готовой продукции.

Рис. 5. Схема строения крахмального зерна (по Мюлеталеру):
а — амилоза; б — амилопектин; в — расположение молекул
амилозы и амилопектина в слое крахмального зерна
Крахмал, богатый амилопектином, называют амилопектиновым. Крахмал, наполовину или более состоящий из амилозы, - высокоамилозным. Крахмал, свойства которого условно принимаются аналогичными свойствам крахмала, содержащегося в органах растений, называют нативным.
При кулинарной обработке крахмалосодержащих продуктов крахмал проявляет способность к адсорбции влаги, набуханию и клейстеризации, в нем могут протекать процессы деструкции и агрегации молекул.
Интенсивность всех этих процессов зависит от происхождения и свойств самого крахмала, а также от технологических факторов — температуры и продолжительности нагревания, соотношения крахмала и воды, вида и активности ферментов и др.
Основные свойства крахмала проявляются в водной среде.
Нативный крахмал в холодной воде практически нерастворим, но может адсорбировать до 30% влаги. Низкомолекулярные полисахариды, содержащие до 70 глюкозных остатков, растворимы в холодной воде. С увеличением молекулярной массы полисахариды растворимы только в горячей воде.
По сравнению с амилозой амилопектин менее растворим в воде и более устойчив при различных видах технологической обработки крахмала.
Известно, что линейные полимеры перед растворением сильно набухают, поглощая большое количество растворителя, и при этом резко увеличиваются в объеме. Растворению крахмальных полисахаридов в воде также предшествует набухание — одно из важнейших свойств крахмала, которое оказывает влияние на консистенцию, форму, объем и выход готовых изделий.
Степень набухания крахмальных зерен в воде в значительной мере зависит от температуры и свойств данного вида крахмала.
Больше всего набухает крахмал клубневых, меньше — зерновых и еще меньше — крахмальных зерен, содержащих большое количество амилопектина (амилопектиновые крахмалы).
Использование крахмала в пищевой промышленности связано главным образом с его способностью клейстеризоваться.
Одним из признаков клейстеризации суспензии крахмала является значительное повышение ее вязкости, т. е. образование крахмального клейстера, вязкость которого при нагревании объясняется свойствами извлекаемой из крахмальных зерен водорастворимой фракции, состоящей из полисахаридных нитей диаметром 0,05-2 мкм, образующих в растворе трехмерную сетку, удерживающую большее количество влаги, чем набухшие крахмальные зерна.
Дисперсия, состоящая из набухших крахмальных зерен и растворимых в воде полисахаридов, называется крахмальным клейстером, а процесс его образования — клейстеризацией.
Клейстеризация происходит в определенном интервале температур, характерном для данного вида крахмала, обычно от 55 до 80°С.
Крахмальные клейстеры относительно жидкой консистенции служат основой многих кулинарных изделий (кисели, соусы, супы-пюре), содержащих 2—5% крахмала. Клейстеры более плотной консистенции образуются в клетках вареного картофеля, кашах и других изделиях, где соотношение крахмала и воды примерно 1:2—1:5.
Примерное содержание амилозы в крахмале различного происхождения, степень набухания крахмала в горячей воде (90°С) и температура клейстеризации приведены в табл. 1.
Таблица 1.
|
Вид крахмала |
Количество амилозы, % |
Степень набухания (Кv), % |
Температура клейстеризации, °С |
|
Картофельный |
32,1 |
1005 |
58-62 |
|
Маниоковый |
22,56 |
775 |
56-68 |
|
Бататный |
21,84 |
862 |
58 |
|
Пшеничный |
21,37 |
688 |
54-92 |
|
Кукурузный |
19,25 |
752 |
66-88 |
|
Рисовый |
20,02 |
648 |
56-65 |
|
Кукурузный амилопектиновый |
5,76 |
608 |
62-68 |
|
Рисовый амилопектиновый |
2,91 |
405 |
54-66 |
В процессе длительного хранения и охлаждения изделий, содержащих клейстеризованный крахмал, происходит ретроградация крахмальных полисахаридов — переход их из растворимого в нерастворимое состояние вследствие агрегации молекул (образования кристаллической структуры).
Это явление считается одной из причин черствения хлеба и старения изделий из круп. Ретроградация усиливается при неоднократном замораживании и оттаивании и приводит к резкому ухудшению качества кулинарных изделий. Ретроградацию частично можно устранить нагреванием.
Использование различных физико-химических свойств крахмала позволяет получать на основе этого природного полимера полуфабрикаты, обладающие необходимой водопоглотительной способностью, пластичностью и др.
При более высоких температурах крахмальные зерна претерпевают ряд изменений. Так, термическая обработка продуктов, содержащих крахмал (варка в воде, на пару, выпечка, сушка при атмосферном и повышенном давлении, жаренье во фритюре и др.) и приготовленных о разнообразной рецептуре, приводит к получению изделий различной консистенции (супы, соусы) и способствует образованию структур хлеба, воздушных продуктов типа зерен, палочек, крекеров и др.
При кулинарной и промышленной переработке крахмалосодержащих продуктов (нагревание в присутствии воды, под действием повышенного давления, горячего жира, сухого нагрева при температурах выше 100°С) происходит деструкция крахмала. Крахмал подвергается деструкции и под действием амилолитических ферментов. В результате снижается способность крахмала к набуханию в горячей воде и клейстеризации.
Коэффициенты деструкции крахмала, т.е. относительное падение степени его набухания при изготовлении различных крахмалосодержащих изделий неодинаковы и зависят от условий его обработки и вида продукта (табл. 2).
Так, при использовании крахмала или крахмалопродукта в качестве загустителя необходимо учитывать их природные свойства, а также степень изменения при термической обработке. Например, при пассеровании муки при температура 150°С природные свойства крахмала (вязкость, способность к набуханию) снижаются в два раза, поэтому сухой нагрев муки следует ограничивать 120°С.
Клетчатка.Этот полисахарид, называемый иначе целлюлозой, подобно гликогену и крахмалу при гидролизе дает только глюкозу. Клетчатка входит в состав оболочек клеток растительных тканей, много ее в листьях, стеблях. В отличие от гликогена и крахмала клетчатка при нагревании в воде не переходит в раствор.
Таблица 2
|
Способы термической обработки |
Коэффициент деструкции КД |
|
Пассерование муки: |
|
|
нагрев до 120°С (белая пассеровка) . . . . . . . . . . . |
0,05 |
|
нагрев до 150°С (красная пассеровка) . . . . . . . . . |
1,94 |
|
Обжаривание и подсушивание круп при 100-120°С (в зависимости от вида круп): |
|
|
гречневой . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . |
0,33-0,49 |
|
риса . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . |
0,61-1,58 |
|
Варка каш: |
|
|
гречневой (из обжаренной крупы), температура до 100 оС |
0,39-0,75 |
|
Жаренье во фритюре: |
|
|
полуфабриката крекеров (температура жира 150-180°С) |
От 0,7 до 1,99 |
|
Выпечка изделий из теста в жарочном шкафу: |
|
|
дрожжевого . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . |
3,0-3,5 |
|
слоеного (пресного) . . . . . . . . . . . . . . . . . . . . . . . . . |
4,0-4,5 |
|
Обработка повышенным давлением: разваривание кукурузы под давлением 0,2 Мпа (90 мин) |
0,29 |
|
получение кукурузных палочек (давлением в экст- рудере — 3-4 МПа) . . . . . . . . . . . . . . . . . . . . . . . . . . |
2,1 |
|
получение взорванных зерен кукурузы, риса, пшена (в «пушке», давление 12ּ105 Па) . . . . . . . . . |
От 8 до 32 |
|
Замораживание теста и хранение его при — 12°С |
0,017 |
Так как клетчатка почти не переваривается в желудочно-кишечном тракте человека, ее относят к группе балластных веществ, которые, однако, необходимы организму для регуляции двигательной функции кишечника.
Молекула целлюлозы имеет нитевидную форму и построена из глюкозных остатков, количество которых колеблется от 1400 до 10000. 60—70 молекул целлюлозы соединены в пучки—мицеллы, образующие сетчатую структуру.
Целлюлоза нерастворима в воде и в большинстве органических растворителей. Она растворяется лишь в реактиве Швейцера [Сu(NН3)4] (ОН)2, а также в концентрированных минеральных кислотах, при кипячении.
Повышенное содержание целлюлозы делает пищу грубой, менее доступной для действия ферментов, выделяемых в пищеварительном тракте, и поэтому хуже усваиваемой. Для выработки диетических и детских консервов предпочитают сырье, бедное целлюлозой (кабачки, тыква, рис).
Целлюлоза повышает стойкость растительного сырья против механических воздействий и нагревания, но затрудняет некоторые операции технологического процесса (протирание, уваривание).
Среди пищевых продуктов клетчаткой богаты мука низших сортов, орехи, плоды и овощи.
Гемицеллюлозы. К гемицеллюлозам—высокомолекулярным полисахаридам, которые входят в состав оболочек растительных клеток, относятся гексозаны (галактан, маннан) и пентозаны (арабан, ксилан), дающие при гидролизе сахара. Наиболее распространен арабан. В семенах бобовых содержится галактан. Количество пентозанов в плодах колеблется от 0,5 до 1,0%.
Большинство гемицеллюлоз нерастворимо в воде, за исключением некоторых пентозанов, образующих клейкие растворы.
Гемицеллюлозы менее устойчивы, чем целлюлоза, и под действием ферментов или кислот гидролизуются, образуя сахара.
При продолжительном кипячении с крепкой соляной кислотой из пентозанов образуется фурфурол, что можно использовать при утилизации отходов производства (плодоножки овощей стержни початков кукурузы и др.).
Пектиновые вещества. Среди высокомолекулярных углеводов важная роль принадлежит и таким полисахаридам, как пектиновые вещества. Их свойства имеют существенное значение для образования структуры пищевых продуктов и используются при изготовлении желированных изделий (студни, фруктовые желе и т.д.).
В растительных тканях содержатся нерастворимые в воде протопектины. При гидролизе протопектины дают высокомолекулярные пектиновые кислоты. Протопектины обусловливают связь между клетками в растительной ткани. Основная масса их находится в срединных пластинках, склеивающих клетки в сыром продукте. Пектиновые вещества играют важную роль в создании плотной мякоти.
Молекулу нерастворимого пектина рассматривают как гетерополимер, имеющий сложную разветвленную структуру (рис. 6).
Главная цепь этого полимера состоит из многих молекул галактуроновой и полигалактуроновой кислот, соединенных моносахаридом рамнозой. К главной цепи ковалентными связями присоединены боковые цепи гемицеллюлоз — галактанов и арабанов.
В недозрелых плодах содержится преимущественно нерастворимый в воде протопектин, цементирующий растительную ткань. По мере созревания плодов происходит распад части протопектина и образуется растворимый в воде пектин. Этот процесс идет под действием фермента протопектиназы, а также органических кислот, содержащихся в плодах.

Рис. 6. Структура молекулы пектина (по Альберсхейму):
Р — рамноза, ГК — галактуроновая кислота
При тепловой обработке продуктов растительного происхождения содержащийся в них протопектин переходит в растворимую форму - пектин, вследствие чего сцепление между клетками ослабевает и растительная ткань размягчается.
При наличии сахара и кислоты пектины способны образовывать студни. В пищевой промышленности это свойство широко используется при производстве мармелада, пастилы, джема.
Растворимость пектина в воде тем больше, чем меньше размеры его молекулы. Благодаря большой молекулярной массе пектина его водные растворы, как и растворы других высокополимеров, обладают рядом свойств, присущих коллоидным растворам.
Пектин может быть переведен из раствора в осадок в виде пектата кальция под действием фермента пектииэстеразы (пектинмет-оксилаза, пектаза или пектилгидролаза), катализирующего гидролитическое расщепление эфирных связей в молекуле пектина.
Распад пектина до растворимой моногалактуроновой кислоты осуществляется при помощи фермента полигалактуроназы (пектиназа, пектолаза, полигалактуронид гликаногидролаза), который разрывает связи между звеньями цепи полигалактуроновой кислоты.
Нагревание в присутствии воды вызывает разрушение пектина.
Дубильные вещества. По химической природе дубильные вещества относятся к полифенолам, имеют молекулярную массу от 600 до 2000 и разделяются на гидролизуемае и конденсированные. Первые представляют собой смесь сложных эфиров, образованных глюкозой, фенольными кислотами — галловой, протокатеховой — и производными этих кислот. В эту группу входит танин, гидролиз которого проходит под действием фермента таназы, а также может быть вызван кислотами. При расщеплении одной молекулы танина образуется одна молекула глюкозы и пять молекул галловой или метадигалловой кислоты, которые были присоединены к глюкозе по месту всех ее гидроксильных групп.
Конденсированные дубильные вещества, к которым относятся катехины, имеют ядра, связанные между собой через углеродные атомы. Они являются эфирами и гидролизу не подвергаются.
В плодах катехины находятся в свободном виде или в виде сложных эфиров галловой кислоты.
Дубильные вещества окисляются кислородом воздуха под действием ферментов. В результате окисления образуются флобафены коричневого или красного цвета. Процесс протекает быстро и является одной из основных причин потемнения плодов, наблюдающегося иногда во время их переработки.
Согласно теории А. Н. Баха, окисление полифенольных соединений происходит по следующей схеме.
Насыщенные соединения (R), обладающие способностью легко окисляться, образуют
О
/
перекиси R + О2 R | , которые под действием фермента пероксидазы
\
О
окисляют полифенолы (В) и при этом восстанавливаются:
О
/
В + R | ВО + RО; В + RО ВО + R.
\
О
Чтобы предотвратить потемнение плодов, вызываемое окислением дубильных веществ, нужно защитить их от воздействия кислорода воздуха или принять меры к разрушению ферментной системы.
Потемнение плодов может быть также следствием химического взаимодействия дубильных веществ с солями окиси железа. При этом гидролизуемые дубильные вещества дают черную окраску с синим оттенком, а конденсированные—с зеленым.
Вступая в реакцию с солями олова, дубильные вещества образуют соединения, имеющие розовую окраску.
При длительном нагревании наблюдается конденсация дубильных веществ с образованием высокомолекулярных соединений красного оттенка.
Дубильные вещества хорошо растворяются в воде. С белковыми веществами они дают нерастворимые соединения (танаты).
Гликозиды. Гликозиды состоят из углеводов (гексоз и пентоз), соединенных с различными химическими веществами (спиртами, альдегидами, фенолами и др.).
В воде гликозиды растворимы. Под действием ферментов или кислот они гидролизуются, распадаясь на составные части: сахар и несахаристый компонент—аглюкон. Свойства гликозидов зависят от вида входящего в их состав аглюкона. Многие гликозиды придают плодам и овощам специфический привкус, аромат и цвет.
К гликозидам относятся гидролизуемые дубильные вещества, красящие вещества группы антоцианов, амигдалин, соланин, геспервдин, иарингин, вакцинин и др.
Амигдалин. Это гликозид, образованный генциобиозой и агликоном, содержащий бензойный альдегид и синильную кислоту следующего строения
С6Н5
R-0-СН ,
СN
где R — углеродный радикал.
Амигдалин находится в семенах косточковых плодов и придает им привкус и аромат, свойственные горькому миндалю. Амигдалину сопутствует расщепляющий его комплексный фермент эмульсин. Гидролизуясь в организме человека, амигдалин выделяет ядовитую синильную кислоту.
С20Н27NО11 + 2Н2О - 2С6Н12О6 + С6Н5СНО + НСN.
Соланин. Соланин встречается в некоторых овощах (томатах, баклажанах) и картофеле. Состав соланина разных видов овощей неодинаков.
В картофеле соланин находится главным образом в кожице и в прилегающем к ней поверхностном слое, придавая им горький привкус. В состав соланина картофеля (С45Н71 NО15) входят сахара: рамноза, галактоза, глюкоза—и аглюкон соланидин, являющийся производным фепантрена (С14Н10), относящегося к ароматическим трехъядерным соединениям.
В баклажанах, достигших ботанической зрелости, иногда наблюдается ярко выраженный горький привкус, вызванный соланином М, который имеет формулу С31Н51 NО15 и состоит из соланидина С21Н33NО и остатков галактозы и рамнозы.
Бетаин находится в свекле. Он состоит из глюкозы и азотсодержащего аглюкона бетанидина.
Антоцианы хорошо растворимы в воде. При длительном нагревании они могут разрушаться и терять свой цвет (земляника, плоды некоторых сортов сливы, черешни, корнеплоды). В то же время нагревание заметно не влияет на антоцианы черной смородины.
В присутствии металлов антоцианы некоторых плодов меняют свою окраску. Олово придает черной смородине синий, а вишне и черешне фиолетовый оттенок. Алюминий вызывает фиолетовое окрашивание вишни и черешни, но не влияет на цвет красного винограда. Антоцианы винограда значительно меняют окраску в присутствии железа, олова, меди.
Флавоны и флавонолы имеют желтую окраску (петрушка). К флавоноловым агликонам относятся кверцетин—красящее вещество лука.
Липиды.В группу соединений под названием липиды входят собственно жиры и ряд более сложных соединений. Все они представляют собой эфиры высокомолекулярных спиртов и жирных кислот (в состав некоторых из них, таких как фосфатиды, стерины, цереброзиды входят другие органические соединения и фосфор) и обладают общим свойством растворенным в органических растворителях. Липиды из-за довольно малой устойчивости эфирной связи разрушаются на составляющие компоненты, основным из которых является жирная кислота. Схема образования липидов и структура жирных кислот представлена на рис. 7.
// O
Н2С ОН Н2С О C
\ R1
// O
НС ОН + 3RСOOH HC О C
жирная \ R2
