
- •Вопрос 6. Структурная организация и свойства биологической мембраны.
- •Вопрос 11. Поверхностный аппарат клетки. Транспорт макромолекул.
- •Вопрос 15 . Поверхностный аппарат клетки. Транспорт макромолекул.
- •Вопрос 19. Система сигнализации: эндокринная, синоптическая. Роль медиаторов и гормонов.
- •Вопрос 20. Понятие о вторичных посредниках. Инозитолфосфатная система
- •Вопрос 21. Понятие о вторичных посредниках. Аденилатцеклазная система
- •Вопрос 24. Синаптическая передача нервного импульса.
- •Вопрос 30. Митохондрии. Организация потока энергии в клетке.
- •Вопрос 37. Лизосомы. Образование строение функция. Гетерогенность лизосом. Патологии лизосом.
- •Вопрос 38. Опишите путь секреторного белка от места синтеза белка до выхода из клетки.
- •Вопрос 40. Опишите путь макромолекулы от момента поступления её в клетку до момента усвоения.
- •Вопрос 41. Роль аг и эр в регенерации и обновлениях поверхностного аппарата клетки (пак)
- •Синтез в эндоплазматическом ретикулуме
- •Строение мышцы.
- •Вопрос 50:Морфология ядерных структур.
- •Вопрос 51. Роль ядерных структур в жизнедеятельности клетки
- •Вопрос 53. Ядро-система хранения, воспроизведение и реализации генетического материала.
- •Вопрос 54. Организация и свойства клеточного ядра.
- •Поток информации
- •Вопрос 57. Организация эу- и гетерохроматина. Структура и химия хромасаомы.
- •Вопрос 58. Уровни структурной организации хроматина
- •Вопрос 59. Первый уровень компактизации днк. Структурная роль нуклиосом. Нуклиосомы при репликации. Политенные хромосомы.
- •Вопрос 60. Второй и третий уровень организации хромотина.
- •Вопрос 62.Самовоспроизведение наследственного материала.
- •Вопрос 64. Способы записи генетической информации в молекуле днк. Биологический код и его ф-ции.
- •Вопрос 70. «Центральная догма»молекулярной биологии. Понятие об обратной транскрипции. Современные проблемы генной инжинерии.
- •Вопрос 71. Синтез белка в клетке. Генетический код. Функции и-,т-,р-рнк.
- •72.Особенности образования иРнк в клетках эу- и прокариот.
- •Основания и правила…
- •Вариации на тему.
- •Рибосома.
- •Подумаем…
- •73.Экспресся генетической информации у эукариот.
- •74.Экспресся генетической информации у прокариот.
- •75.Регуляция экспрессии генов у эукариот (на уровне транскрипции, процессинга и посттранскрипционном уровне).
- •76.Регуляция экспрессии генов у прокариот. Индукция синтеза катаболических ферментов (Lac-оперон).
- •77.Регуляция экспрессии генов у прокариот. Репрессия синтеза анаболических ферментов (trp-оперон).
- •3. Репрессия синтеза белков. Триптофановый и гистидиновый опероны
- •78.Общие принципы генетического контроля экспрессии генов.
- •79.Роль регуляторных белков в регуляции генной активности (репрессоры, активаторы).
- •80.Организация генома прокариот.
- •81.Организация генома эукариот.
- •82.Неклеточные формы жизни. Вирусы.
- •83.Цитологические основы бесполого размножения. Механизмы поддержания постоянства кариотипа поколений организмов и клеток.
- •84.Жизненный цикл клетки. Регуляция митотического цикла.
- •85.Нарушения клеточного цикла. Амитоз. Эндомитоз. Политения.
- •86.Бесполое размножение и его формы.
- •Размножение делением
- •Размножение спорами
- •87.Половое размножение. Регулярные и нерегулярные формы.
- •88.Цитологические основы полового размножения. Мейоз, как специфический процесс при формировании половых клеток.
- •89.Гаметогенез. Строение половых клеток.
- •90.Закономерности сперматогенеза у млекопитающих и человека.
- •91.Закономерности овогенеза у млекопитающих и человека.
- •Развитие половых клеток.
- •92.Оплодотворение, его формы и биологическая функция. Моно- и полиспермия.
- •93.Морфологические и функциональные особенности зрелых гамет млекопитающих и человека.
- •1.Общие св-ва и уровни организации генетического аппарата (геном, генотип, кариотип).
- •2.Ген – функциональная единица наследственности. Эволюция представлений о гене.
- •3.Особенности генома эукариот.
- •4.История изучения структуры гена.
- •5.Сравнительная хар-ка геномов прокариот и эукариот.
- •6.Регуляция экспрессии генов у эукариот.
- •7.Регуляция экспрессии генов у прокариот.
- •1. Теория оперона
- •8.Международная программа (геном человека).
- •Предпосылки
- •9.Организация генома человека.
- •10.Понятие о геномике и новый взгляд на эволюцию.
- •11.Экспериментальные доказательства генетической роли нуклеиновых кислот.
- •12.Химическая организация гена. Классификация генов по структуре и функциям.
- •13.Генетический полиформизм и разнообразие геномов человека.
- •14.Новый взгляд на эволюцию Homo sapiens.
- •15.Биохимическая уникальность человека. Гены предрасположенности.
- •16.Организация генома митохондрий. Митохондриальные болезни.
- •17.Общие принципы генетического контроля экспрессии генов.
- •18.Нейтральные мутации. Генетический полиморфизм.
- •19.Классификация генов человека по структуре и функциям.
- •20.Генетически модифицированные продукты. Польза или вред?
- •21.Организация геномов рнк- и днк- содержащих вирусы.
- •22.Признаки клеток, трансформированных опухолеродными вирусами.
- •24.Онкогенные вирусы. Жизненный цикл ретровирусов.
- •25.Роль вирусов в неопластической трансформации клеток.
- •26.Морфофизиологические особенности опухолевых клеток.
- •27.Использование новых технологий в создании генетической рекомбинации организмов (генотерапия, клеточная терапия).
- •Описание
- •28.Генная диагностика и генная терапия. Схема генной коррекции.
- •29. Генетическое тестирование. Генная и клеточная терапия.
- •30.Периоды онтогенеза человека. Пренатальное и постнатальное развитие.
- •31.Периоды онтогенеза человека (пренатальное развитие). Понятие о критических периодах.
- •32.Метод экстракорпорального оплодотворения (эко0. Об искусственном оплодотворении.
- •33.Закономерности развития зародыша. Мозаичный тип развития.
- •Мозаицизм, ограниченный плацентой
- •34 .Закономерности развития зародыша. Регулярный тип развития (эмбриональная индукция).
- •35.Молекулярные основы механизмов эмбрионального развития. Понятие о морфогенах и гомеозисных генах.
- •36.Понятие об эпигенетической изменчивости.
- •37.Молекулярные механизмы развития зародыша. Метилирование цитозина в днк – регуляция генной активности.
- •38. Введение в тератологию. Понятие о критических периодах.
- •39.Классификация тератогенов.
- •40.Периоды онтогенеза человека (постнатальное развитие).
- •41.Стволовые клетки и их использование в медицине.
- •42.Иерапевтическое клонирование. Понятие о стволовых клетках.
- •43.Клонирование и вопросы трансплантации.
- •44.Вопросы трансплантации. Виды трансплантации.
- •45.Дифференциация пола эмбриона. Развитие вторичных половых признаков.
- •46.Дифференциация мужской половой системы.
- •47.Дифференциация женской половой системы.
- •48.Развитие пола в онтогенезе. Балансовая теория определения пола (гипотеза Бриджеса). Переопределение пола в онтогенезе.
- •49.Хромосомная теория определения пола.
- •50.Роль наследственных и средовых факторов в опрелении половой принадлежности
- •51.Проблемы старения организма. Факторы старения. Долгожители. Преждевременное старение.
- •52.Современное представление о механизмах старения.
- •53.Общие понятия о генетическом материале и его свойствах. Роль ядра и цитоплазмы в наследственности и изменчивости.
- •54.Цитоплазматическая наследственность.
- •55.Этапы развития генетики.
- •56.Законы г.Менделя и их цитологическое обоснование.
- •57.Статистический характер законов г.Менделя. Условие их выполнения.
- •58.Наследование групп крови (аво – система) и резус-фактора у человека.
- •59.Количественная и качественная специфика проявления генов в признаках. Плейотропия, пенетрантность, экспрессивность, генокопии.
- •60.Сцепленное наследование. Эксперименты т.Моргана.
- •61.Наследование признаков, сцепленных с полом. Наследование признаков контролируемх х и у хромосомой человека. Явления истинного и ложного гермафродитизма.
- •62.Основные положения хромосомной теории наследственности. Генетические и цитологические карты хромосом.
- •64. Определение пола у организмов Переопределение пола.
- •65.Фенотип организма. Роль наследственности и среды в формировании фенотипа.
- •66.Модификационная изменчивость. Норма реакции.
- •Условная классификация модификационной изменчивости
- •Механизм модификационной изменчивости Окружающая среда как причина модификаций
- •Характеристика модификационной изменчивости
- •67.Рекомбинация наследственного материала в генотипе. Комбинативная изменчивость.
- •68.Мутационная изменчивость и её виды.
- •69.Соматические мутации. Понятие о клеточных клонах. Понятие о мозаицизме.
- •70.Генеративные мутации.
- •71.Виды мутаций. Спонтанные и индуцированные. Классификация мутагенов.
- •72.Геномные мутации. Болезни, связанные с нарушением количества аутосом.
- •Болезни, обусловленные нарушением числа аутосом (неполовых) хромосом
- •Болезни, связанные с нарушением числа половых хромосом
- •73. Геномные мутации. Болезни, связанные с нарушением количества половых хромосом.
- •75Геномные мутации у человека и их последствия. Болезни обмена веществ. Характеристика наиболее частых трисомий
- •76.Роль ферментов в клеточном метаболизме. Энзимопатии.
- •Углеводы
- •Нуклеотиды
- •77.Человек как специфический объект генетического анализа. Медико-генетическое консультирование и прогнозирование.
- •78.Мутации несовместимые с жизнью человека.
- •80.Причины гетероплоидии у человека.
- •81.Изменения нуклеотидных последовательностей днк. Генные мутации.
- •82.Изменение структурной организации хромосом. Хромосомные мутации.
- •83.Методы в генетике человека. Генеалогический метод. Принципы построения родословных и их типы.
- •84.Методы в генетике человека. Цитогенетические методы. Кариотип человека.
- •85.Кариотип человека. Денверская и Парижская Классификация хромосом.
- •86.Методы в генетике человека. Близнецовый метод.
- •87. Методы в генетике человека. Биохимический метод. Дерматоглифика.
- •88. Методы в генетике человека. Молекулярно-генетические методы (исследование днк). Генетическое тестирование. Генетическое прогнозирование.
- •89.Генетическая гетерогенность популяций в человеческом обществе. Популяционно-статистический метод.
- •1.Паразитизм, как биологический феномен. Специфика среды обитания паразитов.
- •2.Экологические основы выделения групп паразитов. Классификация паразитических форм животных.
- •3.Популяционный уровень взаимодействия паразитов и хозяев. Типы регуляции и механизмы устойчивости системы «паразит-хозяин».
- •4.Пути происхождения групп паразитов.
- •5.Пути морфо-физиологической адаптации к паразитическому образу жизни.
- •6. Понятие об трансмиссивных болезнях. Экологические основы их выведения.
- •7.Природноочаговые протозоонозы. Структура природного очага, основные эелементы (на примере лейшманиоза).
- •8.Природноочаговые гельминтозы. Структура природного очага, основные элементы.
- •9.Природноочаговые трансмиссивные инвазии и инфекционные болезни. Экологические основы и их выделения. Основные элементы природного очага.
- •10.Понятие об антропонозах, энтропозоонозах. Зоонозах.
- •12.Простейшие – полостные паразиты человека. Простейшие, обитающие в полостных органах, сообщающихся с внешней средой
- •Выделяют следующие группы простейших:
- •13.Виды малярийных плазмоидов, патогенное действие для человека. Лабораторная диагностика. Виды (формы) малярии
- •14.Дизентерийная амёба. Особенности строения, цикла развития, пути распространения, патогенное действие. Методы лабораторной диагностики.
- •15.Токсоплазма. Морфофункциональная характеристика: цикл развития, пути заражения, патогенное действие, методы лабораторной диагностики.
- •16.Понятие о гельминтах. Гео- и биогельминты.
- •17.Тип членистоногие. Эпидемиологическое значение клещей.
- •18.Тип членистоногих. Отряд Насекомые, имеющие эпидемиологическое значение.
- •19.Виды экологии: аутэкология, демэкология, синэкология. Понятие об экосистеме.
- •20.О преобразовании природной среды (4 направления). Охранные мероприятия. Красная книга. Национальные парки, заповедники, заказники.
- •21.О влиянии радиации на организм человека.
- •22.Вопросы радиационной безопасности человека. Последствия аварии на Чернобыльской аэс.
- •23.Факторы, влияющие на изменение климата.
- •Климатические изменения на Земле
- •24.Химическое и радиоактивное загрязнение окружающей среды. «Зелёные столицы» Европы.
- •25.Загрязнение окружающей среды. Альтернативные источники энергии.
- •26.Медико-биологические аспекты экологии человека. Проблема питания. Экологически чистые продукты. Генетически модифицированные продукты.
- •36.Клиническая классификация растений опасных для здоровья. Растения, действующие на ссс.
Вопрос 19. Система сигнализации: эндокринная, синоптическая. Роль медиаторов и гормонов.
Шпора 10.
Роль медиаторов: обеспечение механической прочности, обмен вещест, транспорт веществ
Вопрос 20. Понятие о вторичных посредниках. Инозитолфосфатная система
Функционирование инозитолфосфатной системы трансмембранной передачи сигнала обеспечивают: R (рецептор), фосфолипаза С, Gрlс - белок, активирующий фосфолипазу С, белки и ферменты мембран и цитозоля.
Последовательность событий, приводящих к активации фосфолипазы С:
связывание сигнальной молекулы, например гормона с рецептором (R) вызывает изменение конформации и увеличение сродства к Gplc-белку.
образование комплекса [Г] [R] [Gрlс ГДФ] приводит к снижению сродства α-протомера G рlс белка к ГДФ и увеличению сродства к ГТФ. ГДФ заменяется на ГТФ.
это вызывает диссоциацию комплекса; отделившаяся α-субъединица, связанная с молекулой ГТФ, приобретает сродство к фосфолипазе С.
α-ГТФ взаимодействует с фосфолипазой С и активирует её. Под действием фосфолипазы С происходит гидролиз липида мембраны фосфатидилинозитол-4,5 - биофосфата (ФИФ2).
в ходе гидролиза образуется и выходит в цитозоль гидрофильное вещество инозитол-1,4,5-трифосфат (ИФ3). Другой продукт реакции диацилглицерол (ДАГ) остаётся в мембране и участвует в активации фермента протеинкиназы С (ПКС).
инозитол-1,4,5-трифосфат (ИФ3) связывается специфическими центрами Са2 - канала мембраны ЭР, это приводит к изменению конформации белка и открытию канала - Са²+ поступает в цитозоль. В отсутствие в цитозоле ИФ3 канал закрыт.
Активация протеинкиназы С.
• Повышение концентрации Са²+ в цитозоле клетки увеличивает скорость
взаимодействия Са²+ с неактивным цитозольным ферментом протеинкиназой С(ПКС) и белком кальмодулином, таким образом сигнал, принятый рецептором клетки, раздваивается.
• Связывание протеинкиназы С с ионами кальция позволяет ферменту вступать в кальций-опосредованное взаимодействие с молекулами "кислого" фосфолипида мембраны, фосфатидилсерина (ФС). Диацилглицерол, занимая специфические центры в протеинкиназе С, ещё более увеличивает её сродство к ионам кальция.
• На внутренней стороне мембраны образуется ферментативный комплекс - [ПКС] [Са²+] [ДАГ] [ФС] - активная протеинкиназа С, фосфорилирующая специфические ферменты по серину и треонину.
Вопрос 21. Понятие о вторичных посредниках. Аденилатцеклазная система
Наиболее изученным является аденилатциклазный путь передачи гормонального сигнала. В нем задействовано мимимум пять хорошо изученных белков: 1)рецепторгормона; 2)ферментаденилатциклаза, выполняющая функцию синтеза циклическогоАМФ(цАМФ); 3) G-белок, осуществляющий связь междуаденилатциклазойирецептором; 4) цАМФ-зависимаяпротеинкиназа, катализирующаяфосфорилированиевнутриклеточныхферментовили белков-мишеней, соответственно изменяя ихактивность; 5)фосфодиэстераза, которая вызывает распадцАМФи тем самым прекращает (обрывает) действие сигнала (рис. 8.5).
Получены в чистом виде α- и β-адренергические рецепторыизплазматических мембранклетокпечени, мышц ижировой ткани. Показано, что связываниегормонас β-адренергическимрецепторомприводит к структурным изменениям внутриклеточногодоменарецептора, что в свою очередь обеспечивает взаимодействиерецепторасо вторымбелкомсигнального пути – ГТФ-связывающим.
ГТФ-связывающий белок– G-белок – представляет собой смесь 2 типовбелков: активного Gs(от англ. stimulatory G) и ингибиторного Gi с мол. массой 80000–90000. В составе каждого из них имеется три разные субъединицы (α-, β- и γ-), т.е. это гетеротримеры. Показано, что β-субъеди-ницы Gsи Giидентичны (мол. масса 35000); в то же время α-субъединицы, являющиеся продуктами разныхгенов(мол. масса 45000 и 41000), оказались ответственными за проявление G-белком активаторной и ингибиторнойактивностисоответственно. Гормонрецепторный комплекс сообщает G-белку способность не только легко обменивать эндогенный связанный ГДФ на ГТФ, но и переводить Gs-белок в активированное состояние, при этом активный G-белок диссоциирует в присутствииионовMg2+на β-, γ-субъединицы и комплекс α-субъединицы Gsв ГТФ-форме; этотактивный комплексзатем перемещается кмолекулеаденилатциклазыи активирует ее. Сам комплекс затем подвергается самоинактивации за счет энергии распада ГТФ и реассоциации β- и γ-субъединиц с образованием первоначальной ГДФ-формы Gs.
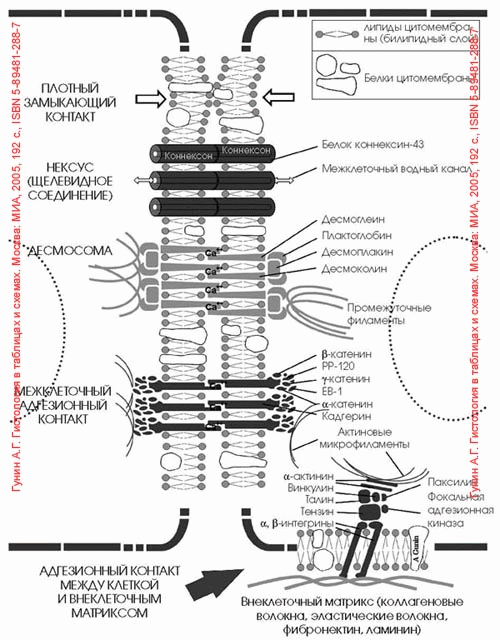
Вопрос №22 межклеточные контакты. Адгезивне соединения.
Межклеточные точечные сцепляющие соединения обнаружены у многих неэпителиальных тканей, но более отчетливо описана структура специальных (адгезивных) лентв однослойных эпителиях. Это структура опоясывает весь периметр эпителиальной клетки, подобно тому как это происходит в случае плотного соединения. Чаще всего такой поясок или лента лежит ниже плотного соединения. В этом месте плазматические мембраны не сближены, а даже несколько раздвинуты на расстояние 25-30 нм, и между ними видна зона повышенной плотности. Это ничто иное как места взаимодействия трансмембранных гликопротеидов, которые специфически сцепляются друг с другом и обеспечивают механическое соединение мембран двух соседних клеток. Эти линкерные белки относятся к Е-кадгеринам - белкам, обеспечивающим специфическое узнавание клетками однородных мембран. Разрушение этого слоя гликопротеидов приводит к обособлению отдельных клеток и разрушению эпителиального пласта. С цитоплазматической стороны около мембраны видно скопление какого-то плотного вещества, к которому примыкает слой тонких (6-7 нм) филаментов, лежащих вдоль плазматической мембраны в виде пучка, идущего по всему периметру клетки. Тонкие филаменты относятся к актиновым фибриллам, они связываются с плазматической мембраной посредством белка катенина, образующего плотный около мембранный слой.
Функциональное значение такого ленточного соединения заключается на только в механическом сцеплении клеток друг с другом: при сокращении актиновых филаментов в ленте может изменяться форма клетки. Считается, что кооперативное сокращение актиновых фибрилл во всех клетках эпителиального пласта может вызвать изменение его геометрии, например, сворачивание в трубку, подобно тому, что происходит при образовании нервной трубки у эмбрионов позвоночных.
Шпора 10.
Вопрос №23.межклеточные соединения. Проводящие (химические)контакты
Нексусы (щелевидные контакты):
Контакт образуется на небольшом по площади участке.
В месте контакта в цитомембрану встроены трансмембранные белки коннексины, которые соединяются между собой и образуют водный канал в толще мембраны — конексон.
Коннексоны контактирующих клеток соединяются (или сопоставляются), в результате чего между соседними клетками образуется канал, с помощью которого из одной клетки в другую (в обоих направлениях) свободно проходит вода, малые молекулы и ионы, а также электрический ток.
Синапсы — см. раздел по нервной ткани. Обеспечивают передачу потенциала действия (нервного импульса) с нервной клетки на другую нервную или иную клетку.
Шпора 10
