
МЕТОДИЧЕСКОЕ ПОСОБИЕ- Орг. химия-Часть 2
.pdf
CH2 |
|
|
CH2 |
|
|
C |
O |
300 |
0 |
C |
|
|
CH2 |
|
|
CH2 |
|||
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
OH Ca2+ |
|
|
|||||||||||||
|
|
|
|
CaCO |
+ |
|
|
|
C |
|
O |
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
OH |
|
|
|
3 |
|
|
|
|
|
|
|
CH2 |
|
|
CH2 |
|
|
C |
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
O |
|
|
|
|
CH2 |
|
CH2 |
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
циклопентанон
Щавелевая кислота весьма распространена в природе: кислая калиевая соль её НООС – СООК находится в щавеле, кислице, щавеле- во-кислый или оксалат кальция – во многих растениях.
В технике щавелевую кислоту получают окислением древесных опилок кислородом воздуха при нагревании их с расплавом КОН или при быстром нагревании до температуры 400 °С калиевой или натриевой соли муравьиной кислоты.
|
|
|
O |
H2SO4 |
|
||||
2 H |
|
C |
|
|
NaOOC |
|
COONa |
HOOC COOH |
|
|
|
|
|
|
|||||
|
|
|
ONa |
|
|
||||
Щавелевая кислота легко окисляется до СО2 и Н2О и при быстром нагревании разлагается
|
|
|
|
|
|
|
O |
|
|
|
|
CO2 |
+ H |
|
C |
|
|
|
|
|
|||
HOOC COOH |
|
|
|
|
|
|
OH |
|
|
|
CO2 + CO + H2O |
||||
|
|
|
|
||||
|
|
|
|
||||
Она является очень сильной кислотой. Константа диссоциации её примерно в 2000 раз выше, чем у уксусной кислоты.
Щавелевая кислота используется в ситцепечатании, кожевенной и пищевой промышленности и во многих других отраслях народного хозяйства.
Малоновая кислота
Вследствие влияния двух карбоксилов водороды метиленовой группы малоновой кислоты активируются и легко замещаются.
H
 O O
O O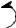
HO  C
C  C
C C
C  OH
OH
H
В лабораториях очень широко практикуется синтез одно- и двухосновных кислот через эфиры малоновой кислоты.
21

|
COOC2H5 |
|
|
|
|
COOC2H5 |
|
|
|
|
|
R− Br |
||
|
|
|
|
|
|
|
|
|
|
|||||
H2C |
|
Na(в спирте) |
HC |
|
|
|
Na |
+ |
||||||
|
|
|
|
|
|
COOC2H5 |
|
|
− Na Br |
|||||
COOC2H5 |
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
||||||||
|
натрий малоновый эфир |
|
|
|||||||||||
малоновый эфир |
|
|
||||||||||||
COOC2H5 R C H
COOC2H5
|
|
COOH |
|
|||
R |
|
C H |
+ 2C2H5OH |
|||
|
||||||
|
|
|
|
|
|
|
|
|
|
COO |
H |
|
|
 R CH2 COOH + CO2
R CH2 COOH + CO2
алкилуксусная
кислота
Янтарная кислота используется для получения некоторых пластмасс и в качестве пластификатора.
Адипиновая кислота используется в производстве полиамидных смол и волокна найлон.
5.1.4 Двухосновные ненасыщенные кислоты
Наиболее простыми представителями этого ряда кислот являются
фумаровая и малеиновая кислоты. Они имеют одинаковую струк-
турную формулу и являются геометрическими изомерами:
HOOC |
C |
|
C |
H |
HOOC |
|
|
|
COOH |
H |
|
COOH |
H |
C |
|
C |
H |
||
|
|
||||||||
|
|||||||||
|
|
||||||||
|
|||||||||
|
транс− |
|
|
|
цис− |
|
|||
|
фумаровая |
|
малеиновая |
||||||
Обе кислоты получают из яблочной кислоты. Осторожное нагревание даёт фумаровую, сильное – малеиновую кислоту
|
|
|
|
COOH |
|
|
|
|
|
COOH |
|
|||
H |
|
|
|
|
H |
|
H |
|
|
|
|
|
||
|
|
C |
|
|
|
C |
+ H2O |
|||||||
|
|
|
|
|||||||||||
|
|
|
|
|
|
OH |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
H |
|
|
|
C |
|
H |
|
|
|
C |
||||
|
|
|
|
|||||||||||
COOH COOH
Одинаковость структурной формулы обеих кислот подтверждается тем, что при гидрировании они дают одну кислоту – янтарную
22
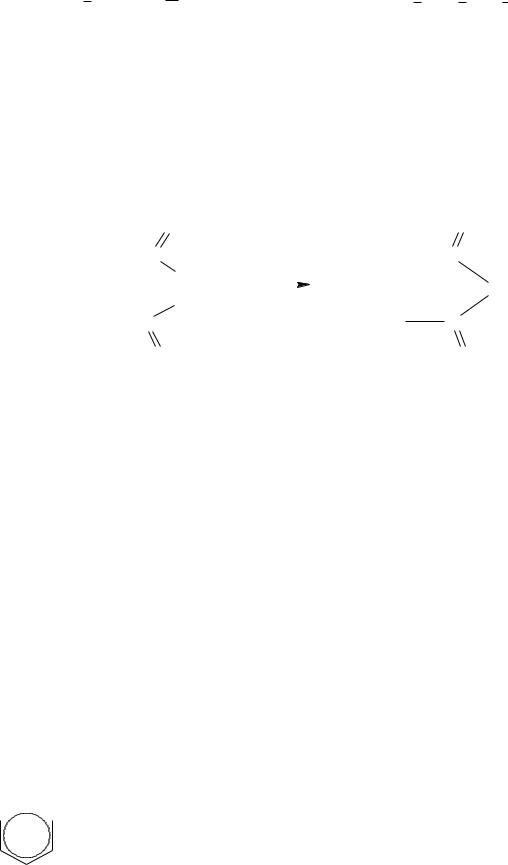
HOOC CH CH COOH + H2
CH COOH + H2  HOOC CH2 CH2 COOH
HOOC CH2 CH2 COOH
Различия в пространственном строении малеиновой и фумаровой кислот сильно отражается на их свойствах.
Фумаровая кислота плохо растворима в воде, возгоняется без плавления при температуре 200 °С. Малеиновая кислота очень легко растворима в воде и плавится при 130 °С, она является более сильной кислотой, чем фумаровая.
При нагревании малеиновая кислота легко отщепляет воду с образованием малеинового ангидрида
|
|
|
|
|
O |
|
|
|
|
|
|
O |
HC |
|
|
C |
|
|
HC |
|
C |
||||
|
|
|
|
|
||||||||
|
|
|
|
|
OH |
|
H2O + |
|
|
|
|
O |
|
|
|
|
|
OH |
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
HC |
|
|
|
C |
|
|
HC |
|
|
|
C |
|
|
|
|
||||||||||
|
|
|
|
|
O |
|
|
|
|
|
|
O |
Малеиновый ангидрид получается в технике при неполном окислении многих органических соединений (бензол, бутилены, циклогексан и др.). Он является хорошим диенофилом и применяется для обнаружения сопряженных диенов. Используется также в производстве стеклопластиков и для получения сополимеров со стиролом, акриловыми и метакриловыми эфирами. Такое применение его обусловлено наличием в молекуле активированной двойной связи С = С.
Фумаровая кислота своего ангидрида не образует и лишь при температуре 300 °С отщепляет воду с образованием… малеинового ангидрида.
С энергетической точки зрения фумаровая кислота стабильней малеиновой кислоты на 29,2 кДж∙моль-1.
5.2 Ароматические карбоновые кислоты
Взависимости от числа карбоксильных групп, – СООН, связанных
сароматическим ядром, ароматические карбоновые кислоты могут быть одно-, двух- и многоосновными. Они обычно носят тривиальные названия. Например:
 СOOH
СOOH
бензойная кислота
23
CH3 |
CH3 |
|
CH3 |
СOOH |
|
|
о-, м- и п-толуиловые |
|
|
СOOH |
|
|
|
кислоты |
|
|
|
|
|
|
|
|
СOOH |
СOOH |
|
|
|
СOOH |
|
|
о-фталевая |
|
|
|
|
СOOH |
|
|
м-фталевая или |
|
|
|
|
СOOH |
|
|
изофталевая |
|
|
|
|
СOOH |
|
|
|
|
|
|
п-фталевая или |
|
|
|
терефталевая |
СOOH |
|
|
|
СOOH |
|
|
1,2,3-бензолтрикарбо- |
СOOH |
|
|
|
|
|
новая кислота или |
|
СOOH |
|
|
гемимеллитовая |
Способы получения
Ароматические карбоновые кислоты могут быть получены обычными методами получения карбоновых кислот, например, гидролизом геминальных тригалогенпроизводных с галогенами в боковой цепи, гидролизом ароматических нитрилов, через магнийорганические соединения и т.д.. Однако преимущественно их получают способами, основанными на окислении.
– Окисление ароматических углеводородов. При энергичном окислении боковые цепи гомологов бензола «отгорают» и образуют соответствующие ароматические кислоты. Окислителями служат хромовая кислота и щелочной раствор перманганата калия.
24
CH3 |
COOH |
C2H5 |
COOH |
[ O ] |
; |
|
[ O ] |
|
|
|
|
CH3 |
COOH |
|
|
[ O ] |
терефталевая |
||
|
|
кислота |
|
CH3 |
COOH |
|
|
– Окисление ароматических кетонов гипохлоритом натрия |
|||
C6H5 C CH3 + 4NaOCl |
C6H5 |
C O |
+ 4NaCl + H2O + CO2 |
O |
|
OH |
|
|
|
|
|
Физические свойства
Ароматические кислоты – кристаллические вещества, плохо растворимые в воде и хорошо – в полярных органических растворителях.
Химические свойства
– Константы диссоциации ароматических кислот несколько выше, чем у кислот жирного ряда (.бензойная кислота – 6,6·10-5,.уксусная кислота – 1,76·10-5). Это связано с большей электрофильностью бензольного кольца (смещение электронной плотности к сильно ненасыщенной группировке).
 O
O
 C
C
H
O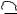 H
H
– Для карбоксильной группы в ароматических кислотах характерны те же реакции, что и в алифатическом ряду: это реакции
образования солей со щелочами, образования ангидридов и галогенангидридов, реакции этерификации, ацилирования и т.д.
Например, при нагревании смеси ароматической кислоты и спирта в присутствии серной кислоты образуется сложный эфир.
25

C H COOH + C H OH |
|
C6H5 |
|
C O |
+ H2O |
|||
|
|
|||||||
|
||||||||
6 |
5 |
2 |
5 |
|
|
|
OC2H5 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
бензойноэтиловый эфир, |
|||
|
|
|
|
|
этилбензоат |
|
||
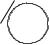
Если заместителей в орто-положении нет, то этерификация идёт также легко, как и в случае алифатических кислот. Однако, если одно из орто-положений замещено, скорость реакции резко падает, если же замещены оба орто-положения – реакция вовсе не идет.
C2H5
 COOH
COOH
C2H5
Этот факт указывает на пространственные затруднения: орто- заместители настолько сильно экранируют углерод кислотной группы, что затрудняют или делают невозможной атаку внешнего реагента на него.
В реакциях замещения в ароматическом ядре карбоксильная группа выступает как ориентант второго рода (электроноакцепторная группа) и направляет электрофильную атаку в мета-положение, затрудняя реакцию.
Бензойная кислота
Бензойная кислота содержится в некоторых природных смолах. Получают её почти исключительно окислением толуола. Она применяется в производстве красителей и лекарственных веществ. Большое промышленное значение имеет хлористый бензоил – хлорангидрид бензойной кислоты,
C6H5 C O Cl
O Cl
Получают его неполным гидролизом бензотрихлорида, который готовят хлорированием толуола на свету.
C6H5CH3 |
Cl2 |
C6H5CСl3 |
H2O |
C6H5 |
|
O |
|
C |
|||||
свет |
|
|
||||
|
|
|
|
|
|
Cl |
Хлористый бензоил находит применение как ацилирующее средство.
Из ароматических кислот с карбоксилом в боковой цепи
наиболее известна фенилуксусная кислота, которую получают через её нитрил.
26
C H CH Cl |
KCN |
C6H5CH2C |
|
N |
H2O |
C6H5CH2 |
|
COOH |
|
|
|
||||||
|
|
|
||||||
|
|
H+ |
||||||
|
|
|||||||
6 5 3 |
|
|
|
|
|
|
|
Используют в парфюмерии и медицине.
Дикарбоновые ароматические кислоты
Они представлены тремя изомерами
|
COOH |
COOH |
COOH |
|
|
COOH |
COOH |
|
|
|
COOH |
фталевая |
изофталевая |
терефталевая |
Используются, в основном, фталевая и терефталевая кислоты. Фталевая кислота получается окислением о-ксилола (о-диметилбензола) или нафталина. При нагревании она даёт фталевый ангидрид.
COOH |
C |
O |
|
O |
+ H O |
||
COOH |
C |
|
2 |
O
Фталевая кислота используется, главным образом, в виде фталевого ангидрида. Он идёт на получение эфиров фталевой кислоты. Диметилфталат является хорошим репелленом (отпугивает комаров, гнус). Конденсацией фталевого ангидрида и глицерина получают глифталевые смолы, применяющиеся в качестве прочных покровных материалов, плёнок, лаков. Фталевый ангидрид идёт на производство красителей.
Терефталевую кислоту получают окислением п-ксилола. Она применяется для получения полиэтилентерефталата, из которого формуют синтетическое полиэфирное волокно лавсан. Этерификация кислоты этиленгликолем протекает как реакция поликонденсации с образованием полимера и выделением воды:
НО |
|
|
ОН |
+ n НО CH2 CH2 ОН |
|
|||
n C |
2 |
3 |
C |
|
||||
|
HCHC |
|
|
|
|
|
|
|
O |
|
|
O |
|
|
|
|
|
... |
|
C |
C |
O CH |
CH |
O |
... + n H |
O |
|
|
|
|
2 |
|
2 |
2 |
|
|
|
O |
O |
|
|
|
n |
|
|
|
|
|
|
|
|
|
|
27

6 ЖИРЫ
Компоненты смеси органических веществ, экстрагируемых из тканей животных или растений неполярными растворителями (диэтиловый эфир, хлороформ, бензол, алканы), называют липидами. К липидам относят следующие совершенно различные по строению вещества: карбоновые кислоты, триглицериды или жиры, фосфолипиды и гликолипиды, воски, терпены, стероиды. Это соединения нерастворимые в воде и хорошо растворимые в органических растворителях.
Основная часть эфирной вытяжки – это собственно жиры или
глицериды: сложные эфиры трёхатомного спирта глицерина и высших жирных кислот.
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
O |
||||||
|
CH2 |
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
C |
|
|
|
R1 |
|
C |
|
R -ацил |
|||||||
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
||
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH |
|
|
|
|
|
C |
|
|
R2 |
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
||
CH2 O C R3
Жиры являются необходимой и весьма ценной составной частью пищи. Они обладают высокой калорийностью и в значительной степени снабжают организм энергией. При окислении 1г жира выделяется ~40 кДж энергии (1г углеводов ~17 кДж; 1г белка ~23 кДж). Жиры в организме вследствие их энергетической ценности служат резервным питательным веществом. После приема в пищу жиров долго сохраняется ощущение сытости. Суточный рацион человека 60… 70 г жиров. В природных жирах в качестве примесей содержатся и другие полезные вещества, в том числе витамины А, D, Е. Жиры служат также теплоизоляционным материалом, затрудняющим охлаждение организма.
В кишечнике под влиянием фермента липазы жиры гидролизуются до глицерина и органических кислот. Продукты гидролиза всасываются стенками кишечника и синтезируются новые жиры. (В организмах животных и растений входящие в состав жиров высшие предельные жирные кислоты синтезируются из уксусной кислоты, глицерин − из глюкозы). Кислоты с несколькими двойными связями (линолевая, линоленовая) синтезируются только растениями и поэтому являются незаменимыми компонентами пищи. В организмах животных они необходимы как исходные материалы в синтезе простагландинов, недостаток которых вызывает замедление роста, поражение кожи, нарушение функции почек, органов размножения.
28
Жиры широко используются в технических целях для изготовления мыл, олифы, линолеума, клеенки, смазочных материалов, а также в медицине и парфюмерии.
Физические свойства
Жиры легче воды и нерастворимы в ней. Хорошо растворимы в органических растворителях, например, в бензине, диэтиловом эфире, хлороформе, ацетоне и т.д. Температура кипения жиров не может быть определена, поскольку при нагревании до 250 °С они разрушаются с образованием из глицерина при его дегидратации сильно
раздражающего слизистые оболочки глаз альдегида − акролеина (пропеналя).
Для жиров прослеживается довольно четкая связь химического строения и их консистенции. Жиры, в которых преобладают остатки насыщенных кислот – твёрдые (говяжий, бараний и свиной жиры). Если в жире преобладают остатки ненасыщенных кислот, он имеет жидкую консистенцию. Жидкие растительные жиры называется маслами (подсолнечное, льняное, оливковое и т.д. масла). Организмы морских животных и рыбы содержат жидкие животные жиры. В молекулы жиров мазеобразной (полутвёрдой) консистенции входят одновременно остатки насыщенных и ненасыщенных жирных кислот (молочный жир).
Изомерия и номенклатура
Как уже отмечалось, жиры – это сложные эфиры глицерина и высших жирных кислот. В жирах найдено до 200 различных жирных кислот с содержанием обычно четного числа атомов углерода
от 4 до 26. Наиболее часто встречаются кислоты с 16 и 18 атомами углерода в цепи. В состав молекул жиров могут входить остатки одинаковых и разных кислот (ацилы).
Природные триглицериды обычно содержат остатки двух или трех различных кислот. В зависимости от того одинаковые или разные остатки кислот (ацилы) входят в состав молекул жира они делятся на простые и смешанные.
29
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|||||||||||
|
CH2 |
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
C |
|
|
|
C17H35 |
|
CH2 |
|
|
|
|
|
C |
|
|
|
C17H33 |
|||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|||||||||||
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH |
|
|
|||||||||||||||||||||||||
|
CH |
|
|
|
|
|
|
|
C |
|
|
C17H35 |
|
|
|
|
|
C |
|
|
|
|
C17H31 |
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
CH |
|
|
|
O |
|
C |
|
C |
17 |
H |
35 |
|
CH2 |
|
|
O |
|
C |
|
C17H29 |
|||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||||
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
Простой жир |
|
|
Смешанный жир |
|||||||||||||||||||||||||||||||||||||
тристеарат глицерина |
1-олеат-2-линолеат- |
|||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3- линоленоат |
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
глицерина |
|||||||||||||||
Структурная изомерия характерна прежде всего для смешанных жиров. Так, для показанного выше смешанного триглицерида возможны три структурных изомера с различным расположением ацильных остатков при углеродах глицерина. Теоретически для жиров, в состав которых входят остатки ненасыщенных высших жирных кислот,
возможна геометрическая изомерия у двойных связей и изомерия, обусловленная различным положением двойных связей. Однако, хотя остатки ненасыщенных жирных кислот в природных жирах встречаются чаще, двойная связь в них обычно располагается между углеродами С9−С10, причем этиленовая группировка имеет цис-конфигурацию.
Названия жиров составляются также как названия сложных эфиров, которыми они собственно и являются. При необходимости проставляются номера атомов углерода глицерина, при которых находятся соответствующие остатки высших жирных кислот. Так, жиры, формулы которых приведены выше, имеют следующие названия: тристеарат глицерина и 1-олеат-2-линолеат-3-линоленоат глицерина.
Химические свойства
Химические свойства жиров определяются сложноэфирным
строением молекул триглицеридов и строением и свойствами углеводородных радикалов жирных кислот, остатки которых входят в состав жира.
Как сложные эфиры жиры вступают, например, в следующие реакции:
– Гидролиз в присутствии кислот (кислотный гидролиз)
30
