
- •СОДЕРЖАНИЕ
- •ПРЕДИСЛОВИЕ
- •I. МЕХАНИКА
- •ПРИНЯТЫЕ ОБОЗНАЧЕНИЯ
- •ТЕСТОВЫЕ ЗАДАНИЯ
- •II. ГАРМОНИЧЕСКИЕ КОЛЕБАНИЯ
- •ПРИНЯТЫЕ ОБОЗНАЧЕНИЯ
- •ТЕСТОВЫЕ ЗАДАНИЯ
- •III. МОЛЕКУЛЯРНАЯ ФИЗИКА И ТЕРМОДИНАМИКА
- •ПРИНЯТЫЕ ОБОЗНАЧЕНИЯ
- •ТЕСТОВЫЕ ЗАДАНИЯ
- •IV. ЭЛЕКТРОСТАТИКА
- •ПРИНЯТЫЕ ОБОЗНАЧЕНИЯ
- •ТЕСТОВЫЕ ЗАДАНИЯ
- •V. ПОСТОЯННЫЙ ТОК
- •ПРИНЯТЫЕ ОБОЗНАЧЕНИЯ
- •ТЕСТОВЫЕ ЗАДАНИЯ
- •VI. МАГНИТНОЕ ПОЛЕ
- •ТЕСТОВЫЕ ЗАДАНИЯ
- •ПРИНЯТЫЕ ОБОЗНАЧЕНИЯ
- •VII. ЭЛЕКТРОМАГНИТНАЯ ИНДУКЦИЯ
- •ПРИНЯТЫЕ ОБОЗНАЧЕНИЯ
- •ТЕСТОВЫЕ ЗАДАНИЯ
- •VIII. ГЕОМЕТРИЧЕСКАЯ ОПТИКА
- •ПРИНЯТЫЕ ОБОЗНАЧЕНИЯ
- •ТЕСТОВЫЕ ЗАДАНИЯ
- •IX. ВОЛНОВАЯ ОПТИКА
- •ПРИНЯТЫЕ ОБОЗНАЧЕНИЯ
- •ТЕСТОВЫЕ ЗАДАНИЯ
- •X. КВАНТОВАЯ ОПТИКА
- •ПРИНЯТЫЕ ОБОЗНАЧЕНИЯ
- •ТЕСТОВЫЕ ЗАДАНИЯ
- •XI. АТОМНАЯ ФИЗИКА
- •ПРИНЯТЫЕ ОБОЗНАЧЕНИЯ
- •ТЕСТОВЫЕ ЗАДАНИЯ
- •XII. КВАНТОВАЯ МЕХАНИКА
- •ТЕСТОВЫЕ ЗАДАНИЯ
- •ПРИНЯТЫЕ ОБОЗНАЧЕНИЯ
- •XIII. ЯДЕРНАЯ ФИЗИКА
- •ТЕСТОВЫЕ ЗАДАНИЯ
- •ПРИНЯТЫЕ ОБОЗНАЧЕНИЯ
- •СПИСОК ЛИТЕРАТУРЫ
- •ПРИЛОЖЕНИЕ
- •Задания закрытого типа с выбором ответа (тип "В")
- •Задания с кратким регламентируемым ответом, самостоятельно конструируемым испытуемым (тип "К")
- •Задания с кратким ответом на установление правильной последовательности
- •Задания с кратким ответом на установление однозначного соответствия
- •Задания на установление множественного соответствия
- •Греческий алфавит
XI. АТОМНАЯ ФИЗИКА
ПРИНЯТЫЕ ОБОЗНАЧЕНИЯ
а - |
|
толщина |
R - |
B - |
|
индукция магнитного по- |
r - |
с - |
|
ля |
S, P, D, |
|
скорость света |
||
|
|
|
F… - |
Е - |
|
энергия |
s, S- |
е - |
|
элементарный заряд |
v - |
g - |
|
фактор Ланде |
Z - |
ћ, h - |
постоянная Планка |
α - |
|
j, J - |
квантовое число полного |
∆ - |
|
|
|
момента импульса элек- |
|
K, L, |
трона/атома |
|
|
символьное обозначение |
θ - |
||
M…- |
оболочки/серии |
|
|
L - |
|
квантовое число орби- |
λ - |
l - |
|
тального момента атома |
|
|
квантовое число орби- |
µ - |
|
|
|
тального момента элек- |
|
Ml, |
|
трона |
|
|
орбитальный момент им- |
µБ - |
|
Mlz |
- |
пульса электрона и его |
|
Ms, |
|
проекция на ось z |
|
|
собственный момент им- |
µJ- |
|
Msz - |
пульса электрона и его |
|
|
Mjz, |
|
проекция на ось z |
|
|
полный момент импульса |
µS- |
|
Mjz |
- |
электрона и его проекция |
|
m - |
|
на ось z |
|
|
масса, магнитное кванто- |
σ - |
|
mе - |
вое число, целое число |
|
|
масса электрона |
τ - |
||
N - |
|
число частиц |
Ω - |
n - |
|
концентрация, главное |
ω - |
|
|
квантовое число, целое |
|
|
|
число |
|
постоянная Ридберга радиус
символы атомных термов
спин электрона (атома) скорость порядковый номер элемента в
периодической таблице Д.И. Менделеева α-частица приращение
угол
длина волны
магнитный момент
магнетон Бора
полный магнитный момент атома
спиновой магнитный момент
константа экранирования
время жизни телесный угол частота
104

ТЕСТОВЫЕ ЗАДАНИЯ
1. Атом имеет размер порядка
а) 10–6 см; |
б) 10–8 см; |
в) 10–10 см; г) 10–13 см; |
д) 10–15 см. |
2. Определению поставьте в соответствие математическое выражение.
Определение
а) энергия водородоподобного атома в стационарном состоянии
б) частота линии в спектре водородоподобного атома
в) формула Резерфорда
г) радиус стационарной боровской орбиты
а) ; |
б) ; |
в) |
||||
|
|
|
|
|
|
|
Математическое выражение
1) na |
Ze2 2 |
|
|
dΩ |
|||||||||||||||
|
|
|
|
|
|
|
|
|
|||||||||||
mαv2 |
sin4(θ/2) |
||||||||||||||||||
2) |
– |
meZ2e4 1 |
|
|
|
|
|||||||||||||
|
2ћ |
2 |
|
|
|
n |
2 |
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
3) |
|
ћ2 |
|
|
n2 |
|
|
|
|
|
|
|
|
|
|
||||
meZe |
2 |
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
4) |
meZ2e4 |
1 |
|
|
– |
1 |
|
||||||||||||
|
|
|
|
3 |
|
|
|
|
|
|
|
|
|
|
|
||||
|
2ћ |
|
|
|
2 |
|
|
2 |
|||||||||||
|
|
|
|
|
m |
|
|
|
n |
|
|||||||||
; |
|
|
|
|
|
|
г) . |
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3.Квантовым числам поставьте в соответствие значения, которые они принимают
|
|
|
Квантовое число |
|
|
|
|
Значение |
|
||||||||
а) главное квантовое число, n |
|
|
|
1) |
0, 1, 2, …, n – 1 |
||||||||||||
б) орбитальное квантовое число, l |
|
|
|
|
|
|
l – s |
|
|||||||||
в) магнитное квантовое число, ml |
|
|
|
2) l + s, …, |
|
||||||||||||
|
|
|
3) |
– ½, + ½ |
|
|
|
||||||||||
г) спиновое квантовое число, ms |
|
|
|
4) |
1, 2, 3, … |
|
|
|
|||||||||
д) квантовое число полного момента атома, mj |
5) |
– l, … 0, … l |
|
||||||||||||||
а) ; |
б) ; |
в) ; |
г) . |
|
д) . |
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4.Кратность вырождения энергетического уровня с квантовым числом n равна
а) 2n2; б) n2; в) n.
5. Максимальное число электронов в состоянии с n = 4 равно
а) 8; |
б) 18; |
в) 32; |
г) 50. |
6.Значение, которое может принимать проекция момента импульса электрона на выбранное направление при заданном значении l, определяется выражением
105

а) lћ; |
б) – lћ; |
в) (2l + 1)ћ. |
7.Угловым моментам электрона (орбитальному, спиновому и полному) и их проекциям на направление оси z поставьте в соответствие собственные значения
|
|
|
Угловой момент/проекция |
|
|
|
Значение |
||||||||||
а) орбитальный момент импульса |
|
|
|
1) |
ћ |
j(j + 1) |
|||||||||||
б) собственный момент импульса |
|
|
|
2) |
ћml |
||||||||||||
в) полный момент импульса |
|
|
|
3) ћ s(s + 1) |
|||||||||||||
г) проекция орбитального момента импульса |
4) |
ћmj |
|||||||||||||||
д) проекция собственного момента импульса |
5) |
ћ |
l(l + 1) |
||||||||||||||
е) проекция полного момента импульса |
6) ћms. |
||||||||||||||||
а) ; |
б) ; |
в) ; |
г) ; |
д) |
; |
e) . |
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
8.Спектральной серии водородоподобного атома поставьте в соответствие формулу.
|
|
Спектральная серия |
|
|
|
|
|
|
|
|
|
Формула |
||||||
|
а) Бальмера |
|
|
|
1) R |
1 |
– |
1 |
|
(n = 2, 3, 4, …) |
||||||||
|
|
|
2 |
2 |
||||||||||||||
|
|
|
|
|
|
|
|
|
1 |
n |
|
|
|
|
||||
|
б) Брекета |
|
|
|
|
|
|
2) R |
1 |
– |
1 |
|
(n = 3, 4, 5, …) |
|||||
|
|
|
|
|
|
2 |
2 |
|||||||||||
|
|
|
|
|
|
|
|
|
2 |
n |
|
|
|
|
||||
|
в) Лаймана |
|
|
|
3) R |
1 |
– |
1 |
|
(n = 4, 5, 6, …) |
||||||||
|
|
|
2 |
2 |
||||||||||||||
|
|
|
|
|
|
|
|
|
3 |
n |
|
|
|
|
||||
|
г) Пфунда |
|
|
|
|
|
|
4) R |
1 |
– |
1 |
|
(n = 5, 6, 7, …) |
|||||
|
|
|
|
|
|
2 |
2 |
|||||||||||
|
|
|
|
|
|
|
|
|
4 |
n |
|
|
|
|
||||
|
д) Пашена |
|
|
|
|
|
|
5) R |
1 |
– |
1 |
|
(n = 6, 7, 8, …) |
|||||
|
|
|
|
|
|
2 |
2 |
|||||||||||
|
|
|
|
|
|
|
|
|
5 |
n |
|
|
|
|
||||
а) ; |
б) ; |
в) ; |
|
г) |
. |
д) . |
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
9.Максимально возможная проекция момента импульса орбитального движения электрона, находящегося в атоме в d-состоянии, на направление внешнего магнитного поля равна
а) ћ; |
б) ћ 6 ; |
в) 2ћ. |
10.Чему равен момент импульса орбитального движения электрона, находящегося в атоме в р-состоянии?
а) 0; |
б) ћ; |
в) ћ 2 . |
106

11. Терм атома 2Р3/2. Чему равен максимальный момент атома?
|
3 |
|
5 |
в) |
ћ |
15 . |
а) ћ |
2; |
б) ћ |
2; |
2 |
12.Электрон в атоме водорода находится р-состоянии. Максимально возможное значение полного момента импульса электрона равно
а) |
ћ |
|
|
ћ |
|
|
ћ |
2 |
15 ; |
б) |
2 |
3 ; |
в) |
2. |
13.Атом натрия, имеющий в своем составе одиннадцать электронов, может находиться в различных электронных состояниях: 1s22s22p63s (I); 1s22s22p63p (II); 1s22s22p64s (III); 1s22s22p64p (IV); 1s22s22p63d (V); 1s22s22p65s (VI). Установите правильную последовательность состояний в порядке возрастания энергии.
а) I<II<III<IV<V<VI; |
б) I<II<III<V<IV<VI; |
в) I<II<III<V<VI<IV; |
г) I<II<III<IV<VI<V; |
д) I<II<III<VI<IV<V; |
e) I<II<III<VI<V<IV. |
14.Атомы лития, бериллия, бора и углерода находятся соответственно в состояниях 1s22s, 1s22s2p, 1s22s2p2, 1s22s22p2. Какие из перечисленных атомов находятся в возбужденном состоянии?
а) Li; |
б) Be; |
в) B; |
г) C; |
д) Li, C; |
е) Be, B. |
15.Какие из приведенных утверждений называются правилами Хунда?
1)низшей энергией обладает терм с наивысшей мультиплетностью, т.е. с высшим значением спина;
2)атомные орбитали располагаются в последовательности возрастания суммы квантовых чисел (n + l), причем в группе уровней с данным значением (n + l) первыми следуют уровни с меньшим значением квантового числа n;
3)из термов с одинаковой мультиплетностью низшей энергией обладает терм с высшим значением квантового числа L;
4)термы атомов или ионов с четным числом электронов имеют нечетные мультиплетности; термы атомов или ионов с нечетным числом электронов имеют четные мультиплетности;
5)при данном значении L и S низшей энергией обладает терм с минимальным J (=L – S), если подоболочка заполнена менее чем наполовину, и с максимальным J (=L + S), если подоболочка заполнена более чем наполовину.
а) 1, 2, 3; |
б) 2, 4; |
в) 3, 5; |
г) 1, 3, 5. |
107

16. Мультиплетностью называется величина
а) 2L + 1; |
б) 2J + 1; |
в) 2S + 1. |
17.Символ терма атома в состоянии с электронной конфигурацией 1s22p3d запишется в виде
а) 1P1; |
б) 3P2; |
в) 1D2; |
д) 3D3; |
е) 3F4. |
18.Какие из термов: 1S, 1P, 1D1, 3S, 3P, 3D не противоречат принципу Паули?
а) 1S; |
б) 1P; |
в) 1D; |
г) 3S; |
д) 3P; |
е) 3D. |
19.Какой из термов: 1S0, 3P0, 3P1, 3P2, 1D2 соответствует основному состоянию для конфигурации np2?
|
а) 1S0; |
б) 3P0; |
в) 3P1; |
г) 3P2; |
|
д) 1D2. |
20. |
Основному состоянию атома бора B соответствует терм |
|
||||
|
а) 2S1/2; |
б) 2P1/2; |
в) 2P3/2; |
г) 2D5/2; |
|
д) 4D7/2. |
21. |
Какой терм является основным для конфигурации np3? |
|
|
|||
|
а) 2S1/2; |
б) 4S3/2; |
|
в) 2P3/2; |
г) |
2D5/2. |
22.Сколько эквивалентных электронов находится в незаполненной подоболочке атома, основной терм которого 3F2?
а) 1; |
б) 2; |
в) 3; |
г) 4; |
д) 5. |
23.Определению физической величины поставьте в соответствие математическое выражение.
Определение а) момент импульса электрона
б) магнитный момент атома водорода
в) гиромагнитное отношение г) магнетон Бора д) ширина спектральной линии
а) ; |
б) ; |
в) ; |
||||||
|
|
|
|
|
|
|
|
|
108
Математическое выражение
e
1) 2mec
ћ
2) τ
evr
3) 2
4) mvr
eћ
5) 2me
г) ; |
д) . |
||||
|
|
|
|
|
|
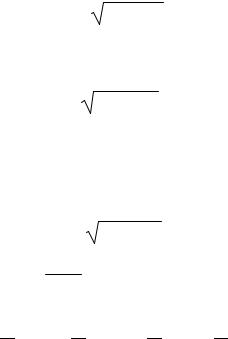
24.Физической величине поставьте в соответствие математическое выражение.
Физическая величина а) орбитальный магнитный момент
б) проекция орбитального магнитного момента атома на выбранное направление
в) спиновой магнитный момент
г) проекция спинового магнитного момента на выбранное направление
д) магнетон Бора е) полный магнитный момент
ж) проекция полного магнитного момента на выбранное направление
з) фактор Ланде
а) ; |
б) ; в) ; |
г) ; |
д) |
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
Математическое выражение
1)– µБ g J(J + 1)
2)– 2µБmS
3) – µБ L(L + 1)
4) 1+ |
S(S+1)+J(J+1)–L(L+1) |
|
2J(J+1) |
5)– µБgmJ
6)– µБmL
7)– 2µБ S(S + 1)
eћ
8) 2mec
; е) ; ж) ; з) .
25.Энергия взаимодействия магнитного момента атома с внешним магнитным полем определяется выражением
а) – µБgmJ; |
б) – µБgBmJ; |
в) – µJBB; |
г) – µB. |
26. Эффект Пашена-Бака проявляется а) в слабом внешнем магнитном поле;
б) в слабом внешнем электрическом поле; в) в сильном внешнем магнитном поле; г) в сильном внешнем электрическом поле.
27.Какие из приведенных ниже утверждений справедливы? Аномальный эффект Зеемана наблюдается а) в том случае, когда исходные линии не имеют тонкой структуры, т.е.
являются синглетными; б) в слабом внешнем магнитном поле при условии, что зеемановское
расщепление уровней меньше мультиплетного расщепления; в) в случае, когда реализуется рассель-саундерская связь между орби-
тальным и спиновым моментами импульса; г) в сильном внешнем магнитном поле, когда раз-рывается связь между
орбитальным и спиновым моментами импульса, и они ведут себя независимо друг от друга.
109

28. Резонансные частоты спектра ЭПР лежат
а) в области радиодиапазона; |
б) в ИКобласти; |
в) в видимой области; |
г) в УФобласти. |
29.Утверждение: «в любом квантовом состоянии может находиться не более одного электрона» получило название а) принципа неопределенности; б) принципа суперпозиции состояний; в) принципа Паули;
г) комбинационного принципа Ритца; д) принципа минимума энергии.
30.На рисунке представлена схема спектра энергетических уровней натрия. Какие из указанных переходов противоречат правилам отбора?
Энергия, эВ
а) I, II;
0
–1
–2
–3
–4
–5
2S1/2 2P3/2 2P1/2
7 |
7 |
7 |
|
6 |
6 |
||
6 |
|||
5 |
5 |
||
|
|||
5 |
|
V |
|
III |
4 |
4 |
4
II
IV
3 3
I
3
б) III, IV, VII; в) V;
110
|
2D5/2, 3/2 |
2F7/2, 5/2 |
7 |
|
7 |
6 |
|
6 |
5 |
VII |
5 |
4 |
|
4 |
VI
3
VIII
г) V, VI; д) V, VI, VIII.

31. Эффектом Зеемана называется а) расщепление энергетических уровней энергии и спектральных ли-
ний атома и других квантовых систем во внешнем магнитном поле;
б) расщепление энергетических уровней энергии и спектральных линий атома и других квантовых систем во внешнем электрическом поле;
в) резонансное поглощение электромагнитной энергии веществами, содержащими парамагнитные частицы;
г) избирательное поглощение электромагнитной энергии веществом, обусловленное ядерным парамагнетизмом;
д) резонансное поглощение ядрами γ- излучения.
32.Какие из приведенных ниже рисунков схематически отображают нормальный эффект Зеемана?
B = 0 |
|
B ≠ 0 |
mJ |
||
1P1 |
|
|
+1 |
||
|
|
0 |
|||
ω0 |
|
|
|
–1 |
|
σ |
π σ |
|
|
||
|
|
|
|||
1S0 |
|
|
|
0 |
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
ω0–∆ω ω0 ω0+∆ω a)
B = 0 |
B ≠ 0 |
2P3/2
2P1/2
2S1/2
ω0 ω0–∆ω ω0
в) 111
B = 0 |
|
|
B ≠ 0 |
|
mJ |
||
|
|
|
|
|
|
+2 |
|
1D2 |
|
|
|
|
|
+1 |
|
|
|
|
|
|
0 |
||
|
|
|
|
|
|
–1 |
|
ω0 |
σ |
π |
σ |
|
–2 |
||
|
|
+1 |
|||||
1P1 |
|
|
|
|
|
||
|
|
|
|
|
0 |
||
|
|
|
|
|
|
–1 |
|
|
|
|
|
|
|
||
|
|
|
|
|
|||
|
ω0–∆ω ω0 |
ω0+∆ω |
|||||
|
|
|
|
б) |
|
|
|
mL |
ms |
mL+2ms |
|||||
+1 |
+1/2 |
|
|
+2 |
|
|
|
0 |
+1/2 |
|
|
+1 |
|
|
|
+1; –1 |
–1/2; +1/2 |
0 |
|
|
|
||
0 |
–1/2 |
|
–1 |
|
|
|
|
–1 |
–1/2 |
|
–2 |
|
|
|
|
0 |
+1/2 |
+1 |
0 |
–1/2 |
–1 |
ω0+∆ω

B = 0 |
B ≠ 0 |
|
mJ |
|
g |
|||
|
|
|
|
+3/2 |
|
|
|
|
2P3/2 |
|
|
|
+1/2 |
4/3 |
|
||
|
|
|
|
|
–1/2 |
|
|
|
|
|
|
|
|
–3/2 |
|
|
|
2P1/2 |
|
|
|
+1/2 |
2/3 |
|
||
|
|
|
|
–1/2 |
|
|||
σ π σ σ π σ |
|
|
|
|||||
2S1/2 |
+1/2 |
|
|
|
||||
|
|
|
|
2 |
|
|||
|
|
|
|
|
–1/2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ω01 ω02
г)
33. На каком из рисунков схематически изображен рентгеновский характе-
ристический спектр излучения.
l j
M
L
K
Kα
2P3/2
2P1/2
2S1/2
Kβ
Lα |
Mα |
K-серии |
Kδ |
|
Возбуждение |
M-серия |
||
Kγ |
|
|
L-серия |
|
|
a)mJ
+3/2
+1/2
–1/2
–3/2
+1/2
–1/2
π σ |
π |
|
+1/2 |
|
–1/2 |
б) 112
серии- |
2 |
5/2 |
|
2 |
3/2 |
||
|
1 |
3/2 |
|
L |
1 |
1/2 |
|
0 |
1/2 |
||
Возбуждение |
|||
1 |
3/2 |
||
|
1 |
1/2 |
|
|
0 |
1/2 |
|
|
0 |
1/2 |
|
g |
|
|
|
4/3 |
|
||
2/3
2

13,53
13
12
11
|
10 |
|
|
|
|
|
9 |
|
, эВ |
8 |
|
7 |
||
Энергия |
||
6 |
||
|
5
4
3
2
1
0
n |
|
|
|
см–1 |
∞ |
|
|
|
0 |
5 |
|
|
|
|
4 |
|
|
|
|
3 |
БальмераСерия |
СерияПашена |
СерияБрекета |
Серия Пфунда |
ЛайманаСерия |
||||
2 |
|
|
|
|
50000
10000
1
в)
113
