- •Глава 1. Галоидпроизводные углеводородов
- •Номенклатура алкилгалогенидов, алкенилгалогенидов, алкинилгалогенидов и арилгалогенидов
- •1. Получение алкилгалогенидов
- •1.1. Галогенирование алканов
- •1.2. Присоединение галогеноводородов к алкенам
- •1.3. Замещение гидроксильной группы на галоген.
- •1.4. Свойства Галоидпроизводных углеводородов
- •1.4.1. Реакции нуклеофильного замещения
- •1.4.2. Механизм sn1
- •Дифенилметилгалогенид Трифенилметилгалогенид
- •1.4.3. Механизм sn2
- •1.4.4. Реакции отщепления
- •1.4.5. Реакции алкилгалогенидов с металлами
- •Глава 2. Спирты
- •Номенклатура одноатомных спиртов
- •2.4. Синтез спиртов из карбонильных соединений с помощью магнийорганических соединений
- •2.5. Гидролиз алкилгалогенидов
- •2.6. Свойства одноатомных спиртов
- •Температуры кипения некоторых спиртов и изомерных им простых эфиров
- •Кислотно-основные свойства спиртов
- •Кислотность спиртов
- •Из этих данных следует, что равновесие в системе спирт – щелочь всегда смещено в сторону спирта, а не алкоголята:
- •Замещение гидроксильной группы на галоген. Получение алкилгалогенидов
- •Получение алкилгалогенидов из спирта и галогеноводородных кислот
- •Получение алкилгалогенидов из спиртов и галогенидов фосфора
- •Дегидратация спиртов
- •2.10. Образование простых эфиров из спиртов
- •2.11. Получение простых эфиров по Вильямсону
- •2.12. Окисление спиртов
- •Восстановление спиртов
- •Взаимодействие с щелочными и щелчноземельными металлами.
- •2.15. Двухатомные спирты
- •2.16. Получение диолов
- •2.17. Свойства диолов
- •2.21. Расщепление простых эфиров кислотами
- •Глава 3. Тиолы и сульфиды
- •3.1 Получение тиолов
- •3.2 Свойства тиолов
- •Решения некоторых тестовых задач по теме спирты и тиолы
- •Только в реакциях 3) и 4) используются третичные спирты. Поскольку стабильность третичного карбениевого иона бензильного типа выше, чем стабильность третичного карбениевого иона алкильного типа:
- •5. Какого алкена образуется меньше при дегидратации 3-метилгексанола-3?
- •Глава 4. Альдегиды и кетоны
- •Альдегиды классификация
- •Строение карбонильной группы
- •4.1. Реакционные центры в молекулах альдегидов и кетонов
- •4.2. Химические свойства альдегидов и кетонов
- •4.3. Реакции альдегидов и кетонов по механизму нуклеофильного присоединения (an)
- •4.4. Реакции нуклеофильного присоединения по карбонильной группе с последующим отщеплением воды.
- •4.5. Окисление альдегидов и кетонов.
- •4.6. Реакция Канниццаро -Тищенко
- •4.7. Реакции полимеризации.
- •Получение альдегидов и кетонов
- •4.9. Медико-биологическое значение соединений с карбонильной группой
- •Отдельные представители альдегидов и кетонов
- •Эталонное решение задач
Температуры кипения некоторых спиртов и изомерных им простых эфиров
|
Спирт |
Формула |
Т кип., оС |
|
Метанол |
СН3ОН |
64,5 |
|
Этанол |
СН3СН2ОН |
78 |
|
Диметиловый эфир (метоксиметан) |
CH3OCH3 |
-24.9 |
|
Пропанол-1 |
СН3СН2СН2ОН |
97 |
|
Метилэтиловый эфир (метоксиэтан) |
СН3СН2ОCH3 |
7.9 |
|
Бутанол-1 |
CH3(CH2)3OH |
117 |
|
Диэтиловый эфир (этоксиэтан) |
СН3СН2ОCH2CH3 |
34.6 |
Кислотно-основные свойства спиртов
в водном растворе кислотность спиртов изменяется следующим образом:
H2O > СН3ОН > СН3СН2ОН > (СН3)2СНОН > (СН3)3СОН
Формально, такой последовательности изменения кислотности спиртов можно было бы ожидать на основании увеличения индукционного эффекта радикалов в этом ряду, что, в свою очередь, должно приводить к увеличению электронной плотности на атоме кислорода спирта. Вследстсвие этого долж-но наблюдаться уменьшение кислотности спиртов. Однако более вероятным представляется образование менее прочной водородной связи в этом направ-лении, вследствие увеличения пространственных препятствий по мере увеличения объёма углеводородного радикала в ряду:
CH3 < C2H5 < (CH3)2CH < (CH3)3C
Образование водородной связи всегда предшествует переносу протона в гидроксилсодержащих растворителях. В Таблице 2 приведены данные о кислотности простейших спиртов, которые подтверждают это положение.
Таблица 2
Кислотность спиртов
-
RОН
рKa.
(СН3)3СОН
18,0
(СН3)2СНОН
17,1
СН3СН2ОН
15,9
СН3ОН
15,5
НОН
15,7
Из этих данных следует, что равновесие в системе спирт – щелочь всегда смещено в сторону спирта, а не алкоголята:
![]()
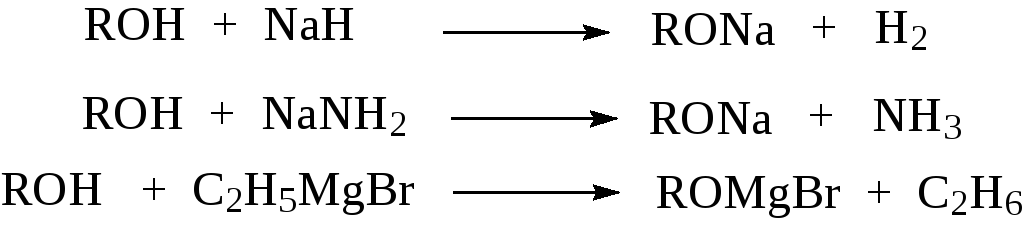
Для количественного превращения спирта в алкоголят требуется использова-ние гораздо более сильных оснований, таких как гидриды или амиды щелоч-ных или щелочноземельных металлов или реактивов Гриньяра.
По отношению к сильным минеральным кислотам спирты проявляют свойства оснований и образуют соли алкоксония:
![]()
основание кислота кислота' основание'
Эта реакция является первой стадией в реакциях спиртов, протекащих в кислой среде, т.е., при замещении гидроксильной группы на галоген, дегидратации спиртов и образовании простых эфиров.
Замещение гидроксильной группы на галоген. Получение алкилгалогенидов
Известно много способов замены гидроксильной группы спирта на галоген. Эти методы замещения гидроксила на галоген основаны на реакции спиртов с галогеноводородами, а также с галогенидами фосфора и оксогалогенидами фосфора и серы.
Получение алкилгалогенидов из спирта и галогеноводородных кислот
ROH + HHal → RHal + Н2O
Реакционная способность галогеноводородов уменьшается в ряду HI > HBr > HC1 >> HF. Скорость реакции замещения возрастает в ряду первич-ный > вторичный > третичный спирт. Для получения третичных алкилгало-генидов обычно достаточно обработать третичный спирт концентрирован-ным водным раствором соляной, бромистоводородной или йодистоводород-ной кислоты при комнатной температуре. Для получения первичных и вторичных алкилбромидов и алкилйодидов обычно требуется нагревание смеси спирта с концентрированной бромистоводородной или йодисто-водородной кислотой. Вместо концентрированных водных растворов НВr и HI можно использовать бромиды и йодиды натрия или калия и концентрированную серную или фосфорную кислоту. Выходы алкилгалогенидов по этому методу обычно составляют 75—90%. Отдельные примеры приведены ниже.
![]()
![]()
![]()
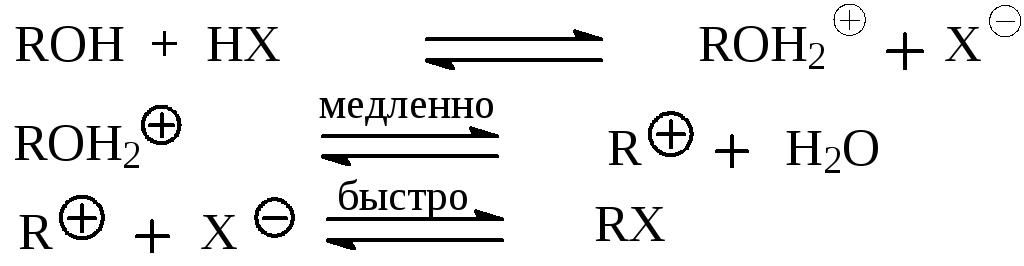
Первой стадией реакции является образование из спирта иона алкоксония
![]()
Следующей стадией для первичных спиртов и некоторых вторичных является SN2 реакция замещения воды в катионе алкоксония на галоген:
![]()
для получения алкилхлоридов при взаимодействии первичных спиртов с соляной кислотой используют электрофильный катализатор - безводный хлорид цинка. Смесь соляной кислоты и хлорида цинка носит название реактива Лукаса. В отсутствии катализатора реакция протекает с гораздо меньшей скоростью.
Третичные спирты и некоторые вторичные взаимодействуют с гало-геноводородом по механизму SNl с образованием в качестве интермедиата карбокатиона, который далее с анионом галогена образут конечный продукт.