
- •Глава 1. Галоидпроизводные углеводородов
- •Номенклатура алкилгалогенидов, алкенилгалогенидов, алкинилгалогенидов и арилгалогенидов
- •1. Получение алкилгалогенидов
- •1.1. Галогенирование алканов
- •1.2. Присоединение галогеноводородов к алкенам
- •1.3. Замещение гидроксильной группы на галоген.
- •1.4. Свойства Галоидпроизводных углеводородов
- •1.4.1. Реакции нуклеофильного замещения
- •1.4.2. Механизм sn1
- •Дифенилметилгалогенид Трифенилметилгалогенид
- •1.4.3. Механизм sn2
- •1.4.4. Реакции отщепления
- •1.4.5. Реакции алкилгалогенидов с металлами
- •Глава 2. Спирты
- •Номенклатура одноатомных спиртов
- •2.4. Синтез спиртов из карбонильных соединений с помощью магнийорганических соединений
- •2.5. Гидролиз алкилгалогенидов
- •2.6. Свойства одноатомных спиртов
- •Температуры кипения некоторых спиртов и изомерных им простых эфиров
- •Кислотно-основные свойства спиртов
- •Кислотность спиртов
- •Из этих данных следует, что равновесие в системе спирт – щелочь всегда смещено в сторону спирта, а не алкоголята:
- •Замещение гидроксильной группы на галоген. Получение алкилгалогенидов
- •Получение алкилгалогенидов из спирта и галогеноводородных кислот
- •Получение алкилгалогенидов из спиртов и галогенидов фосфора
- •Дегидратация спиртов
- •2.10. Образование простых эфиров из спиртов
- •2.11. Получение простых эфиров по Вильямсону
- •2.12. Окисление спиртов
- •Восстановление спиртов
- •Взаимодействие с щелочными и щелчноземельными металлами.
- •2.15. Двухатомные спирты
- •2.16. Получение диолов
- •2.17. Свойства диолов
- •2.21. Расщепление простых эфиров кислотами
- •Глава 3. Тиолы и сульфиды
- •3.1 Получение тиолов
- •3.2 Свойства тиолов
- •Решения некоторых тестовых задач по теме спирты и тиолы
- •Только в реакциях 3) и 4) используются третичные спирты. Поскольку стабильность третичного карбениевого иона бензильного типа выше, чем стабильность третичного карбениевого иона алкильного типа:
- •5. Какого алкена образуется меньше при дегидратации 3-метилгексанола-3?
- •Глава 4. Альдегиды и кетоны
- •Альдегиды классификация
- •Строение карбонильной группы
- •4.1. Реакционные центры в молекулах альдегидов и кетонов
- •4.2. Химические свойства альдегидов и кетонов
- •4.3. Реакции альдегидов и кетонов по механизму нуклеофильного присоединения (an)
- •4.4. Реакции нуклеофильного присоединения по карбонильной группе с последующим отщеплением воды.
- •4.5. Окисление альдегидов и кетонов.
- •4.6. Реакция Канниццаро -Тищенко
- •4.7. Реакции полимеризации.
- •Получение альдегидов и кетонов
- •4.9. Медико-биологическое значение соединений с карбонильной группой
- •Отдельные представители альдегидов и кетонов
- •Эталонное решение задач
Глава 4. Альдегиды и кетоны
Производные углеводородов, содержащие карбонильную группу
,![]()

 относятся к классу альдегидов или
кетонов
относятся к классу альдегидов или
кетонов
Альдегиды классификация
|
Предельные альдегиды | ||
|
Формула |
Тривиальная номенклатура |
Между-народная номенклатура |
|
|
Муравьиный альдегид (формальдегид) |
Метаналь |
|
|
Уксусный альдегид (ацетальдегид) |
Этаналь |
|
|
Пропионовый альдегид |
Пропаналь |
|
|
Масляный альдегид |
Бутаналь |
|
|
Валерьяновый альдегид |
Пентаналь |
|
|
Капроновый альдегид |
Гексаналь |
|
Непредельные альдегиды | ||
|
|
Акриловый альдегид |
Пропеналь |
|
|
Кротоновый альдегид |
Бутен-2-аль |
|
Алициклические альдегиды | ||
|
|
|
Циклопентан- карбальдегид |
|
|
|
Циклогексан- карбальдегид |
|
Ароматические альдегиды | ||
|
|
Бензальдегид |
Бензальдегид |
|
Со смешанным радикалом (алифатическо-ароматические) | ||
|
|
Коричный альдегид |
3-фенил-пропеналь |
Кетоны
|
Предельные | |||
|
Формула |
тривиальная номенклатура |
радикально-функциональная номенклатура |
Между-народная номенклатура |
|
|
Ацетон |
Диметилкетон |
Пропанон |
|
Непредельные | |||
|
|
|
Метилвинилкетон |
Бутенон |
|
Алициклические | |||
|
|
|
|
Цикло-пентанон |
|
Ароматические | |||
|
|
|
Дифенилкетон |
|
|
Смешанный: алифатическо-ароматический | |||
|
|
Ацетофенон |
Метилфенил-кетон |
Фенилэтанон |
Строение карбонильной группы
|
Альдегиды |
Кетоны |
|
|
|
Как в альдегидах, так и в кетонах sp2-гибридизованный атом углерода связан двойной связью с атомом кислорода. Три сигма (σ)-связи, соединяющие атом углерода с углеводородным радикалом, атомами водорода и атомом кислорода в молекуле альдегида и с двумя углеводородными радикалами и атомом кислорода в молекуле кетона, находятся в одной плоскости. Углы между связями состав-ляют примерно 1200. π-связь имеет две доли: одна располагается выше, а другая ниже этой плоскости. На рис. представлено образо-вание π-связи между атомами углерода и кислорода.
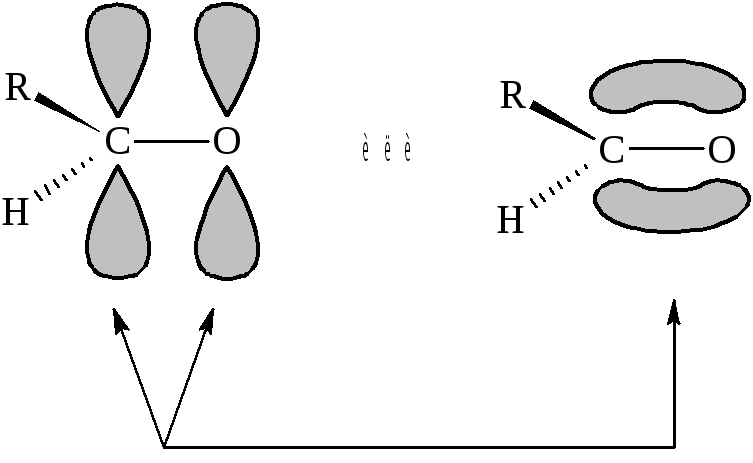
p-орбитали при боковом перекрывании образуют π-связь
4.1. Реакционные центры в молекулах альдегидов и кетонов
1. Электроотрицательность атома кислорода значительно больше электроотрицательности атома углерода, поэтому связи в карбо-нильной группе сильно поляризованы, особенно «рыхлая» π-связь. Атом кислорода несет частичный отрицательный заряд, а атом угле-рода частичный положительный заряд: вследствии такой поляриза-ции карбонильный атом углерода (Сδ+) может подвергаться нуклео-фильной атаке.
Нуклеофильный реагент (нуклефил Nu) это анион или нейтральная молекула, которая может предоставить электронную пару для образования связи.
2. Карбонильный атом углерода альдегидов легче подвергается нуклеофильной атаке, чем у кетонов, т.к. связан только с одним электронодонорным радикалом, понижающим δ+ на углероде и менее пространственно затруднен.
|
|
|
3. Карбонильная группа является электроноакцептором (–I-эффект) и наиболее сильно влияет на смещение электронной плотности связи С–Н при атоме углерода в α-положении:

Таким образом, можно отметить следующие реакционные центры:
|
а) кислотные центры: 3 4 б) основные центры: 1 и по Льюису; 2 |
|
Примечание. Подробно данный вопрос изложен в учебно-методическом пособии: Левина И.Ю., Берлянд А.С., Теоретические основы биоорганической химии, раздел «Кислотность и основность органических соединений», с. 29.
Непосредственная
атака положительно заряженного атома
угле-рода возможна только сильными
нуклеофилами (OH–,
R–![]() ,
H–).
Для проведения реакций со слабыми
нуклеофилами (R–OH,
R–SH)
используют кислотный катализ.
,
H–).
Для проведения реакций со слабыми
нуклеофилами (R–OH,
R–SH)
используют кислотный катализ.




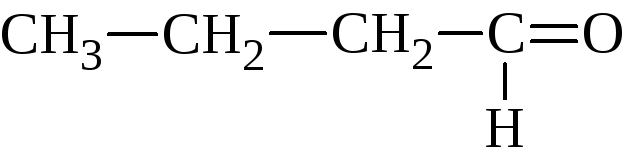


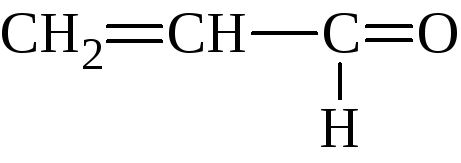




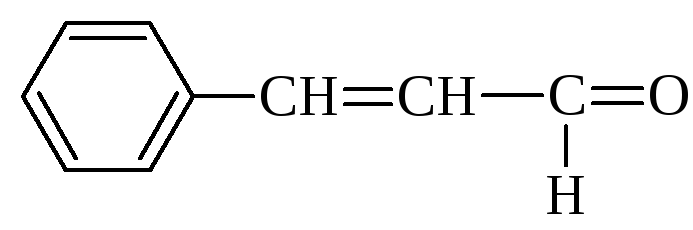











 – кислотный
центр по Льюису;
– кислотный
центр по Льюису; – кислотный
центр по Бренстеду;
– кислотный
центр по Бренстеду; – основный
центр по Бренстеду
– основный
центр по Бренстеду  – π-основный
центр по Льюису.
– π-основный
центр по Льюису.