- •Глава 1. Галоидпроизводные углеводородов
- •Номенклатура алкилгалогенидов, алкенилгалогенидов, алкинилгалогенидов и арилгалогенидов
- •1. Получение алкилгалогенидов
- •1.1. Галогенирование алканов
- •1.2. Присоединение галогеноводородов к алкенам
- •1.3. Замещение гидроксильной группы на галоген.
- •1.4. Свойства Галоидпроизводных углеводородов
- •1.4.1. Реакции нуклеофильного замещения
- •1.4.2. Механизм sn1
- •Дифенилметилгалогенид Трифенилметилгалогенид
- •1.4.3. Механизм sn2
- •1.4.4. Реакции отщепления
- •1.4.5. Реакции алкилгалогенидов с металлами
- •Глава 2. Спирты
- •Номенклатура одноатомных спиртов
- •2.4. Синтез спиртов из карбонильных соединений с помощью магнийорганических соединений
- •2.5. Гидролиз алкилгалогенидов
- •2.6. Свойства одноатомных спиртов
- •Температуры кипения некоторых спиртов и изомерных им простых эфиров
- •Кислотно-основные свойства спиртов
- •Кислотность спиртов
- •Из этих данных следует, что равновесие в системе спирт – щелочь всегда смещено в сторону спирта, а не алкоголята:
- •Замещение гидроксильной группы на галоген. Получение алкилгалогенидов
- •Получение алкилгалогенидов из спирта и галогеноводородных кислот
- •Получение алкилгалогенидов из спиртов и галогенидов фосфора
- •Дегидратация спиртов
- •2.10. Образование простых эфиров из спиртов
- •2.11. Получение простых эфиров по Вильямсону
- •2.12. Окисление спиртов
- •Восстановление спиртов
- •Взаимодействие с щелочными и щелчноземельными металлами.
- •2.15. Двухатомные спирты
- •2.16. Получение диолов
- •2.17. Свойства диолов
- •2.21. Расщепление простых эфиров кислотами
- •Глава 3. Тиолы и сульфиды
- •3.1 Получение тиолов
- •3.2 Свойства тиолов
- •Решения некоторых тестовых задач по теме спирты и тиолы
- •Только в реакциях 3) и 4) используются третичные спирты. Поскольку стабильность третичного карбениевого иона бензильного типа выше, чем стабильность третичного карбениевого иона алкильного типа:
- •5. Какого алкена образуется меньше при дегидратации 3-метилгексанола-3?
- •Глава 4. Альдегиды и кетоны
- •Альдегиды классификация
- •Строение карбонильной группы
- •4.1. Реакционные центры в молекулах альдегидов и кетонов
- •4.2. Химические свойства альдегидов и кетонов
- •4.3. Реакции альдегидов и кетонов по механизму нуклеофильного присоединения (an)
- •4.4. Реакции нуклеофильного присоединения по карбонильной группе с последующим отщеплением воды.
- •4.5. Окисление альдегидов и кетонов.
- •4.6. Реакция Канниццаро -Тищенко
- •4.7. Реакции полимеризации.
- •Получение альдегидов и кетонов
- •4.9. Медико-биологическое значение соединений с карбонильной группой
- •Отдельные представители альдегидов и кетонов
- •Эталонное решение задач
2.11. Получение простых эфиров по Вильямсону
Наиболее простой метод получения несимметричных простых эфиров заключается во взаимодействии алкоголятов щелочных металлов с алкил-галогенидами. Этот метод получения простых эфиров обычно называют синтезом эфиров по Вильямсону
![]()
В отличие от межмолекулярной дегидратации спиртов реакция Вильямсона пригодна для синтеза как симметричных, так и несимметричных простых эфиров:
![]()
Получение простых эфиров по Вильямсону представляет собой обычную реакцию бимолекулярного нуклеофильного замещения у насыщенного атома углерода SN2. Если простой эфир должен содержать вторичную или третичную алкильную группу, ее следует вводить с помощью алкоголята, но не алкилгалогенида, поскольку в этом случае имеет место преимущественное или исключительное E2-элиминирование:
![]()
![]()
Наилучшие результаты достигаются в том случае, когда в качестве алкили-рующего агента используются первичные алкилгалогениды , а также аллил- и бензилгалогениды.
2.12. Окисление спиртов
Окисление первичных спиртов в альдегиды и вторичных спиртов в кетоны является одним из важнейших превращений функциональных групп:
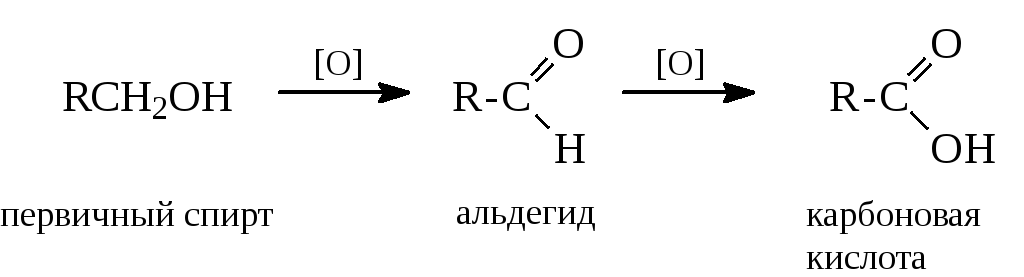

Третичные спирты в условиях окисления первичных и вторичных спиртов не окисляются, а в очень жестких условиях их окисление сопровож-дается деструкцией углеродного скелета.
Среди большого числа разнообразных окислителей наиболее широкое применение нашли реагенты на основе переходных металлов - производные хрома (VI), марганца (VII).
Наиболее сложную проблему при окислении первичных спиртов до альдегидов составляет дальнейшее окисление альдегидов до карбоновых кислот. Для предотвращения этой реакции в качестве окислителя используют комплексы хромового ангидрида с третичными аминами, которые уменьшают окислительную способность хромового ангидрида и делают окисление более селективным. Для селективного окисления первичных спиртов до альдегидов в настоящее время лучшим реагентом являются комплекс СrО3 с двумя молями пиридина: CrO3 • 2C5H5N . Этот реагент растворим в хлорис-том метилене и хлороформе и его использование для окисления спиртов позволяет получать альдегиды с высокими выходами.
![]()
Для окисления вторичных спиртов до кетонов в качестве окислителя используют раствор строго рассчитанного количества СrО3 в водной серной кислоте. Здесь не будет рассматриваться механизм приведённых выше реакций окисления. Как указывалось выше окисление третичных спиртов протекает в гораздо более жёстких условиях по сравнению с окислением первичных и вторичных спиртов. Вследствие этого третичные спирты могут
использоваться в качестве растворителей для окисления первичных и вторичных спиртов. Так раствор хромового ангидрида в трет-бутиловом спирте используется для окисления первичных и вторичных спиртов.
Среди относительно старых реагентов, использующихся в синтетичес-кой практике для окисления спиртов следует отметить перманганат калия. Этот реагент иногда используется для окисления первичных спиртов до карбоновых кислот, а вторичных спиртов - до кетонов.
![]()
В отдельных и очень редких случаях в качестве дешевого окислителя используют азотную кислоту. При этом и первичные и вторичные спирты окисляются до карбоновых кислот:

Вторичные спирты первоначально окисляются до кетонов, которые далее окисляются с деструкцией углеродного скелета. Классическим примером служит промышленное окисление циклогексанола 50%-ной азотной кислотой до адипиновой кислоты.

Для получения альдегидов и кетонов из первичных и вторичных спиртов в промышленности используется каталитическое дегидрирование. Этим методом в промышленных условиях получают формальдегид из метанола, масляный альдегид из н-бутилового спирта и циклогексанон из циклогекса-нола. В качестве катализатора дегидрирования используют медь, серебро, хромит меди: