
Posob_2012_Ok
.pdf+L); кристаллы безводной соли и раствор (LiNO3(S)+L); кристаллогидрат и раствор (LiNO3·3H2O (S)+L); раствор и пар (L+H2O(V)) имеют одну фазу переменного состава (L), являются моновариантными и отображаются на диаграмме состояния линиями: плавления льда - от температуры плавления воды до точки Е1; растворимости безводной соли - Е2М; растворимости кристаллогидрата - Е1Е2; кривая кипения - от температуры кипения воды до точки М. Равновесия кристаллов безводной соли и водяного пара (LiNO3(S) + H2O(V)), кристаллов воды и кристаллогидрата (LiNO3·3H2O(S) + H2O(S)), кристаллов безводной соли и кристаллогидрата (LiNO3·3H2O(S) + LiNO3(S)) не имеют фазы переменного состава, представлены нодами, проходящими между составами соответствующих фаз при заданных температурах.
На диаграмме имеется также только одна дивариантная однофазная область - область ненасыщенных растворов (L), отграниченная от других фазовых областей линиями плавления льда, растворимости криталлогидрата, безводной соли и кипения растворов. Если взять смесь, фигуративная точка которой находится в этой области ненасыщенных растворов, установить равновесие в системе, то исходная смесь будет представлять собой однофазную жидкую систему - ненасыщенный раствор, состав которого равен составу исходной смеси.
Если фигуративная точка исходной смеси окажется в одном из полей моновариантных равновесий (L + S; L + V), имеющих фазу переменного состава - насыщенный раствор, то равновесный состав раствора также может быть определен графически, для чего через фигуративную точку исходной смеси следует провести ноду от фазы постоянного состава до пересечения с соответствующей линией моновариантного равновесия. Соотношение фаз определяется по правилу рычага.
При помощи рис. 8.4 рассмотрим, как будет протекать изменение составов равновесных фаз при охлаждении различных реакционных смесей. Исходная смесь, состав и состояние которой отображается фигуративной точкой A (рис. 8.4), находится в поле совместного существования водяного пара и кристаллов нитрата лития. При охлаждении до температуры кипения предельно насыщенного раствора М (точка 1) начнется конденсация пара, растворение кристаллов нитрата лития и образуется предельно насыщенный при данном давлении раствор М. В это время в равновесии находятся три фазы: пар, раствор М и кристаллы нитрата лития.
Если отводить тепло от системы, то соотношение равновесных фаз изменяется - количества твердой и парообразной фаз уменьшаются, а количество жидкой фазы М возрастает. Поскольку в исходной смеси содержание нитрата лития меньше, чем в точке М, постольку кристаллический нитрат лития кончится быстрее, чем парообразная фаза. В этот момент в равновесии находятся уже две фазы, температура вновь начинает умень-
81
шаться.
При дальнейшем снижении температуры состав жидкой фазы изменяется по кривой кипения от точки М до точки 2, состав парообразной фазы остается неизменным, твердая фаза отсутствует. изменяется и соотношение парообразной и жидкой фаз - уменьшается количество первой и увеличивается количество второй. Когда состав раствора достигнет точки 2, исчезнет парообразная фаза.
На участке охлаждения от точки 2 до точки 3 происходит охлаждение ненасыщенного раствора, состав которого равен составу выбранного сечения. В точке 3 начнется выделение первых кристаллов льда. Равновесие в системе вновь становится моновариантным. Состав жидкой фазы при этом меняется по кривой плавления льда от точки 3 до точки Е1, состав твердой фазы отвечает воде. Количество жидкой фазы уменьшается, а твердой - возрастает.
Когда состояние исходной смеси будет соответствовать точке 4, равновесие в системе вновь станет нонвариантным из-за начавшейся кристаллизации трехводного нитрата лития. Составы жидкой и твердых фаз при этом остаются постоянными, состав жидкой фазы равен Е1. Соотношение твердых фаз меняется, суммарный состав выпавших кристаллов уходит из состава воды и приходит в состав точки 4, в этот момент исчезает последняя капля жидкой фазы. в системе остаются две твердые фазы: лед и трехводный нитрат лития, она становится моновариантной, вновь начинает уменьшаться температура.
На участке охлаждения от точки 4 до точки 5 происходит уменьшение температуры смеси кристаллов льда и трехводного нитрата лития, суммарный состав выпавших кристаллов остается равным составу выбранного сечения. Жидкая фаза отсутствует, а парциальное давление паров воды гораздо меньше атмосферного, и им можно пренебречь.
Политермическое сечение B проходит через эвтектику системы Е1. На начальном участке, от точки B до точки 7, протекающие в системе фазовые превращения тождественны описанным выше процессам, протекавшим при охлаждении смеси A от точки A до точки 2 (исключая конечный состав раствора в момент исчезновения парообразной фазы, который будет равен составу точки 7).
На участке охлаждения от точки 7 до точки Е1 реакционной смеси B система также станет конденсированной, будет происходить охлаждение ненасыщенного раствора, но в точке Е1 начнется кристаллизация сразу эвтектической смеси кристаллов льда и трехводного нитрата лития. Суммарный состав выпавших кристаллов сразу будет равен составу выбранного сечения. После исчезновения жидкой фазы на участке охлаждения от точки Е1 до точки 8 также будет происходить охлаждение смеси кристаллов льда и трехводного нитрата лития.
82
Всоставе исходной смеси C содержится больше нитрата лития, чем
вточке М. Поэтому при температуре нонвариантного процесса точки М исчезнет не твердая фаза, а парообразная. При дальнейшем охлаждении исходной смеси от точки 9 до точки 10 в равновесии будут находиться кристаллы нитрата лития и насыщенный раствор, состав которого при этом
будет меняться по кривой растворимости соли от точки М до точки Е2. Изменится и соотношение твердой и жидкой фаз. Количество твердой фазы будет возрастать.
Вточке 10 система становится нонвариантной. В равновесии находятся кристаллы трехводного нитрата лития, безводного нитрата лития и
жидкая фаза состава Е2. Суммарный состав твердой фазы меняется от состава нитрата лития до состава выбранного сечения.
На участке охлаждения от точки 10 до точки 11 происходит охлаждение смеси кристаллов трехводного и безводного нитрата лития. Жидкая и парообразная фазы отсутствуют. Суммарный состав твердой фазы равен составу выбранного сечения.
Исходная смесь, состав и состояние которой отображается фигуративной точкой D (рис. 8.4), находится в поле совместного существования водяного пара и кристаллов нитрата лития. При охлаждении до температуры кипения предельно насыщенного раствора М (точка 12) начнется конденсация пара, растворение кристаллов нитрата лития и образуется предельно насыщенный при данном давлении раствор М. В это время в равновесии находятся три фазы: пар, раствор М и кристаллы нитрата лития.
Если отводить тепло от системы, то соотношение равновесных фаз изменяется - количества твердой и парообразной фазы уменьшаются, а количество жидкой фазы М возрастает. При дальнейшем уменьшении температуры состав жидкой фазы изменяется по кривой кипения от точки М до точки 13, состав парообразной фазы остается неизменным, твердая фаза отсутствует.
На участке охлаждения от точки 13 до точки 14 происходит охлаждение ненасыщенного раствора, состав которого равен составу выбранного сечения. В точке 14 начнется выделение первых кристаллов трехводного нитрата лития. Равновесие в системе вновь становится моновариантным. Состав жидкой фазы при этом меняется по кривой растворимости трехвод-
ного нитрата лития от точки 14 до точки Е1, состав твердой фазы отвечает кристаллогидрату.
Когда состояние исходной смеси будет соответствовать точке 15, равновесие в системе вновь станет нонвариантным из-за начавшейся кристаллизации льда. Составы жидкой и твердых фаз при этом остаются по-
стоянными, состав жидкой фазы равен Е1. Соотношение твердых фаз меняется, суммарный состав выпавших кристаллов уходит из состава кристаллогидрата и приходит в состав точки 15, в этот момент исчезает последняя
83
капля жидкой фазы. в системе остаются две твердые фазы: лед и трехводный нитрат лития, она становится моновариантной, вновь начинает уменьшаться температура.
На участке охлаждения от точки 15 до точки 16 понижается температура смеси кристаллов льда и трехводного нитрата лития, суммарный состав выпавших кристаллов остается равным составу выбранного сечения. Жидкая фаза отсутствует.
Политермическое сечение F проходит через состав кристаллогидрата. На начальном участке, от точки F до точки 17, протекающие в системе фазовые превращения тождественны описанным выше процессам, протекавшим при охлаждении смеси A от точки A до точки 2 (исключая конечный состав раствора в момент исчезновения парообразной фазы, который будет равен составу точки 18).
На участке охлаждения от точки 18 до точки 19 (температура плавления кристаллогидрата в своей кристаллизационной воде) реакционной смеси F система также становится конденсированной, происходит охлаждение ненасыщенного раствора, но в точке 19 начнется кристаллизация трехводного нитрата лития. Суммарный состав выпавших кристаллов сразу будет равен составу кристаллогидрата. После исчезновения жидкой фазы на участке охлаждения от точки 19 до точки LiNO3·3H2O будет происходить охлаждение кристаллов трехводного нитрата лития.
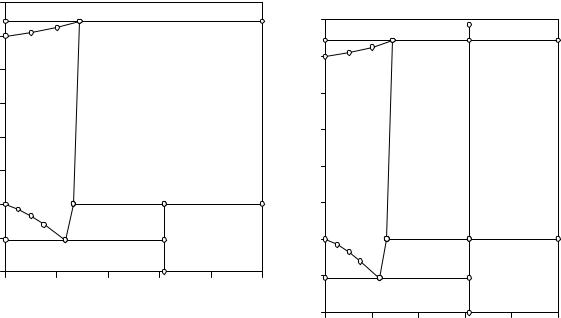
На рис. 8.5 приведена диаграмма состояния двойной водно-солевой системы NaCl - H2O с образованием инконгруэнтно растворимого кристаллогидрата состава NaCl·2H2O, а на рис. 8.6 - наиболее интересный политермический разрез данной системы. В случае образования в двойной вод- но-солевой системе инконгруэнтно растворимого кристаллогидрата имеется три следующих нонвариантных равновесия: парообразная фаза, кристаллы безводной соли и предельно насыщенный раствор (М); кристаллы льда, кристаллогидрата и эвтектический раствор Е; кристаллы безводной соли, кристаллогидрата и перитектический раствор Р. Эти равновесия отображаются на рис. 8.5 предельными нодами, проходящими через точки М, Еи Р, параллельными оси состава.
Двухфазные равновесия системы: кристаллы льда и раствор (H2O(S) +L); кристаллы безводной соли и раствор (NaCl(S)+L); кристаллогидрат и раствор (NaCl·2H2O(S)+L); раствор и пар (L+H2O(V)) имеют одну фазу переменного состава (L), являются моновариантными и отображаются на диаграмме состояния линиями: плавления льда - от температуры плавления воды до точки Е; растворимости безводной соли - РМ; растворимости кристаллогидрата - ЕР; кривая кипения - от температуры кипения воды до точки М. Равновесия кристаллов безводной соли и водяного пара (NaCl(S) + H2O(V)), кристаллов воды и кристаллогидрата (NaCl·2H2O(S) + H2O(S)), кристаллов безводной соли и кристаллогидрата (NaCl·2H2O(S) + NaCl(S)) не
84
имеют фазы переменного состава, представлены нодами, проходящими |
|||||||||||||||
между составами соответствующих фаз при заданных температурах. |
|
||||||||||||||
120 |
t,°C |
|
M |
NaCl(S)+H2O(V) |
|
|
|
t,°C |
|
|
|
|
|
||
|
L+V |
|
|
|
120 |
|
|
3 |
|
|
|||||
|
|
|
|
|
|
|
|
|
|
M |
NaCl(S)+H2O(V) |
|
|||
100 |
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
L+V |
|
2 |
|
|||
|
|
|
|
|
|
|
|
|
100 |
|
|
|
|
||
80 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
60 |
|
|
|
|
L+NaCl(S) |
|
|
80 |
|
|
|
|
|
|
|
L |
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
40 |
|
|
|
|
|
|
|
|
60 |
L |
|
|
|
L+NaCl(S) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
20 |
|
|
|
|
|
|
|
|
40 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
0 |
|
P |
|
|
|
|
|
|
20 |
|
|
|
|
|
|
-20 |
L+лед |
E |
L+NaCl·2H2O(S) |
NaCl(S)+NaCl·2H2O(S) |
0 |
|
P |
|
1 |
|
|
||||
|
|
|
|
|
|
|
|
|
|
||||||
-40 |
Лед+NaCl·2H2O(S) |
NaCl·2H O |
|
-20 |
L+лед |
E |
L+NaCl·2H2O(S) |
NaCl(S)+NaCl·2H2O(S) |
|||||||
|
|
|
|
|
|
|
|
|
|||||||
|
0 |
20 |
|
40 |
100 |
|
|
|
|
||||||
|
|
60 |
2 |
80 |
|
Лед+NaCl·2H2O(S) |
|
|
|
||||||
|
H2O |
|
|
|
% мас. |
|
|
NaCl |
|
|
|
|
|||
|
|
|
|
|
|
-40 |
|
|
|
NaCl·2H O |
|
||||
|
M: LM+NaCl(S)+H2O(V) |
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
0 |
20 |
40 |
60 |
2 80 |
100 |
|||||
|
P: LP+NaCl(S)+NaCl·2H2O(S) |
|
|
|
|
H2O |
|
|
% мас. |
NaCl |
|||||
|
E: LE+NaCl·2H2O(S)+H2O(S) |
|
|
|
|
|
|
|
|
|
|
||||
Рис. 8.5. Изобара растворимости |
Рис. 8.6. политермическое сечение |
двойной системы NaCl - H2O при ат- |
системы NaCl - H2O при атмо- |
мосферном давлении |
сферном давлении |
На диаграмме имеется также только одна дивариантная однофазная область - область ненасыщенных растворов (L), отграниченная от других фазовых областей линиями плавления льда, растворимости кристаллогидрата, безводной соли и кипения растворов.
При помощи рис. 8.6 рассмотрим, как будет протекать процесс изобарического нагревания кристаллогидрата NaCl·2H2O. До температуры точки Р будет происходить нагревание твердой фазы. При достижении температуры перитектического равновесия (точка 1) начнется реакция инконгруэнтного (с разложением) растворения кристаллогидрата в собственной кристаллизационной воде: NaCl·2H2O(S) = NaCl(S) + P(L).
В это время в равновесии находятся три фазы, и оно является нонвариантным. При подводе тепла к системе исчезнут кристаллы двуводного хлорида натрия. Равновесие становится моновариантным, вновь начинает возрастать температура исходной смеси. Состав насыщенного раствора при этом меняется от точки Р до точки М. Состав твердой фазы остается постоянным и представляет собой безводный хлорид натрия.
При температуре точки 2 равновесие системы становится трехфазным и нонвариантым - предельно насыщенный раствор (М), безводные
85
кристаллы хлорида натрия и парообразная вода. При подводе тепла к системе исчезнет жидкая фаза. На участке изобарического нагревания от точки 2 до точки 3 в равновесии находятся кристаллы безводной соли и парообразная вода. Фаза переменного состава на этом участке отсутствует.
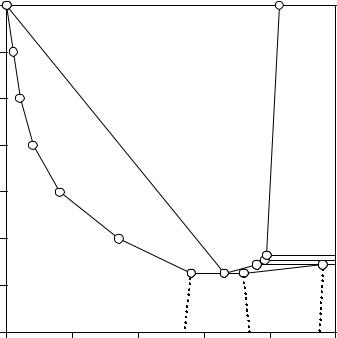
На рис. 8.7 изображена низкотемпературная часть изобары раство-
римости двойной водно-солевой системы NH4F - H2O. t,°C
0 |
|
|
|
|
|
|
-5 |
|
|
|
|
|
|
-10 |
|
|
|
|
|
|
-15 |
L+α |
|
L |
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
-20 |
|
|
|
|
|
|
-25 |
|
|
E |
L+NH4F |
|
|
|
α |
|
CBA |
|
|
|
-30 |
|
|
|
|
|
|
|
|
α+β |
β |
|
|
|
|
|
|
|
|
||
-35 |
|
|
|
|
|
Рис. 8.7. Изобара раство- |
0 |
10 |
20 |
30 |
40 |
50 |
римости системы NH4F - |
H2O |
|
|
% мас. |
|
NH4F |
H2O |
|
|
|
|
|
|
|
В этой системе обнаружено образование твердых растворов и ряда инконгруэнтно плавящихся кристаллогидратов. Нонвариантные равновесия, выявленные в системе, приведены в табл. 8.1.
Таблица 8.1.
Нонвариантные равновесия системы NH4F - H2O при атмосферном давлении
Точка |
Равновесие |
t, °C |
с, % мас. |
Е |
E(L)+α(S)+β(S) |
-28.7 |
33.0 |
C |
C(L)+β(S)+NH4F·H2O(S) |
-27.8 |
38.0 |
B |
B(L)+ NH4F·H2O(S)+ 4NH4F·H2O(S) |
-27.3 |
39.2 |
A |
A(L)+ 4NH4F·H2O(S)+ NH4F(S) |
-26.8 |
39.5 |
86
9. Двойные конденсированные системы с одной фазой переменного состава (двойные системы плавкости)
Применение правила фаз к двойным конденсированным системам (давление при исследовании систем поддерживается постоянным) позволяет сделать следующие выводы. Нонвариантыми равновесиями являются все возможные трехфазные равновесия (2-3+1=0). Наиболее распространенными трехфазными равновесиями являются: L+S1+S2 (жидкая фаза и две твердых фазы - так называемое эвтектическое равновесие); L1+L2+S (две жидкие фазы и твердая фаза). Моновариантными являются двухфазные равновесия (2-2+1=1). Дивариантыми (2-1+1=2) будут однофазные состояния систем.
9.1. Построение диаграммы состояния двойной конденсированной системы простого эвтектического типа по экспериментальным данным
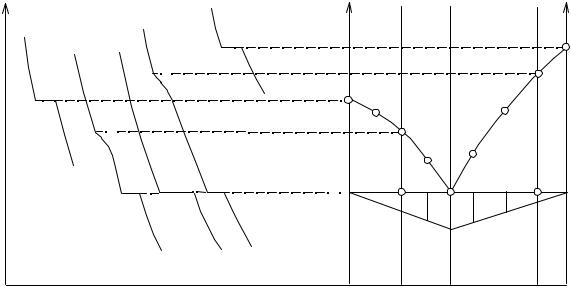
Изобарные диаграммы двойных систем строят чаще всего по кривым охлаждения или нагревания или по тем и другим вместе (см. рис. 9.1). Получают соответствующие кривые для чистых компонентов или их смесей, добавляя к чистому компоненту (например, В) возрастающее количество другого компонента (А). По мере увеличения концентрации компонента А температура начала кристаллизации компонента В в смеси В и А понижается. Эти понижения температур констатируются изломами на кривых охлаждения или нагревания и сопровождаются обогащением исходных расплавов компонентом А вплоть до эвтектического.
Такая же картина наблюдается при добавлении к чистому компоненту А различного количества компонента В. Получив кривые охлаждения (нагревания) для всех сплавов, строят диаграмму состояния изучаемой системы В-А. Для этого на диаграмму состав - температура наносят все отмеченные на кривых охлаждения (нагревания) изломы и соединяют их кривыми. Такая диаграмма представлена на рис. 9.1. Кристаллизация расплавов заканчивается в эвтектической точке, независимо от состава.
Полученная диаграмма состоит из двух ветвей - В'E и EA', которые начинаются в точках В' и A', отвечающих температурам плавления чистых компонентов В и А, и идут, опускаясь при удалении от этих точек. Очевидно, что эти кривые пересекаются в эвтектической точке Е.
При отводе тепла от жидкой эвтектики одновременно выделяются обе равновесные с ней твердые фазы, при подводе тепла к твердой эвтектике обе твердые фазы расплавляются. Такой процесс называется конгруэнтным.
На основании постоянства температуры кристаллизации и состава эвтектик систем, изучаемых при атмосферном давлении, первоначально делался вывод о том, что эвтектики представляют собой химические соединения компонентов. Однако от этой мысли пришлось отказаться, так
87
как при изменении давления состав и температура эвтектики изменяются. Кроме того, микроскопические исследования показывают, что в затвердевшем состоянии эвтектики представляют собой смесь двух твердых фаз.
Т |
V |
ТI |
II III |
IV VТ |
I |
IV |
|
|
A' |
III |
|
|
||
II |
|
|
||
|
3' |
B' |
|
3 |
|
|
L |
||
|
|
|
||
|
|
|
|
|
|
1' |
|
1 |
L+A(S) |
|
|
L+B(S) |
||
|
|
|
||
2' |
4' |
B'' |
2 |
4 |
A'' |
|
|
|
|
E |
|
|
|
|
|
E' A(S)+B(S) |
|
Время |
B |
A |
Рис. 9.1. Построение диаграммы плавкости по экспериментальным данным
Вернемся к рис. 9.1. Линия B'EA', которая называется кривой ликвидуса, в соответствии со сказанным выше состоит из двух частей: B'E - ветвь кристаллизации (плавления) компонента В и EA' - ветвь кристаллизации компонента А. Прямая B"A", изображающая температуры конца кристаллизации, называется линией солидуса (или просто солидусом), а также предельной (конечной) нодой или коннодой.
Область диаграммы, лежащая выше кривой ликвидуса, отвечает жидкому состоянию системы и называется полем жидкости или расплава
(L). Аналогично область, лежащая ниже линии солидуса, называется полем твердого состояния (В(S) + А(S)) и соответствует механической смеси компонентов В и А.
Область B'EB" (L + В(S)) - поле компонента В - соответствует смеси жидкости и твердого В, а область A'EA" (L + А(S)) - поле компонента А - соответствует смеси жидкости и твердого А. Линия B'E изображает составы расплавов, насыщенных компонентом В, а линия EA'- компонентом А.
На рис. 9.1. представлены кривые охлаждения, по которым построена эта диаграмма. Пунктирными линиями показано, как переносятся значения температур с кривых охлаждения на диаграмму состояния (и наоборот, имея диаграмму состояния, можно построить кривую охлаждения).
При помощи рис. 9.1 рассмотрим, как будет протекать изменение составов равновесных фаз при охлаждении различных реакционных сме-
88
сей. Исходная смесь I представляет собой чистый компонент В, находящийся в расплавленном состоянии. При охлаждении до температуры плавления (В') система является моновариантной (1-1+1=1), при отводе тепла происходит равномерное понижение температуры.
При температуре плавления компонента В начинается выделение кристаллов В. В это время в равновесии находятся две фазы: расплав и кристаллы В. Такое равновесие в однокомпонентной системе является нонвариантным - на кривой охлаждения наблюдается температурная задержка.
Если отводить тепло от системы, то соотношение равновесных фаз изменяется - количество твердой фазы возрастает, а количество жидкой фазы уменьшается. После исчезновения жидкой фазы система вновь становится моновариантной, температура вновь начинает уменьшаться. Происходит охлаждение кристаллов В.
Таким образом, на кривой охлаждения имеется три участка - два нисходящих, отображающих моновариантные равновесия системы, и один горизонтальный, соответствующий нонвариантному равновесию, этот участок кривой охлаждения называется температурной задержкой.
Политермическое сечение II проходит между составами В и Е, пересекает поле компонента В. На начальном участке до температуры начала кристаллизации компонента В система является дивариантной (2-1+1=2) и происходит охлаждение жидкой фазы.
При температуре точки 1 начинается кристаллизация компонента В, при этом вариантность системы уменьшается на единицу, а на кривой охлаждения наблюдается излом. На участке охлаждения от точки 1 до точки 2 происходит кристаллизация чистого компонента В, а состав жидкой фазы меняется по кривой В'Е от точки 1 до точки Е.
При температуре эвтектики (точка 2) начинается кристаллизация эвтектической смеси кристаллов В и А. В это время в равновесии находятся три фазы и состояние системы является нонвариантным, а на кривой охлаждения наблюдается температурная задержка. Это равновесие отображается прямой В"EA". Точки B", E, A" отображают составы равновесных фаз. При этом состав жидкой фазы остается постоянным, а суммарный состав твердой фазы меняется от чистого компонента В до состава данного сечения. Когда суммарный состав твердой фазы становится равным составу выбранного сечения, исчезает последняя капля эвтектического расплава. Система вновь становится моновариантной.
При температуре ниже точки 2 происходит охлаждение смеси кристаллов В и А. Жидкая фаза отсутствует, суммарный состав твердой фазы равен составу выбранного сечения и не меняется.
Сечение III проходит через эвтектику системы. При температурах выше эвтектической система представляет собой жидкую фазу. При температуре эвтектики начинается кристаллизация эвтектической смеси кри-
89
сталлов В и А, в это время равновесие в системе является нонвариантным. Состав жидкой фазы не меняется, образующийся суммарный состав твердой фазы сразу равен составу выбранного сечения. На кривой охлаждения нет изломов, имеется только горизонтальный участок температурной задержки.
Политермическое сечение IV пересекает поле А. При температурах выше точки 3 система представляет собой жидкость. При температуре, равной точке 3, начинает кристаллизоваться вещество А, вариантность системы уменьшается с двух до единицы, на кривой охлаждения наблюдается излом. На участке охлаждения от точки 3 до точки 4 происходит кристаллизация компонента А, состав жидкой фазы меняется по кривой А'E от точки 3 до точки Е. Суммарный состав твердой фазы остается постоянным и равным А.
При температуре точки 4 начинает кристаллизоваться эвтектическая смесь кристаллов А и В. В это время в равновесии находятся три фазы, и оно является нонвариантным. Состав жидкой фазы остается постоянным и равным Е. Суммарный состав твердой фазы меняется от чистого компонента А до состава выбранного сечения.
После исчезновения жидкой фазы система вновь становится моновариантной и уменьшается температура. При температурах, меньших точки 4, жидкая фаза отсутствует и происходит охлаждение смеси кристаллов А и В, суммарный состав которой равен составу выбранного сечения.
Исходная смесь сечения V представляет собой чистый компонент А. Кристаллизация в этом сечении протекает точно так же, как и в сечении I, за исключением того факта, что кристаллизация начинается при температуре плавления компонента А (точка А').
Возвращаясь вновь к кривым охлаждения двойных сплавов (кривые II - IV на рис. 9.1.), отмечаем на них наличие четко выраженных температурных остановок, длина которых соответствует времени кристаллизации жидких эвтектик у разных двойных смесей (сплавов). Эта длина тем больше, чем ближе состав смеси к эвтектическому. Откладывая перпендикулярно к эвтектической линии отрезки прямых, длины которых пропорциональны продолжительности эвтектических задержек на кривых охлаждения, и соединяя концы этих отрезков плавными линиями, получают кривосторонний треугольник В"E'A", называемый треугольником Таммана.
Построение этого треугольника позволяет уточнить состав эвтектики при исследовании системы и в некоторых случаях зафиксировать наличие в системах твердых растворов.
9.2 Диаграммы плавкости двойных систем с полиморфными превращениями одного из компонентов
На рис. 9.2 приведена диаграмма плавкости двойной системы KCl - K2CrO4. В этой системе β-K2CrO4 при 679°С и отводе тепла превращается в
90
