
Posob_2012_Ok
.pdf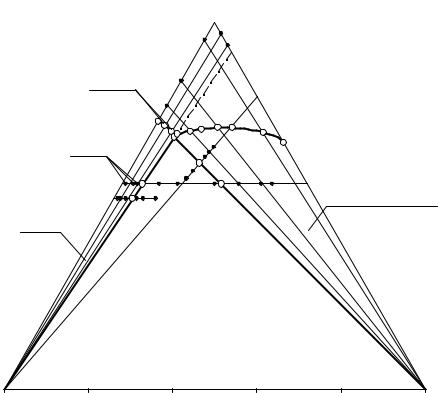
Определение репéрных точек на границах нонвариантной области рационально осуществлять сечениями типа «раствор одной соли + вторая соль» (прокол) и «две соли + вода» (изогидрическое сечение).
|
|
|
H O |
|
|
|
|
|
|
|
a |
2 b1 |
|
|
|
|
|
|
1 |
b2E |
B |
|
|
|
|
|
|
|
|
|
|
b1' b2' |
|
a2 |
|
|
|
B |
|
|
R1a3 |
|
|
|
|
||
|
a3' |
a2' |
|
a ' |
R |
||
1 2 3 |
|
E |
b |
|
|
1 |
|
|
|
|
|
2 |
|||
|
|
|
|
|
|
|
|
F |
f |
4 5 |
|
g |
7 |
8 9 |
G |
H |
h |
K |
|
6 |
|
|
2Na2SO4·Na2CO3 |
NaCl |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2Na2SO4·Na2CO3+NaCl
0 |
20 |
40 % мас. 60 |
80 |
100 |
NaCl |
|
|
2Na2SO4·Na2CO3 |
|
Рис. 13. 8. Планирование исследования изотермы растворимости оптимизированным методом сечений
Обращаем внимание, что применение сечений первого типа («прокол») возможно в случае, когда перспективная проекция из вершины NaCl предполагаемого состава эвтонического раствора на противолежащую сторону Na2CO3·2Na2SO4-Н2О находится в гомогенной области (ЕВ на рис. 13. 8) и невозможно, когда перспективная проекция из вершины Na2CO3·2Na2SO4 на сторону NaCl-Н2О лежит в гетерогенной части.
Для сечения типа прокол в середине гомогенной части интервала EB–R2 выбирают раствор В, прибавление к которому хлорида натрия позволяет наименее трудоемко и наиболее надежно определить состав репéрной точки b на предельной ноде Е-Na2CO3·2Na2SO4.
Для определения составов репéрных точек на границах нонвариантной области изогидрическое сечение наиболее универсально, но наиболее трудоемко. Используя содержание воды в составе предполагаемого двойного эвтонического раствора, вычисляем ее содержание в изогидрическом сечении FG (56% мас. Н2О, ~20% донной фазы).
Сечение FG пересекает три фазовые области, позволяет определить обе границы нонвариантной области f и g, которые находятся на предель-
151
ных нодах системы – прямых линях проходящих из вершин треугольника состава NaCl и Na2CO3·2Na2SO4 в эвтонику системы. На рисунке 3.4 функция свойства от состава по сечению FG выразится кривыми линиями 1–3 и 7–9. Смеси 4–6 сечения FG имеют нонвариантное фазовое равновесие:
Е(L)+NaCl(S)+Na2CO3·2Na2SO4(S), поэтому свойство жидких фаз для составов 4÷6 одинаково, что выражается горизонтальной линией 4–6 на функции
«состав – свойство».
Вычисляем основные коэффициенты отношений содержаний компонентов во всех репéрных точках на предельных нодах, которые должны быть одинаковыми при условии, что ноды исходят из вершин концентрационного треугольника: c1 = {Na2CO3·2Na2SO4}/{Н2О};
c2 = {NaCl}/{Н2О}, где {Na2CO3·2Na2SO4}, {NaCl}, {Н2О} – процентные концентрации беркеита, хлорида натрия и воды в репéрных точках на предельных нодах, исходящих из вершин исходных безводных солевых компонентов.
Используя значения этих коэффициентов (c1, c2, …), вычисляют ко-
личество воды {W} в нонвариантном растворе (% мас.): |
|
{W} = 100/(c1+c2+1). |
(13.8) |
Содержания солевых компонентов {Х} рассчитывают по общей |
|
формуле (%): {X} = cX·{W}. |
(13.9) |
Экспериментальные составы f (на ноде Е-NaCl) и g |
(на ноде Е– |
Na2CO3·2Na2SO4) изогидрического сечения FG, вычисленные по ним коэффициенты c1 и c2 и предварительный состав эвтонического раствора (Е56) приведены в табл. 13. 1.
|
|
|
|
Таблица 13. 1 |
|
Использование изогидрического сечения FG для предварительного |
|||||
определения состава двойного эвтонического раствора |
|||||
Репéрная |
Состав, % мас. (Истинные концентрации) |
Коэффициен- |
|||
|
Na2CO3·2Na2SO4 |
|
|||
точка |
NaCl |
Н2О |
ты |
||
(Brk) |
|||||
|
|
|
|
||
f |
39,15 |
4,85 |
56,00 |
c1 = 0,0866* |
|
g |
20,42 |
23,58 |
56,00 |
c2 = 0,3646** |
|
|
{NaCl}=25,13 |
{Brk}=5,97 |
{W}=68,91 |
|
|
Е56 |
25,13 |
5,97 |
68,91 |
|
|
* c1 = {Na2CO3·2Na2SO4}/{Н2О}; ** c2 = {NaCl}/{Н2О}
Для подтверждения гипотезы о том, что этот раствор является эвтоническим, насыщенным индивидуальными исходными солями, необходимо найти еще как минимум по одной точке состава на каждой предельной ноде.
С целью оптимизации выбора сечений по определению второй пары точек на предельных нодах находят перспективные проекции полученного
152
эвтонического раствора (Е56) на водно-солевые стороны треугольника состава изучаемой системы.
Для рационального изучения данного сечения вычисляют содержание хлорида натрия в точке b, которое составляет 22,52% мас. Это содержание вычисляют по уравнению прямой, заданной составами Е56; Na2CO3·2Na2SO4 и соотношением {Na2CO3·2Na2SO4}/{Н2О} в приготовленном растворе В (% мас.: 20,30 – Na2CO3·2Na2SO4; 79,70 – Н2О). Готовят не менее двух ИСК с бóльшим содержанием хлорида натрия с шагом 3–6% и три ИСК с меньшим содержанием этой соли и шагом в 1%. Последние ИСК должны находиться как можно ближе к предельной ноде, так как границу гомогенной области данным сечением определять нет смысла. Это связано с бóльшей ошибкой вычисления состава точки пересечения двух кривых функциональных линий, построенных по данным с неизбежной экспериментальной погрешностью.
Оптимальность сечения В-NaCl состоит в том, что приготовление всех ИСК осуществляется двумя взвешиваниями, полученные составы находятся строго на одной прямой линии. Кроме того, погрешность определения точки излома на функциональной зависимости в этом случае минимальна.
Положение второй точки (h) на конноде Е–NaCl находят изучением части изогидрического разреза НК (рис. 3.5; 56,00% мас. Н2О).
Вычисленные составы точек изломов функциональных зависимостей изученных сечений, которые также находятся на предельных нодах тройной системы, сведены в табл. 13. 2. Кроме того, в этой таблице приведены коэффициенты, полученные по составам этих точек, и вычисленный по соответствующим средним коэффициентам итоговый средний состав двойного эвтонического раствора Е (формулы 13.8, 13.9).
Таблица 13. 2 Использование экспериментальных данных на предельных нодах
для определения состава двойного эвтонического раствора
То- |
Состав, % мас. (Истинные концентрации) |
Основные коэффициенты |
|||
чка |
NaCl |
Brk |
H2O |
{Brk}/{H2O} |
{NaCl}/{H2O} |
f |
39,15 |
4,85 |
56,00 |
0,0866 |
0,6991 |
g |
20,42 |
23,58 |
56,00 |
0,4211 |
0,3646 |
h |
43,50 |
4,50 |
52,00 |
0,0865 |
0,8365 |
b |
22,75 |
15,56 |
61,69 |
0,2522 |
0,3688 |
|
|
|
|
c1 ср= 0,087 |
c2 ср= 0,367 |
|
{NaCl}=25,24 |
{Brk} = 5,98 |
{W}=68,78 |
|
|
E |
25,24 |
5,98 |
68,78 |
0,087 |
0,367 |
Обращаем внимание на то, что все составы точек на предельных нодах неизбежно содержат ошибки экспериментального определения. Поэтому вычисленные по ним основные коэффициенты (в табл. 13. 2 отмечены жирным шрифтом) отличаются тысячными долями единицы и для оп-
153
ределения содержания компонентов в двойном эвтоническом растворе использованы их средние значения. «Посторонние» коэффициенты, которые не используются для расчетов (приведены в соответствующих ячейках табл. 13. 2 обычным шрифтом), отличаются несколькими десятыми долями. Сопоставление величин всех коэффициентов позволяет оценить точность эксперимента.
13.2.4, 3). Нахождение составов равновесных твердых фаз, насыщающих нонвариантный раствор
Для выяснения состава твердых фаз равновесных двойному эвто-
ническому раствору, анализируем значения основных коэффициентов в табл. 13. 2. Их равенство доказывает, что предельные ноды исходят из вершин составов солевых компонентов, на которые рассчитаны составы репéрных точек и по которым вычислялись основные коэффициенты. Таким образом, эвтонический раствор в данной системе насыщен хлоридом натрия и беркеитом, а выдвинутая выше гипотеза экспериментально подтверждена. Установленные составы твердых фаз, насыщающих двойной эвтонический раствор, вносят в итоговую таблицу фазовых равновесий системы (табл. 13. 8).
Приведенная методика определения составов твердых фаз, насыщающих двойной эвтонический раствор, является простой, надежной и эффективной. Неравенство основных коэффициентов (несколько сотых долей единицы и более) свидетельствует о наличии в системе других твердых фаз (кристаллогидраты, химические соединения или твердые растворы), на которые не были рассчитаны составы репéрных точек.
Рассмотрим порядок действий по определению составов нонвариантного раствора и твердых фаз, насыщающих этот раствор, на примере системы NaI – KI – H2O при 25°C, в которой присутствует устойчивый кристаллогидрат (NaI·2H2O). Данные о составах точек на коннодах, определенные с помощью изогидрических или других оптимальных сечений (см. выше), в системе NaI – KI – H2O при 25°C изображены на рис. 13. 9 и приведены в табл. 13. 3.
Анализ величин основных коэффициентов (с1 и с2) показывает приблизительное равенство отношения содержаний иодида натрия к воде в т.т. b, d, что означает их принадлежность конноде, исходящей из вершины состава иодида калия, который является равновесной эвтоническому раствору твердой фазой. Отношения же содержаний иодида калия к воде в репéрных точках a и c отличаются более чем в две сотые единицы, т.е. не могут находиться на конноде, исходящей из вершины иодида натрия, а иодид натрия не является равновесной эвтоническому раствору твердой фазой.
Для определения состава второй равновесной эвтоническому раствору твердой фазы выдвигаем гипотезу о том, что ею является дигидрат
154
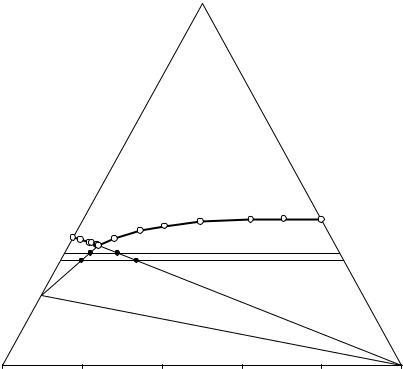
иодида натрия, который находится в равновесии с насыщенным раствором в двойной системе NaI – H2O при 25°С. Пересчитываем с учетом молярных масс составы т.т. a, b, c и d в координаты NaI·2H2O, KI и H2O, вычисляем новые основные коэффициенты и все сводим в табл. 13. 3.
H2O
R1 |
|
E |
|
R2 |
a |
|
B |
||
A |
b |
|
||
C |
c |
|
d |
D |
|
|
|
NaJ·2H2O
0 |
20 |
40 % мас. 60 |
80 |
100 |
NaJ |
|
|
|
KJ |
Рис. 13. 9. Определение состава равновесных твердых фаз, насыщающих эвтонический раствор, в системе NaI – KI – Н2О при 25°С
Анализ величин основных коэффициентов (с3 и с4) показывает приблизительное равенство отношений (0,0001) содержаний дигидрата иодида натрия к воде в т.т. b, d, и отношений (0,001) содержаний иодида калия к воде в т.т. a и c, что означает их принадлежность коннодам, исходящим из вершин составов иодида калия и дигидрата иодида натрия соответственно, а эти соли являются равновесными эвтоническому раствору твердыми фазами, что подтверждает выдвинутую гипотезу (см. табл. 13.3).
Вычисляем с использованием коэффициентов с3 и с4 составы двойного эвтонического раствора (E*) в истинных концентрациях по уравнениям (13.8) и (13.9) и пересчетом состава E* в Е** на безводные соли и воду (аналитический способ выражения концентраций). Для сравнения в табл. 13. 3 приведен справочный состав (Е***) двойного эвтонического раствора, который прекрасно согласуется с составом Е**, вычисленным по предлагаемой процедуре.
Рассмотрим применение универсальной процедуры определения составов равновесных нонвариантных фаз на примере системы MgCl2 –
155
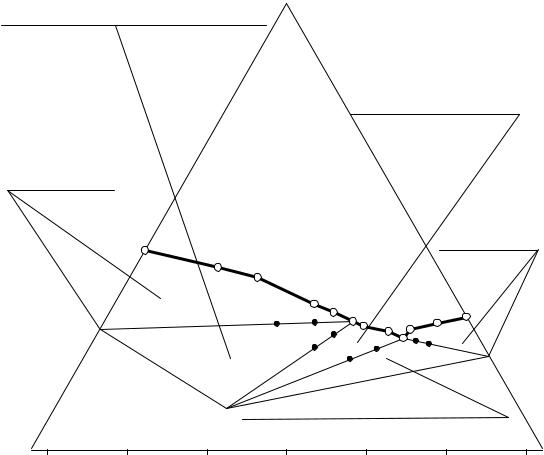
CaCl2 – H2O при 25°С, в которой образуется химическое соединение в виде кристаллогидрата (см. рис. 13. 10 и табл. 13. 4).Анализ величин коэффициентов (с1′ и с2′) показывает их значительное неравенство во всех репéрных точках, т.е. они не могут находиться на коннодах, исходящих из вершин безводных исходных компонентов. Вычисляем координаты точек пересечения прямых ab и gh со сторонами треугольника состава, а cd и ef друг с другом и определяем составы предполагаемых равновесных твердых фаз и химического соединения C (см. табл. 13. 4).
Для определения составов равновесных нонвариантным растворам твердых фаз триангулируем исходную систему на две: CaCl2·6H2O – 2MgCl2·CaCl2·12H2O(C) – H2O и 2MgCl2·CaCl2·12H2O(C) – MgCl2·6H2O – H2O. Пересчитываем с учетом молярных масс составы всех точек на границах нонвариантных областей (a, b, c, d, e, f, g, h) в соответствующие истинные концентрации, вычисляем основные коэффициенты и все данные сводим в табл. 13. 4 и 13. 5.
H2O 2MgCl2·CaCl2·12H2O+MgCl2·6H2O
2MgCl2·CaCl2·12H2O
MgCl2·6H2O |
L |
R1 |
1 |
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
x |
3 |
4 |
P |
|
7 |
|
|
|
b |
|
||||
|
|
a |
c |
|
5 6 E |
||
|
|
|
d |
f |
e |
g h |
|
|
|
|
|
|
|
||
CaCl2·6H2O
R2
2MgCl2·CaCl2·12H2O 2MgCl2·CaCl2·12H2O+CaCl2·6H2O
20 |
30 |
40 |
50 % мас.60 |
70 |
80 |
MgCl |
2 |
|
|
|
CaCl2 |
|
|
|
|
|
Рис. 13. 10. Водный угол системы MgCl2 – CaCl2 – H2O при 25°С и реперные точки на границах нонвариантных областей
156
Анализ величин основных коэффициентов табл. 13. 5 (с1 и с2) показывает приблизительное равенство отношений (0,002) содержаний гексагидрата хлорида магния к воде в т.т. с и d; отношений (0,002) содержаний химического соединения к воде в т.т. a и b, что означает их принадлежность коннодам, исходящим из вершин составов гексагидрата хлорида магния и додекагидрата хлорида кальция-димагния. По средним значениям коэффициентов с1 и с2 вычисляем составы нонвариантного перитонического раствора в истинных и аналитических концентрациях (т.т. P* и P** соответственно).
Следует обратить внимание, что все составы табл. 13. 5, выраженные в истинных концентрациях, находятся в области отрицательных значений данной диаграммы составов. Этот факт, с одной стороны, однозначно свидетельствует о перитоническом (инконгруэнтном) характере нонвариантного раствора и, с другой стороны, о необходимости использования отрицательных областей составов диаграмм состояния.
Таблица 13. 3 Использование составов репéрных точек для определения
нонвариантных равновесных фаз
Точка |
Состав, % мас. |
|
Основные коэффициенты |
|||
NaI |
KI |
|
H2O |
c1 = {KI}/{H2O} |
c2 = {NaI}/{H2O} |
|
|
|
|||||
|
|
|
|
Нода Е-NaI·2H2O |
|
|
a |
62,54 |
6,45 |
|
31,01 |
0,2080 |
2,0168 |
c |
65,74 |
5,31 |
|
28,95 |
0,1834 |
2,2708 |
|
|
|
|
Нода |
Е-KI |
|
b |
55,66 |
13,33 |
|
31,01 |
0,4299 |
1,7949 |
d |
51,97 |
19,07 |
|
28,96 |
0,6585 |
1,7945 |
|
|
|
|
|
|
c2 ср= 1,7947 |
Точка |
NaI·2H2O |
KI |
H2O |
c3 = {KI}/{H2O} |
c4 = {NaI·2H2O}/{H2O} |
|
a |
77,56 |
6,45 |
|
15,99 |
0,4034 |
4,8504 |
c |
81,53 |
5,31 |
|
13,16 |
0,4034 |
6,1943 |
b |
69,03 |
13,33 |
|
17,64 |
c3 ср= 0,4034 |
3,9125 |
|
0,7556 |
|||||
d |
64,45 |
19,07 |
|
16,48 |
1,1572 |
3,9111 |
E* |
73,60 |
7,59 |
|
18,81 |
0,4034 |
c4 ср= 3,9118 |
|
3,9118 |
|||||
Точка |
NaI |
KI |
H2O |
|
|
|
E** |
59,34 |
7,59 |
|
33,07 |
|
|
E*** |
59,35 |
7,59 |
|
33,06 |
|
|
*– состав в истинных координатах;
**– состав в аналитических координатах;
***– справочные данные в аналитических координатах
Анализ величин основных коэффициентов табл. 13. 6 (с3 и с4) показывает приблизительное равенство отношений (0,002) содержаний гекса-
157
гидрата хлорида кальция к воде в т.т. e и f; отношений (0,007) содержаний химического соединения к воде в т.т. g и h, что означает их принадлежность коннодам, исходящим из вершин составов гексагидрата хлорида кальция и додекагидрата хлорида кальция-димагния.
По средним значениям коэффициентов с3 и с4 вычисляем составы нонвариантного эвтонического раствора в истинных и аналитических концентрациях (Е* и Е** соответственно).
Нетрудно убедиться, что предложенная процедура может быть использована и для водно-солевых систем с образованием твердых растворов с разрывами сплошности.
13.2.4, 4). Исследование линий моновариантных равновесий
Рассмотрим применение метода сечений для изучения линий моновариантного равновесия в тройной водно-солевой системе NaCl–2Na2SO4·Na2CO3–Н2О при 50°С. Данная система является разрезом четверной системы Na+ // Cl−, CO32−, SO42− – H2O, в которой образуется химическое соединение 2Na2SO4·Na2CO3 – беркеит, конгруэнтно растворимое в воде при данной температуре.
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Таблица 13. 4 |
|
|
|
Экспериментальные данные на предельных нодах, |
|||||||||||
|
|
|
вычисленные и предполагаемые составы донных фаз |
|||||||||||
Точка |
|
|
Состав, % мас. |
|
|
|
c1′={MgCl2}/{H2O} |
c2′={CaCl2}/{H2O} |
||||||
MgCl2 |
|
CaCl2 |
|
|
H2O |
|
||||||||
a |
|
19,38 |
|
26,49 |
|
|
54,13 |
|
0,3580 |
|
0,4894 |
|||
b |
|
24,22 |
|
21,82 |
|
|
53,96 |
|
0,4489 |
|
0,4044 |
|||
c |
|
17,87 |
|
29,72 |
|
|
52,41 |
|
0,3410 |
|
0,5671 |
|||
d |
|
21,20 |
|
28,26 |
|
|
50,54 |
|
0,4195 |
|
0,5592 |
|||
e |
|
13,53 |
|
36,11 |
|
|
50,36 |
|
0,1558 |
|
0,7867 |
|||
f |
|
17,63 |
|
33,53 |
|
|
48,84 |
|
0,1292 |
|
0,8278 |
|||
g |
|
8,02 |
|
40,50 |
|
|
51,48 |
|
0,2687 |
|
0,7170 |
|||
h |
|
6,60 |
|
42,30 |
|
|
51,10 |
|
0,3610 |
|
0,6865 |
|||
Состав, % мас. или число моль |
|
Примечание |
|
Предполагаемый |
||||||||||
MgCl2 |
|
CaCl2 |
|
H2O |
|
|
|
состав донной фазы |
||||||
|
|
|
|
|
|
|
||||||||
46,83 |
|
0,00 |
|
|
53,17 |
|
|
Пересечение ab и |
|
MgCl2·6H2O |
||||
1,00 |
|
0,00 |
|
|
6,01 |
|
|
|
MgCl2-H2O |
|
||||
|
|
|
|
|
|
|
|
|||||||
37,04 |
|
21,31 |
|
|
41,65 |
|
Пересечение cd и ef |
2MgCl2·CaCl2·12H2O(C) |
||||||
2,03 |
|
1,00 |
|
|
12,06 |
|
||||||||
0,00 |
|
50,67 |
|
|
49,33 |
|
|
Пересечение gh и |
|
CaCl2·6H2O |
||||
0,00 |
|
1,00 |
|
|
6,01 |
|
|
|
CaCl2- H2O |
|
||||
|
|
|
|
|
|
|
|
|||||||
Изотерма растворимости в разрезе NaCl – 2Na2SO4·Na2CO3 – Н2О при 50°С и основные типы оптимальных сечений для исследования линий моновариантного равновесия приведены на рис. 13. 8.
158
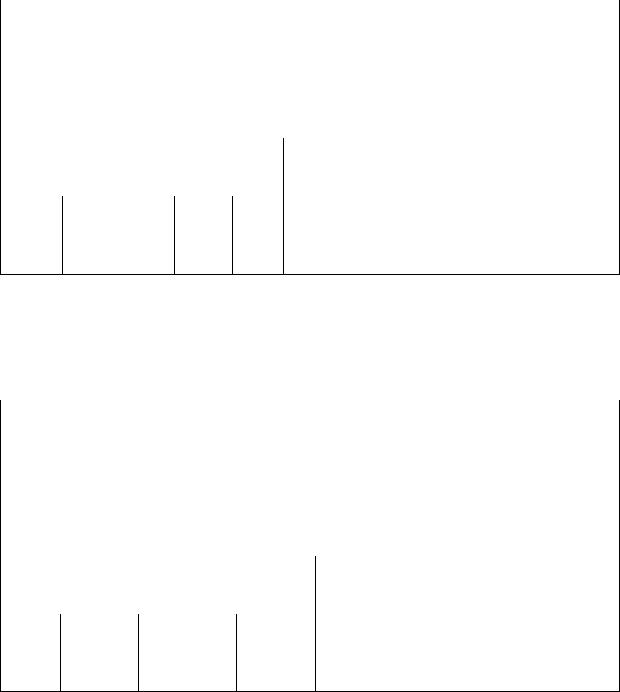
Таблица 13. 5 Использование составов репéрных точек для определения
нонвариантных равновесных фаз в системе
MgCl2·6H2O – 2MgCl2·CaCl2·12H2O(C) – H2O
Точка |
Состав, % мас. |
|
Основные коэффициенты |
||
MgCl2·6H2O |
C |
H2O |
c1={MgCl2·6H2O}/{H2O} |
c2={C}/{H2O} |
|
|
|
|
Нода P- MgCl2·6H2O |
|
|
a |
−55,60 |
123,44 |
32,16 |
−1,7286 |
3,8373 |
b |
−28,19 |
101,68 |
26,51 |
−1,0632 |
3,8350 |
|
|
|
|
|
c2 ср= 3,8362 |
|
|
Нода P- 2MgCl2·CaCl2·12H2O(C) |
|
||
c |
−70,65 |
138,49 |
32,16 |
−2,1968 |
4,3064 |
d |
−58,20 |
131,68 |
26,52 |
−2,1950 |
4,9665 |
|
|
|
|
c1 ср= -2,1959 |
- |
P* |
−83,17 |
145,29 |
37,88 |
-2,1959 |
3,8362 |
|
MgCl2 |
CaCl2 |
H2O |
|
|
P** |
14,51 |
31,18 |
54,31 |
|
|
P*** |
14,54 |
31,17 |
54,29 |
|
|
*– состав выражен истинными концентрациями;
**– состав выражен аналитическими концентрациями;
***– справочные данные выражены аналитическими концентрациями
Таблица 13. 6 Использование составов репéрных точек для определения нонвариантных равновесных фаз в системе 2MgCl2·CaCl2·12H2O(C) – CaCl2·6H2O – H2O
Точка |
|
Состав, % мас. |
|
Основные коэффициенты |
|||
C |
|
CaCl2·6H2 |
|
H2O |
c3={CaCl2·6H2O}/{H2O |
c4={C}/{H2O} |
|
|
|
O |
|
} |
|||
|
|
|
|
|
|
||
|
|
|
|
Нода E- CaCl2·6H2O |
|
||
g |
21,78 |
|
70,65 |
|
7,57 |
9,3383 |
2,8793 |
h |
17,93 |
|
75,83 |
|
6,24 |
12,1517 |
2,8726 |
|
|
|
|
|
|
|
c4 ср= 2,8759 |
|
|
|
Нода E- 2MgCl2·CaCl2·12H2O(C) |
|
|||
e |
36,75 |
|
55,66 |
|
7,59 |
7,3322 |
4,8412 |
f |
47,89 |
|
45,86 |
|
6,25 |
7,3304 |
7,6546 |
|
|
|
|
|
|
c3 ср= 7,3313 |
- |
E· |
25,66 |
65,42 |
|
8,92 |
7,3313 |
2,8759 |
|
Точка |
MgCl2 |
|
CaCl2 |
H2O |
|
|
|
E** |
9,45 |
38,68 |
|
51,87 |
|
|
|
E*** |
9,43 |
38,70 |
|
51,87 |
|
|
|
*– состав в истинных концентрациях;
**– состав в аналитических концентрациях;
***– справочные данные в аналитических концентрациях Функциональные зависимости показателя преломления жидкой фа-
зы от состава ИСК при изучении сечений: а1÷а3(р-р)-2Na2SO4·Na2CO3; b1÷b2(р-р)-NaCl – представляют собой кривые линии переходящие в горизонтальные прямые. Точки излома показывают растворимость беркеита и
159
хлорида натрия в растворах другой соли. Эти зависимости выглядят аналогично таковой, изображенной на рис. 13. 6 для функциональной зависимости показателя преломления жидкой фазы от состава ИСК при изучении растворимости беркеита в воде.
В указанных сечениях смеси с 1-й по 6-ю являются гомогенными, в которых исследуемые физические свойства монотонно изменяются и их совокупность позволяет подробно описать свойства растворов гомогенной части системы. ИСК 7÷9 являются гетерогенными, в которых состав равновесной жидкой фазы остается постоянным, соответствующим растворимости добавляемой соли в растворе сечения. Равенство физического свойства жидкой фазы гетерогенных смесей с высоким содержанием твердой фазы однозначно указывает на равновесность и постоянство состава добавленной твердой фазы, что позволяет следить за корректностью экспериментов.
Точки изломов функциональных зависимостей отвечают составам насыщенных растворов, которые переносят на соответствующие сечения диаграммы состава.
С целью оптимизации выбора сечений по изучению линий моновариантных равновесий находят перспективные проекции полученного эвтонического раствора (Е) на водно-солевые стороны треугольника состава изучаемой системы. На отрезках ЕВ-H2O и R1-H2O выбирают необходимое количество составов исходных растворов сечений (b1÷b2 и а1÷а3) для изучения линий моновариантных равновесий.
Таким образом, метод сечений является структурно чувствительным и позволяет определять составы равновесных нонвариантных жидких и твердых фаз без их взаимной изоляции.
13.2.4, 5). Обобщение результатов исследований фазовых равновесий в тройной системе NaCl – Na2CO3·2Na2SO4 – H2O при 50°C
Использование оптимизированного метода сечений для исследования растворимости приводит к получению значительного количества экспериментальной информации сводимой в таблицах и изображаемой на рисунках. Чтобы не загромождать текст работы целесообразно таблицы экспериментальных данных, содержащие все массы взвешиваний, фазовые состояния и измеренные показатели преломления жидких фаз ИСК, помещать в приложение, а наиболее значимую – в раздел, обобщающий результаты исследований.
Структура и содержание этого раздела показаны на примере изучения фазовых равновесий в тройной системе системы NaCl – Na2CO3·2Na2SO4 – H2O при 50°C оптимизированным методом сечений, о которой речь шла выше.
На рисунке 13. 11 и в табл. 13. 7 представлены направления изученных сечений и составы ИСК в них.
160
