
Posob_2012_Ok
.pdf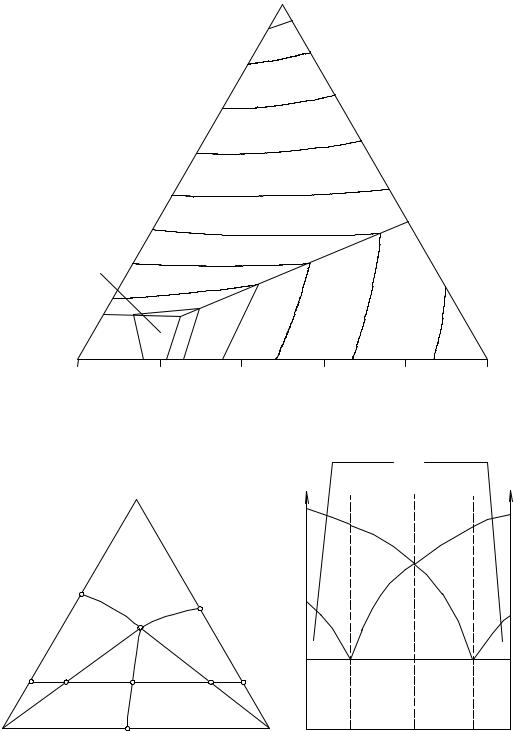
Tl2SO4
|
|
|
|
600 |
600°С |
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
550 |
|
|
550 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
500 |
|
|
|
|
500 |
|
|
|
|
|
|
|
Tl2SO4 |
|
|
|
|
|
|
|||
|
|
450 |
|
|
|
450 |
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
400 |
|
|
|
|
|
|
|
400 |
|
|
|
|
350 |
|
|
|
|
|
|
|
350 |
|
|
|
TlNO3 |
300 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
300 |
|
|
400°С |
|
|||
|
|
|
|
|
|
|
|
|
|
|||
250 |
|
|
|
250 |
|
|
|
|
||||
|
|
|
TlCl |
|
|
|
|
|||||
|
200 |
E 200 |
|
|
|
|
|
|
|
|||
0 |
200 20200 |
250 |
40 |
|
300 |
60 |
350 |
80 |
400 |
100 |
|
|
Tl2(NO3)2 |
|
|
|
% мол. |
|
|
Tl2Cl2 |
|
||||
|
Рис. 14. 3. Система TlNO3 - TlCl - Tl2SO4 |
|
|
|||||||||
|
|
|
|
|
|
|
L+A+C |
L+B+C |
|
|||
|
C |
|
|
|
|
T |
|
1 |
2 |
|
3 |
T |
|
|
|
|
|
|
TDI |
|
|
L |
|
|
TFI |
eI |
|
|
eIII |
|
|
TDII |
L + A |
|
L + B |
|
||
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
L + A + B |
|
TFII |
||||
|
E |
|
|
|
|
TE |
|
|
TE |
|||
|
|
|
|
|
|
|
|
|
||||
D 1 |
|
|
3 |
F |
|
|
|
|
||||
2 |
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
A + B + C |
|
|
||
|
|
|
|
|
|
|
|
|
|
|
||
A |
eII |
|
|
|
|
B |
D |
|
|
|
|
F |
Рис. 14. 4. Политермический разрез D-F
В исходном расплаве D температура первичного выделения (TDI) выше, чем температура вторичного (TDII) выделения. В точке 2 эти температуры совпадают (узловая точка первичных и вторичных выделений). По мере изменения содержания компонента В от точки D до точки 2 температура первичной кристаллизации компонента А плавно уменьшается, от
171
точки 2 до точки F температура первичного выделения плавно же возрастает, но кристаллизуется компонент В.
Точки 1 и 3 являются узловыми для границ вторичных выделений и третичной кристаллизации в политермическом разрезе. От точки D до точки 1 температура вторичного выделения уменьшается от TDII до ТЕ, кристаллизуется при этом смесь компонентов А и С. От точки 1 до точки 2 температура начала вторичного выделения увеличивается, кристаллизуется при этом смесь компонентов А и В. От точки 2 до точки 3 также протекает совместная кристаллизация компонентов А и В, температура начала вторичного выделения снижается до эвтектической. От точки 3 до точки F происходит вторичная кристаллизация компонентов В и С, температура начала вторичного выделения по мере увеличения содержания компонента
В в исходной смеси возрастает до температуры вторичного выделения исходной смеси F (TFII).
Третичное выделение всех компонентов системы происходит на всем протяжении разреза при температуре ТЕ. Ниже этой температуры жидкая фаза отсутствует. Предельная нода ТЕ-ТЕ является линией солидуса.
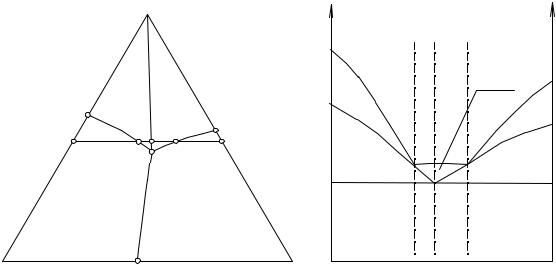
На рис.14. 5 изображен политермический разрез G-H, проходящий параллельно стороне АВ между тройной и двойными эвтектиками системы. В разрезе также имеется три характеристические точки. Точки 1 и 3 находятся на линиях вторичных выделений, а точка 2 - на вспомогательной
линии СЕ.
C T T
1 2 3
eI |
|
|
L+A |
L+C |
|
|
|
L+B |
|
||
|
2 |
|
L |
|
|
G |
|
eIII |
|
|
|
1 E |
3 |
H |
|
|
|
|
TE L+A+C |
L+B+C |
TE |
A+B+C
A |
eII |
B G |
|
|
|
|
|
H |
|
|
|
||||||
|
Рис. 14. 5. Политермический разрез G-H |
|
|
|||||
Политермический разрез A-M (см. рис. 14.6) исходит из вершины, отвечающей чистому компоненту А, проходит на сторону СВ треугольника состава и пересекает линию вторичных выделений еIE (точка 1), а также вспомогательную линию СЕ (точка 2). Для проверки правильности пос-
172
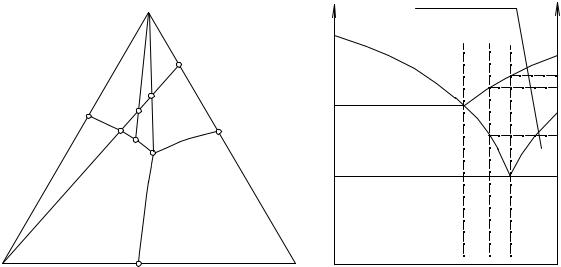
троения политермического разреза воспользуемся для примера текущим составом Х.
Исходная смесь Х находится в поле кристаллизации компонента С, внутри кривостороннего треугольника СеIE. Данный расплав должен иметь первичное выделение С (температура ТХ), вторичное выделение компонентов А и С(температура ТX') и третичное выделение всех трех компонентов при температуре тройной эвтектики. И в политермическом разрезе, правая часть рисунка, вертикаль Х пересекает эти же фазовые области. Причем температура первичного выделения должна быть ниже температуры первичного выделения сплава 2, но выше температуры начала кристаллизации сплава 1. Температура начала вторичного выделения сплава Х (TX') должна быть ниже температуры начала вторичного выделения сплава 1, но выше температуры тройной эвтектики. Все эти факты также соответствуют изображению политермического разреза. Аналогично могут быть проверены и другие части построенного разреза.
|
|
|
|
C |
|
T |
L+B+C |
T |
||
|
|
|
|
|
M |
TA |
L |
1 |
X 2 |
|
|
|
|
|
|
|
|
|
|
T2 |
|
|
|
|
|
|
|
|
L+A |
|
|
|
e |
|
X |
2 |
|
T1 |
|
L+C |
TX |
||
|
e |
|
|
|||||||
|
I |
|
|
|
III |
|
|
|
TIII |
|
|
|
|
|
|
|
|
|
|
||
|
|
1 |
|
|
|
L+A+C |
|
|
TX' |
|
|
|
X' E |
|
|
|
|
||||
|
|
|
|
|
|
|
|
TE |
||
|
|
|
|
|
|
|
A+B+C |
|
|
|
A |
eII |
B A |
|
|
M |
|
|
||||
|
Рис. 14. 6. Политермический разрез A-M |
|
|
|
|
14. 4. Изотермические разрезы тройной системы простого эвтектического типа
Переходя к изучению горизонтальных или изотермических разрезов, используем данные рис. 14. 3 для их построения. Первое изотермическое сечение проведем при температуре, равной 400°С (см. рис. 14. 7). Эта температура ниже точек плавления сульфата и хлорида таллия, но выше температур плавления нитрата таллия и всех эвтектик системы. Разрез пересекает части поверхности солидуса, отвечающие выделению сульфата и хлорида таллия.
На рис. 14. 7 видны две изотермические линии, отделяющие на плоскости концентрационного треугольника два поля гетерогенных равно-
173
весий L+Tl2SO4 и L+TlCl от гомогенной жидкофазной области. Для подчеркивания гетерогенного характера в полях кристаллизации компонентов проведены ноды. Пунктирными линиями изображены моновариантные линии системы.
Второй разрез проведем при 300°С (рис. 14. 8). При этой температуре изотермы пересекаются на линии двойного выделения хлорида и сульфата таллия. Возникает трехфазная область совместного существования расплава с кристаллами хлорида и сульфата таллия. Валовой состав твердой фазы, соотношение твердых и жидкой фазы, а также соотношение каждой из солей в донной фазе можно определить по правилу рычага (точ-
ки N, N', O, O').
|
|
|
Tl |
SO |
4 |
|
|
|
|
|
|
Tl2SO4 |
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
L+Tl SO |
4 |
|
|
|
|
|
|
L+Tl2SO4 |
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
N' L+TlCl+Tl2SO4 |
|
|
400 |
|
|
|
|
400°C |
|
|
|
|
|
N |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
L |
|
|
|
400°С |
|
300°C |
|
|
300 |
O |
O' |
|
|
|
|
|
|
|
|
|
L |
|
|
|
||||
|
|
|
|
|
|
|
|
L+TlCl |
|
|
|
|
|
L+TlCl |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
0 |
20 |
|
40 |
|
60 |
80 |
400 |
100 |
0 |
20 |
40 |
300°C |
60 |
80 |
100 |
Tl2(NO3)2 |
|
% мол. |
|
Tl2Cl2 |
Tl2(NO3)2 |
|
% мол. |
|
Tl2Cl2 |
||||||
|
Рис. 14. 7. Изотермический разрез |
|
Рис. 14. 8. Изотермический разрез |
||||||||||||
|
системы Tl2SO4 - TlNO3 - TlCl при |
|
системы Tl2SO4 - TlNO3 - TlCl при |
||||||||||||
|
|
|
|
400°С |
|
|
|
|
|
|
300°С |
|
|
||
|
|
Третий разрез проведем при 200°С (рис. 14. 9). Он отличается от |
|||||||||||||
предыдущего разреза наличием второй трехфазной области (L + Tl2SO4 + |
|||||||||||||||
TlNO3). |
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
14. 5. Оптимальный план изучения тройных систем плавкости |
|||||||||||||
|
|
|
|
|
|
простого эвтектического типа |
|
|
|
||||||
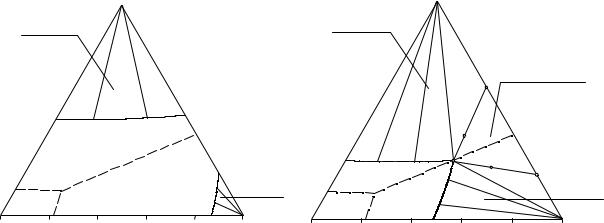
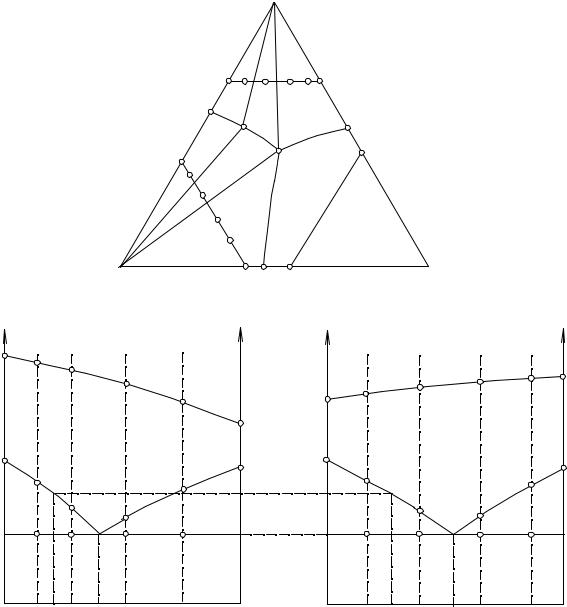
Д.А. Петровым предложен прием, с помощью которого по минимальному числу вертикальных разрезов можно определить положение пограничных кривых и эвтектики. Мы ограничимся изложением метода в применении к системе с простой эвтектикой. Покажем, как находится пограничная кривая еIE.
Экспериментально исследуются политермические разрезы FG и MN на треугольной диаграмме (см. рис. 14.10). Метод основан на том, что составы, примыкающие к точке F, имеют кривую вторичных выделений, общую с составами, примыкающими к точке М во втором разрезе.
174

На общих кривых вторичных выделений интерполяцией экспериментальных данных находят два состава исходных смесей (точки х1 и х2) с одинаковой температурой начала вторичных выделений(ТХ). Полученные точки наносят на концентрационный треугольник и проводят ноды А-х1 и С-х2 до пересечения друг с другом в точке Х, лежащей на линии вторичных выделений.
Экстраполяцией экспериментальных данных в обоих сечениях находят точки пересечения линий вторичных выделений с солидусом системы (точки y1 и y2). Проводя ноды А-y1 и С-y2 до пересечения друг с другом, находят состав тройной эвтектики системы (точка Е).
Tl2SO4
L+Tl2SO4
L+TlCl+Tl2SO4
L+TlNO3+Tl2SO4
L+TlNO3 |
|
L+TlCl |
|
200 |
|
|
|
|
|
L |
|
0 |
200°C20200°C |
40 |
60 |
80 |
100 |
Tl2(NO3)2 |
|
% мол. |
|
Tl2Cl2 |
|
Рис. 14. 9. Изотермический разрез системы Tl2SO4 - TlNO3 - TlCl при 200°С
Аналогичным путем можно получить любое количество точек на линии вторичных выделений еIЕ. Таким же путем можно получить точки на кривых еIIЕ и еIIIЕ, разделяющие поля кристаллизации компонентов А и В, а также В и С. Для этого нужно изучить лишь еще один аналогичный политермический разрез (RS), лежащий в поле кристаллизации компонента В.
175
C
|
|
M |
5 |
6 7 8 |
N |
|
|
eI |
|
x2 |
y2 |
eIII |
|
|
|
|
|
|
||
F |
1 |
|
X |
|
E |
S |
2 |
|
|
|
|||
|
x1 |
|
|
|
|
|
|
y1 3 |
4 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
A |
G eII R |
|
B |
|
|
|
1 |
2 |
L |
3 |
4 |
5 |
6 |
L |
7 |
8 |
|
|
|
|
|
|
|
|
L+A |
|
L+C |
|
|
|
|
|
|
|
|
TX |
TX |
|
|
L+ A+C |
L+A+B TE |
TE L+ A+C |
|
L+B +C |
|
A+B+C |
|
|
A+B+C |
F x1 y1 |
G |
M x2 |
y2 |
N |
Рис. 14. 10. Построение диаграммы плавкости по способу Петрова
176
Часть 2. Физико-химический анализ многокомпонентных водно-солевых систем
15.Способы выражения концентраций и изображение составов в четверных водно-солевых системах
Прежде чем начинать рассмотрение изотерм растворимости четверных водно-солевых систем, необходимо описать основные способы выражения концентраций и изображения этих систем.
15.1. Способы выражения концентрации и их взаимный пересчет
Величина, характеризующая количество какой-либо составной части в определенном количестве смеси, называется концентрацией. Под концентрацией раствора понимают количество растворенного вещества, содержащегося в определенном количестве раствора или растворителя.
Концентрацию раствора можно выражать различными способами. Выбор того или иного способа выражения концентрации определяется преимущественно практическими соображениями (необходимость облегчить расчеты, упростить сравнение одних данных с другими, сделать обобщения и т.д.). Для выражения концентрации используются как массовые и объемные, так и молекулярные, атомные и другие отношения.
Приведем некоторые общие выражения концентраций: массовые (масса / масса), объемно-массовые (масса / объем), объемные (объем / объем), мольно-объемные (число молей / объем), мольно-массовые (число молей / масса), мольные, атомные, эквивалентные.
15.1.1. Массовые концентрации
Массовой долевой концентрацией (массовой долей) называется концентрация, выраженная отношением массы вещества в смеси (растворе) к массе всей смеси (раствора). Массовые доли, умноженные на 100, выражают массовые проценты. Массовая доля, выраженная в процентах, называется массовой процентной концентрацией (% мас.). Сумма массовых долей равна 1, а сумма массовых процентов - 100.
Массовые концентрации измеряют двумя способами:
а) числом граммов вещества на 100 г раствора, т.е. в массовых процентах;
б) числом граммов вещества на 100 г растворителя (чаще всего воды), т.е. массовым отношением.
15.1.2. Объемные концентрации
Объемные концентрации измеряют чаще всего двумя способами: а) числом граммов вещества на 1 л раствора; б) числом молей вещества на 1 л раствора (мольно-объемная кон-
центрация).
177
Мольно-объемной концентрацией называется концентрация, выраженная числом молей одного вещества (или нескольких веществ) в единице объема смеси. Раствор, содержащий в одном литре С молей растворенного вещества, называется С молярным.
Последние способы измерения концентрации часто предпочитают другим, так как измерять объемы растворов проще, чем определять их массу. При этом следует учитывать, что количество воды в растворе остается неизвестным, вследствие чего для пересчета концентрации необходимо знать плотность раствора.
В растворах, полученных путем смешения двух жидкостей, концентрация часто выражается в объемных процентах, т.е. числом объемов данной жидкости, содержащихся в 100 объемах раствора.
Растворимость газов также принято обозначать в различных единицах. Состав газовых смесей иногда обозначают в объемных долях (например, в объемных %), т.е. в отношениях парциальных объемов к общему объему смесей. Парциальный объем - объем какого-либо одного газа, входящего в состав газовой смеси при давлении и температуре смеси. Для смеси идеальных газов объемные доли совпадают с мольными.
15.1.3. Мольные концентрации
Мольно-долевой концентрацией (мольной долей) называется концентрация, выраженная отношением числа молей одной из составляющей смеси к общему числу молей всех ее составляющих. Мольные доли, умноженные на 100, выражают мольные %, называемые также мольнопроцентной концентрацией. Сумма мольных долей равна 1, а сумма мольных процентов - 100.
Мольные концентрации измеряют обычно тремя способами:
а) числом молей вещества, растворенного в 100 молях раствора, т.е. мольных %;
б) числом молей вещества, растворенного в 1000 молей растворителя, обычно воды;
в) числом молей вещества, растворенного в 1000 г растворителя (мольно-массовая концентрация).
Раствор, содержащий m молей растворенного вещества в 1000 г растворителя, называется m-моляльным.
15.1.4. Атомные концентрации
Атомно-долевой концентрацией (атомной долей) называется концентрация, выраженная отношением числа г-атомов одной из составляющей смеси к общему числу г-атомов всех ее составляющих. Атомные доли, умноженные на 100, выражают атомные проценты. Атомная доля, выраженная в %, называется атомно-процентной концентрацией (атомным % или ионным % для ионов). Сумма атомных долей равна 1, а сумма атомных процентов - 100.
178
15.1.5. Эквивалентные концентрации
При наличии в растворе нескольких солей возможно их химическое взаимодействие - реакции обменного разложения, образование гидратированных солей, двойных солей и т.п., вследствие чего определить состав раствора становится затруднительно. Выражать концентрацию таких растворов целесообразнее в эквивалентных единицах, например в г-эквива- лентах (г-экв) веществ или ионов. Какие бы химические взаимодействия ни происходили в растворе, количество того или иного иона остается постоянным вне зависимости от формы его связей. Поэтому выражение концентрации, например, в эквивалентных % имеет ряд преимуществ при графическом изображении составов растворов. В этом случае состав обычно выражается числом грамм-эквивалентов веществ, приходящихся на 100 г-экв сухого остатка (сумма всех веществ, находящихся в растворе за исключением растворителя). Содержание воды при этом выражается числом молей воды (растворителя), приходящимся на 100 г-экв суммы сухого остатка.
Если валентность ионов, находящихся в растворе, одинакова, содержание веществ в сухом остатке можно выразить не в грамм-эквивален- тах, а в грамм-молях.
Вместо грамм-эквивалентов веществ состав раствора можно выразить в грамм-эквивалентах ионов, приходящихся на 100 г-экв суммы катионов или анионов. При этом суммы катионов и анионов порознь должны быть равны 100. В этом случае концентрации носят название ионэквивалентных % (% ион-экв).
Эквивалентные концентрации выражают:
а) числом грамм-эквивалентов вещества, растворенного в 1000 г растворителя, обычно воды;
б) числом грамм-эквивалентов вещества, приходящегося на 100 г- экв сухого остатка раствора (% экв.);
в) числом грамм-эквивалентов ионов, приходящихся на 100 г-экв суммы ионов раствора (% ион-экв.);
г) числом грамм-эквивалентов (СЭ) вещества, растворенного в 1 л раствора (СЭ нормальный).
В частном случае в теории и практике аммиачно-содового производства широко применяются так называемые "нормальные деления" (н. д.). Эта единица измерения концентрации в 20 раз больше нормальной концентрации раствора.
15.1.6. Взаимный пересчет концентраций
Взаимный пересчет концентраций можно проиллюстрировать следующими примерами (см. табл. 15. 1).
1. Состав раствора дан в массовых %. Выразить состав раствора в граммах растворенного вещества на 100 г растворителя.
179
В растворе содержится А г вещества на 100 г раствора или (100-А) г растворителя. Отсюда на 100 г растворителя приходится В г вещества по
уравнению |
|
В = 100А/(100-А). |
(15.1) |
2. Дана плотность раствора, содержащего А % мас. вещества. Выразить состав раствора в граммах на 1 л, т.е. в объемных концентрациях (СВ).
Масса 1 л раствора составляет 1000d г. В этих 1000d г раствора содержится СВ г вещества. Зная содержание А г вещества в 100 г раствора,
находим: |
|
СВ = А1000d/100 = 10Аd. |
(15.2) |
Зная массу 1 л раствора и сумму растворенных в 1 л веществ, можно по разности определить количество воды в 1 л раствора.
3. В растворе содержится А % мас. вещества. Выразить состав раствора в молях на 1000 г растворителя (m), т.е. мольно-массовую концентрацию.
Число молей растворенного вещества в 100 г раствора составляет а=А/М, где М - молекулярная масса растворенного вещества. Число молей а приходится на (100-А) г растворителя. Следовательно, в 1000 г растворителя содержится следующее количество молей растворенного вещества:
m = а/(100-А) = 1000А/(М-(100-А)). |
(15.3) |
4. В растворе содержится А % мас. вещества. Выразить состав раствора в молях на 1000 молей растворителя (n), т.е. мольную концентрацию.
Число молей растворенного вещества в 100 г раствора составляет а=А/М. Это количество молей приходится на а0 = (100-а)/M0 молей растворителя, где M0 - молекулярная масса растворителя. Следовательно, в 1000 молей растворителя содержится следующее количество растворенного ве-
щества: |
|
n = 1000a/a0 = AM01000/(M(100-A)). |
(15.4) |
5. В растворе плотностью d содержится А % мас. вещества. Выразить состав раствора в молях на 1 л раствора (С), т.е. мольно-объемную концентрацию.
В 100 г раствора содержится а=А/М молей растворенного вещества. Масса 1 л раствора составляет 1000d г. Следовательно, в 1000d г раствора содержится следующее количество молей растворенного вещества:
C = 1000da/100 = 1000dA/(100M) = 10dA/M. |
(15.5) |
180
