
Posob_2012_Ok
.pdfхлорида триэтиламмония ((C2H5)3NHCl-e1Ee2) и дигидрофосфата аммония (NH4H2PO4-e2E NK2Me3); область монотектического равновесия кристаллов дигидрофосфата аммония и двух жидких фаз (MK2N); нода (MN), отображающая условно нонвариантное равновесие кристаллов гидрофосфата, дигидрофосфата аммония и двух жидких фаз - нижней, солевой состав которой отображается т. М, и верхней - N; линия двойного насыщения относительно гидрофосфата аммония и хлорида триэтиламмония (e1E); дигидрофосфата аммония и хлорида триэтиламмония (e2E); линия двойного насыщения относительно фосфатов аммония разорвана предельной монотектической нодой на две части (e3M и NE); точка (Е), отображающая солевой состав тройного эвтонического раствора, насыщенного относительно всех трех солевых компонентов системы.
По данным применения статистического метода главных компонент неплоскостность всех составов, представленных в табл. 16. 6, составляет 9,1 % отн. Неплоскостность составов жидких фаз предельного монотектического равновесия, точек на линиях моновариантных равновесий и нонвариантных растворов составляет 0,5 % отн. Что подтверждает распространение коллигативного свойства многократно насыщенных растворов на системы монотектического типа, с одной стороны, неприменимость этого свойства к составам жидких фаз, участвующих в моновариантных моноткектических равновесиях с твердыми фазами, – с другой стороны.
16.6.5. Порядок кристаллизации солевых компонентов в процессе изотермического испарения исходных реакционных смесей водно-солевых систем монотектического типа
Для исследования процесса изотермического испарения воспользуемся изотермой растворимости системы NH4H2PO4 – (NH4)2HPO4 – (C2H5)3NHCl – H2O при 20°С, которая в упрощенном виде представлена на рис. 16. 16.
Рассматривая рис. 16. 16, отмечаем, что порядок кристаллизации исходных смесей, лежащих в треугольниках (NH4)2HPO4-N-(C2H5)3NHCl и NH4H2PO4-N-(C2H5)3NHCl, ничем не отличается от таковых в четверных водно-солевых системах простого эвтонического типа.
Солевой состав исходной ИСК F находится в треугольнике (NH4)2HPO4-N-M в поле кристаллизации гидрофосфата аммония, а не в монотектической области этого треугольника. Поэтому при изотермическом испарении сначала кристаллизуется гидрофосфат аммония, солевой состав жидкой фазы меняется по лучу (NH4)2HPO4-F от т. F до т. F1В на границе монотектической области, точка твердой фазы остается в вершине солевого треугольника состава, отвечающей гидрофосфату аммония.
В т. F1В возникает первая капля второй жидкой фазы, вариантность системы уменьшается на единицу: составы жидких фаз начинают изме-
221
няться по линии моновариантного равновесия кристаллов гидрофосфата аммония и двух жидких фаз (верхняя - по линии F1BN, нижняя - по F1HM).
По аналогии с понятием т. твердой фазы, которое означает средний солевой состав твердой фазы, введем понятие т. жидкой фазы, подразумевающее средний солевой состав жидкой фазы, состоящей из двух или более различных жидких фаз.
NH4H2PO4
GG2 3
e3 M GH

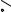



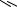


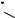

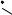



 K2
K2
G |
|
F1H |
G1 |
GB |
F4 |
K1 |
F2 |
N |
F3 |
|
F1B |
|
F |
|
Ee2 |
|
|
|
||
|
|
|
e1 |
0 |
20 |
40 % мас. 60 |
80 |
100 |
(NH4)2HPO4 |
|
(C2H5)3NHCl |
||
Рис. 16. 16. Процесс изотермического испарения различных исходных смесей системы NH4H2PO4 - (NH4)2HPO4 - (C2H5)3NHCl - H2O при 20°С
При дальнейшем изотермическом испарении продолжает кристаллизоваться гидрофосфат аммония, точка жидкой фазы перемещается по лучу (NH4)2HPO4-F1В от т. F1В до т. F2 на предельной монотектической ноде. Состав нижней жидкой фазы при этом меняется по границе монотектической области от т. F1Н до т. М, состав верхней - от т. F1В до т. Ν.
Когда точка жидкой фазы оказывается в т. F2, появляется первый кристалл дигидрофосфата аммония и при изотермическом испарении протекает инконгруэнтная условно нонвариантная монотектическая фазовая реакция:
M(L) → N(L) + (NH4)2HPO4(S) + NH4H2PO4(S).
222
Реакция заканчивается после исчезновения последней капли нижней жидкой фазы. Во время протекания предельной монотектической фазовой реакции составы жидких фаз остаются постоянными, точка жидкой фазы перемещается по предельной ноде от т. F2 до т. Ν, суммарный состав твердой фазы изменяется по стороне солевого треугольника состава от вершины, отвечающей гидрофосфату аммония, до т. F3.
Далее протекает процесс совместной кристаллизации гидрофосфата и дигидрофосфата аммония. Состав жидкой фазы меняется по линии двойного насыщения относительно фосфатов аммония от т. N до т. E, точка твердой фазы - от т. F3 до т. F4.
В точке E начинается кристаллизация трех твердых фаз, при постоянной температуре и давлении четырехфазное равновесие является нонвариантным, составы равновесных фаз постоянны. Суммарный состав твердой фазы изменяется по лучу F4-E от т. F4 до т. F, когда точка твердой фазы приходит в точку F, тогда исчезает последняя капля эвтонического раствора Е.
Составы исходных реакционных смесей, находящиеся в треугольнике NH4H2PO4-N-M в поле кристаллизации дигидрофосфата аммония, но не в монотектической области этого треугольника, кристаллизуются так же, как смесь F, но начинает кристаллизоваться дигидрофосфат аммония.
Солевой состав исходной ИСК G находится в монотектической области треугольника NH4H2PO4-N-M. Поэтому при изотермическом испарении сначала произойдет расслаивание, солевой состав жидкой фазы остается в точке G, солевые составы равновесных жидких фаз изменяются от т. G до точек GН и GВ на границе монотектической области, твердая фаза в это время отсутствует.
Когда составы нижней и верхней жидких фаз оказываются в точках GН и GВ соответственно, начинается кристаллизация дигидрофосфата аммония. Далее точка жидкой фазы меняется по лучу NH4H2PO4-G от т. G до т. G1, солевой состав нижней жидкой фазы перемещается по границе монотектической области от т. GН до т. М, верхней - от т. GВ до т. N, суммарный солевой состав твердой фазы находится в вершине дигидрофосфата аммония.
По достижении составами жидких фаз точек М и N начинается предельная монотектическая фазовая реакция: M(L) → N(L) + (NH4)2HPO4(S) + NH4H2PO4(S), составы жидких фаз остаются постоянными, точка жидкой фазы перемещается по предельной монотектической ноде MN от т. G1 до т. N, точка твердой фазы перемещается из вершины дигидрофосфата аммония в точку G2.
Далее протекает процесс совместной кристаллизации гидрофосфата и дигидрофосфата аммония. Состав жидкой фазы меняется по линии двой-
223
ного насыщения относительно фосфатов аммония от т. N до т. E, точка твердой фазы - от т. G2 до т. G3.
В точке E начинается кристаллизация трех твердых фаз, составы равновесных фаз постоянны. Суммарный состав твердой фазы изменяется по лучу G3-E от т. G3 до т. G, когда точка твердой фазы приходит в точку G, тогда исчезает последняя капля эвтонического раствора Е, процесс изотермического испарения завершается.
Составы исходных реакционных смесей, находящиеся в монотектической области треугольника (NH4)2HPO4-N-M, при изотермическом испарении кристаллизуются аналогично смеси G, но первым выделяется в осадок гидрофосфат аммония.
Особенностью кристаллизации составов исходных реакционных смесей, находящиеся в кривосторонних треугольниках (NH4)2HPO4-e3-M и NH4H2PO4-e3-M, при изотермическом испарении является тот факт, что после первичной кристаллизации гидрофосфата или дигидрофосфата аммония соответственно, вторичной кристаллизации смеси этих фаз сразу начинается нонвариантная монотектическая фазовая реакция, в дальнейшем они ведут себя аналогично смесям F и G.
16.7. Четверные водно-солевые системы с образованием конгруэнтно растворимого соединения. Система
Na2CO3 – NaCl – Na2SO4 – H2O при 50°С
16.7.1. Оконтуривающая система Na2CO3 – NaCl – H2O при 50°С
Фазовые равновесия в системе Na2CO3 – NaCl – H2O при 50°С изображены в аналитических концентрациях на рис.16. 17, справочные и экспериментальные данные, выраженные в истинных концентрациях, сведены в табл. 16. 9. Изотерма растворимости имеет простой эвтонический тип, усложненная образованием необезвоживающегося моногидрата карбоната натрия.
16.7.2. Оконтуривающая система NaCl – Na2SO4 – H2O при 50°С
Фазовые равновесия в системе NaCl – Na2SO4 – H2O при 50°С изображены в аналитических концентрациях на рис. 16. 17, справочные и экспериментальные данные, выраженные в истинных концентрациях, сведены в табл. 16. 10. Изотерма растворимости имеет простой эвтонический тип с кристаллизацией безводных исходных солевых компонентов.
16.7.3. Оконтуривающая система Na2SO4 – Na2CO3 – H2O при 50°С
Фазовые равновесия в системе Na2SO4 – Na2CO3 – H2O при 50°С изображены в аналитических концентрациях на рис. 16. 17, экспериментальные данные, выраженные в истинных концентрациях, сведены в табл. 16. 11. Изотерма растворимости имеет сложное строение. В системе при 50°С образуется конгруэнтно растворимое химическое соединение состава Na2CO3·2Na2SO4(Brk), называемое беркеитом, образуется моногидрат кар-
224
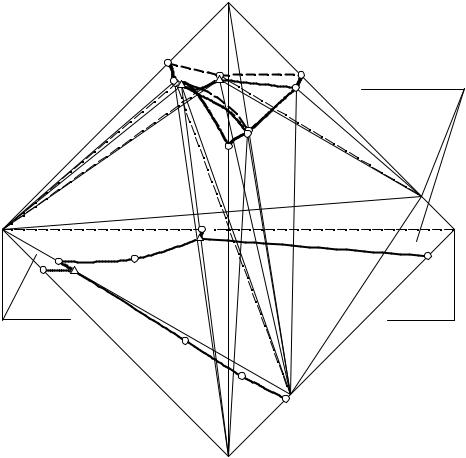
боната натрия, который не обезвоживается в присутствии химического соединения.
H2O
R2 |
e12 |
|
e23 e24 |
|
|
E1 |
|
|
E2 |
|
|
|
|
|
|
R3 |
R |
|
e344 |
R1 |
Na2CO3·H2O |
|
e14 |
||
|
e'24 |
NaCl |
e'12 |
|
|
E'1 |
|
|||
e'23 |
|
|
e'14 |
|
E'2 |
Na |
CO ·2Na SO |
||
|
2 |
3 2 |
4 |
|
NaCl |
|
|
|
Na2CO3 |
Na2SO4
e'Na34 2CO3·2Na2SO4
Na2SO4
Рис. 16. 17. Система NaCl – Na2CO3· – Na2SO4 – H2O при 50°С
Таблица 16. 9 Фазовые равновесия в системе Na2CO3 - NaCl - H2O при 50°С.
Точка |
Состав, % мас. |
|
|||
|
Na2CO3·H2O |
NaCl |
|
H2O |
|
|
|
Жидкие фазы |
|
||
R1 |
37,68 |
- |
|
62,32 |
Na2CO3·H2O |
|
23,21 |
12,67 |
|
64,13 |
-"- |
|
28,44 |
6,43 |
|
65,13 |
-"- |
e12 |
16,48 |
18,38 |
|
65,14 |
Na2CO3·H2O+NaCl |
|
10,90 |
22,32 |
|
66,78 |
NaCl |
|
5,79 |
23,91 |
|
70,30 |
-"- |
R2 |
- |
26,74 |
|
73,26 |
-"- |
|
|
|
Т. |
на нодах |
|
a1 |
33,21 |
14,61 |
|
52,18 |
Na2CO3·H2O |
a2 |
14,14 |
30,91 |
|
54,95 |
NaCl |
|
|
|
225 |
|
|
Таблица 16. 10 Фазовые равновесия в системе Na2SO4 – NaCl – H2O при 50°С.
Т. |
Состав, % мас. |
|
|
Донная фаза |
||
Na2SO4 |
NaCl |
|
H2O |
|
||
|
|
|
|
|||
|
|
|
|
Жидкие фазы |
|
|
R2 |
- |
26,8 |
|
73,26 |
|
NaCl |
|
25,0 |
3,7 |
|
71,3 |
|
-"- |
e23 |
24,2 |
5,3 |
|
70,5 |
|
Na2SO4 + NaCl |
|
20,0 |
7,7 |
|
72,4 |
|
Na2SO4 |
|
15,0 |
12,1 |
|
72,9 |
|
-"- |
|
10,0 |
18,1 |
|
71,9 |
|
|
|
5,0 |
24,7 |
|
70,3 |
|
|
R3 |
31,8 |
- |
|
68,06 |
|
|
|
|
|
|
Т. на |
нодах |
|
b1 |
26,38 |
18,62 |
|
55,00 |
|
Na2SO4 |
b2 |
4,10 |
40,90 |
|
55,00 |
|
NaCl |
На изотерме растворимости системы Na2SO4 – Na2CO3 – H2O имеется поле ненасыщенных растворов (H2O-R1е14R4е34R3), поле кристаллизации одноводного кристаллогидрата карбоната натрия (Na2CO3·H2O-R1е14), безводного сульфата натрия (Na2SO4-R3е34), конгруэнтно растворимого химического соединения (Na2CO3·2Na2SO4-е14е34), поле совместной кристаллизации моногидрата карбоната натрия и химического соединения (Na2CO3·H2O-е14-Na2CO3·2Na2SO4), совместной кристаллизации безводного сульфата натрия и химического соединения (Na2SO4-е34- Na2CO3·2Na2SO4); ветви кристаллизации моногидрата карбоната натрия (R1е14), химического соединения (е14е34), безводного сульфата натрия (R3е34); условно нонвариантные двояконасыщенные растворы е14 – относительно моногидрата карбоната натрия и беркеита, е2 – химического соединения и безводного сульфата натрия.
16.7.4. Разрез 2Na2SO4·Na2CO3 – NaCl –H2O при 50°С
Фазовые равновесия в квазитройной системе 2Na2SO4·Na2CO3 – NaCl – H2O при 50°С изображены в аналитических концентрациях на рис. 16. 18, экспериментальные данные, выраженные в истинных концентрациях, сведены в табл. 16. 12.
Изотерма растворимости имеет простой эвтонический тип, что доказывает конгруэнтный характер растворения беркеита при 50°С.
16.7.5. Система Na2SO4 – Na2CO3 – NaCl –H2O при 50°С
Фазовые равновесия в четверной системе Na2SO4 – Na2CO3 – NaCl – H2O при 50°С изображены в аналитических концентрациях на рис. 16. 17 в виде ортогональной проекции на плоскость параллельную перекрещивающимся сторонам тетраэдра состава. Составы реперных точек на гранях
226
нонвариантных областей системы, выраженные в истинных концентрациях, сведены в табл. 16. 13, а аналитические концентрации жидких фаз – в
табл. 16. 14.
Таблица 16. 11 Фазовые равновесия в системе Na2SO4– Na2CO3–H2O при 50°С.
Точ- |
|
|
Состав, % мас |
|
Донная фаза |
||
ка |
|
Brk |
|
|
Na2CO3·H2O |
H2O |
|
|
|
|
|
||||
|
|
Жидкие фазы в системе Na2CO3·2Na2SO4(Brk) – Na2CO3–H2O |
|||||
R1 |
- |
|
37,68 |
62,32 |
Na2CO3·H2O |
||
|
2,07 |
|
35,87 |
62,06 |
-"- |
||
e14 |
5,69 |
|
32,68 |
61,63 |
Na2CO3·2Na2SO4+ Na2CO3·H2O |
||
|
16,67 |
|
19,46 |
63,87 |
Na2CO3·2Na2SO4 |
||
|
25,67 |
|
8,70 |
65,63 |
-"- |
||
R4 |
32,78 |
|
- |
67,22 |
-"- |
||
|
|
Т. на |
нодах в системе Na2CO3·2Na2SO4(Brk) – Na2CO3–H2O |
||||
c1 |
20,43 |
|
27,57 |
52,00 |
Na2CO3·2Na2SO4 |
||
c2 |
4,55 |
|
46,15 |
49,30 |
Na2CO3·H2O |
||
Точ- |
|
|
|
Состав, % мас, |
|
Донная фаза |
|
ка |
|
Na2SO4 |
|
|
Brk |
H2O |
|
|
|
|
|
||||
|
|
Жидкие фазы в системе Na2CO3·2Na2SO4(Brk) – Na2SO4 – H2O |
|||||
R3 |
|
31,8 |
|
- |
68,2 |
Na2SO4 |
|
|
|
25,29 |
|
5,96 |
68,75 |
-"- |
|
|
|
8,59 |
|
23,77 |
67,64 |
-"- |
|
e34 |
|
2,22 |
|
30,96 |
66,82 |
Na2SO4+2Na2SO4·Na2CO3 |
|
|
|
1,37 |
|
31,64 |
66,98 |
2Na2SO4·Na2CO3 |
|
R4 |
|
- |
|
32,78 |
67,22 |
-"- |
|
|
|
Т. на нодах в системе Na2CO3·2Na2SO4(Brk) – Na2SO4 – H2O |
|||||
d1 |
|
18,05 |
|
25,95 |
56,00 |
Na2SO4 |
|
d2 |
|
1,86 |
|
42,14 |
56,00 |
2Na2SO4·Na2CO3 |
|
Изотерма растворимости при 50°С имеет сложное строение. Из-за образования химического соединения и кристаллизации карбоната натрия в виде одноводного кристаллогидрата поверхность солидуса представлена двумя плоскостями, пересекающимися по линии Na2CO3·2Na2SO4-NaCl. Эвтонический раствор Е2 и линия моновариантных равновесий Е2е34 прижаты к плоскости разреза квазитройной системы NaCl – Na2CO3·2Na2SO4 – H2O и часть полей на рис. 16. 17 плохо различима.
На перспективной проекции имеются и хорошо различимы следующие поля: кристаллизации хлорида натрия (NaCl-e'12E'1e'24E'2e'23), моногидрата карбоната натрия (NaCO3·H2O-e'12E'1e'14), химического соедине-
ния (e'14E'1e'24E'2e'34), безводного сульфата натрия (Na2SO4-e'23E'2e'24e'34); ли-
227
нии двойного насыщения e'12E'1 – относительно одноводного карбоната натрия и хлорида натрия, E'1e'24E'2 – относительно беркеита и хлорида натрия, e'24E'2 – относительно безводного сульфата натрия и хлорида натрия, e'14E1 – относительно одноводного карбоната натрия и беркеита, e'34E'2 – безводного сульфата натрия и химического соединения; имеются две конгруэнтные тройные эвтонические т. (Е'1 и Е'2), которым соответствуют трояконасыщенные растворы относительно одноводного карбоната натрия, химического соединения и хлорида натрия, безводного сульфата натрия, беркеита и хлорида натрия соответственно.
Таблица 16. 12 Фазовые равновесия в системе NaCl – Na2CO3·2Na2SO4 – H2O
Точка |
|
Состав, % мас. |
|
Донная фаза |
|
NaCl |
Na2CO3·2Na2SO4 |
H2O |
|||
|
|
||||
|
Жидкие фазы в системе NaCl – Na2CO3 |
·2Na2SO4 – H2O |
|||
R2 |
26,74 |
- |
73,26 |
NaCl |
|
|
25,90 |
2,23 |
71,87 |
то же |
|
|
25,15 |
4,60 |
70,25 |
-"- |
|
e24 |
25,11 |
6,09 |
68,80 |
NaCl+Na2CO3·2Na2SO4 |
|
|
24,13 |
6,24 |
69,63 |
Na2CO3·2Na2SO4 |
|
|
20,65 |
8,97 |
70,38 |
-"- |
|
|
17,62 |
11,45 |
70,93 |
-"- |
|
|
13,52 |
15,04 |
71,44 |
-"- |
|
|
10,21 |
18,41 |
71,38 |
-"- |
|
|
3,48 |
26,49 |
70,03 |
-"- |
|
R4 |
- |
32,78 |
67,22 |
-"- |
|
|
Точки |
на нодах в системе NaCl – Na2CO3·2Na2SO4 – H2O |
|||
q1 |
39,08 |
4,92 |
56,00 |
NaCl |
|
q4 |
43,37 |
4,63 |
52,00 |
-"- |
|
q2 |
20,42 |
23,58 |
56,00 |
Na2CO3·2Na2SO4 |
|
q3 |
22,57 |
15,64 |
61,79 |
-"- |
|
Тройная система NaCl – Na2CO3·2Na2SO4 – H2O делит четверную систему на две самостоятельные простые четверные системы NaCl –
Na2CO3·2Na2SO4 – Na2SO4 – H2O и NaCl – Na2CO3·2Na2SO4 – Na2CO3 – H2O,
каждая из которых имеет простой эвтонический тип и может изучаться, изображаться, анализироваться и использоваться самостоятельно.
Применение статистического метода главных компонент к табл. 16. 14 показывает, что неплоскостность составов растворов, находящихся в нон- и моновариантных равновесиях с твердыми фазами в системе NaCl – Na2CO3·2Na2SO4 – Na2SO4 – H2O при 50°С составляет 0,5 % отн. В системе NaCl – Na2CO3·2Na2SO4 – Na2CO3 – H2O при 50°С неплоскостность этих составов жидких фаз равна 0,7 % отн. Полученные результаты подтверждают распространение коллигативного свойства многократно насыщен-
228
ных растворов на системы с образованием конгруэнтно растворимых химических соединений.
Таблица 16. 13 Составы на гранях нонвариантной области системы
NaCl – Na2CO3· – Na2SO4 – H2O при 50°С
Точка |
|
|
Состав реперной т.,% мас. |
Донная фаза |
|||||||
NaCl |
|
Brk |
|
Na2SO4 |
|
H2O |
|||||
|
|
Система NaCl – Na2CO3·2Na2SO4(Brk) – Na2SO4 – H2O |
|||||||||
t1 |
28,20 |
|
6,62 |
6,18 |
|
59,00 |
NaCl + Na2SO4 |
||||
t2 |
26,22 |
|
6,55 |
8,23 |
|
59,00 |
-"- |
||||
t3 |
24,22 |
|
6,55 |
10,23 |
|
59,00 |
-"- |
||||
t4 |
25,90 |
|
15,08 |
0,02 |
|
59,00 |
NaCl + Brk |
||||
t5 |
23,24 |
|
17,51 |
0,25 |
|
59,00 |
-"- |
||||
t6 |
20,43 |
|
20,57 |
0,00 |
|
59,00 |
-"- |
||||
t7 |
19,82 |
|
15,17 |
6,01 |
|
59,00 |
Na2SO4 + Brk |
||||
t8 |
19,82 |
|
20,38 |
0,80 |
|
59,00 |
-"- |
||||
Точка |
|
|
Состав реперной т.,% мас. |
Донная фаза |
|||||||
NaCl |
|
Brk |
|
Na2CO3·H2O |
H2O |
||||||
|
Система NaCl – Na2CO3·2Na2SO4(Brk) – Na2CO3·H2O – H2O |
||||||||||
q1 |
23,35 |
|
1,58 |
18,80 |
|
56,27 |
NaCl + Na2CO3·H2O |
||||
q2 |
24,60 |
|
1,58 |
17,34 |
|
56,48 |
- " - |
||||
q3 |
25,85 |
|
1,58 |
15,88 |
|
56,70 |
- " - |
||||
q4 |
25,22 |
|
4,23 |
13,51 |
|
57,04 |
NaCl+Brk |
||||
q5 |
21,08 |
|
8,45 |
13,42 |
|
57,05 |
- " - |
||||
q6 |
20,44 |
|
9,01 |
13,51 |
|
57,04 |
- “ - |
||||
q7 |
15,53 |
|
12,32 |
15,39 |
|
56,77 |
Brk + Na2CO3·H2O |
||||
q8 |
15,28 |
|
8,45 |
20,21 |
|
56,07 |
- " - |
||||
q9 |
15,15 |
|
4,23 |
25,29 |
|
55,33 |
- “ - |
||||
|
|
|
|
|
|
|
|
|
|
|
Таблица 16. 14 |
Фазовые равновесия в системе NaCl – Na2CO3 – Na2SO4 – H2O при 50°С |
|||||||||||
Точка |
|
Состав жидкой фазы, % мас. |
|
Донная фаза |
|||||||
|
Na2CO3 |
|
NaCl |
|
Na2SO4 |
H2O |
|
||||
e24 |
|
1,66 |
|
25,11 |
|
4,43 |
68,80 |
|
NaCl + Brk |
||
E1 |
|
13,63 |
|
17,81 |
|
1,33 |
67,23 |
|
NaCl+Brk+Na2CO3·H2O |
||
e14 |
|
29,77 |
|
- |
|
3,99 |
66,24 |
|
Brk+Na2CO3·H2O |
||
e12 |
|
14,3 |
|
18,1 |
|
- |
67,6 |
|
NaCl+Na2CO3·H2O |
||
e34 |
|
8,42 |
|
- |
|
24,77 |
66,81 |
|
Na2SO4+Brk |
||
|
|
6,25 |
|
4,45 |
|
19,55 |
69,75 |
|
- " - |
||
|
|
4,76 |
|
10,48 |
|
14,64 |
70,12 |
|
- " - |
||
E2 |
|
2,09 |
|
23,19 |
|
5,70 |
69,02 |
|
Na2SO4+Brk+NaCl |
||
e23 |
|
- |
|
24,2 |
|
5,3 |
70,5 |
|
Na2SO4+NaCl |
||
|
|
|
|
|
|
|
|
229 |
|
|
|
16.8. Четверные водно-солевые системы с образованием инконгруэнтно растворимого соединения. Система CO(NH2)2 –
NH4Cl – (NH4)2SO4 –H2O при 25°C
Основной особенностью указанной системы является тот факт, что компоненты системы образуют при растворении в воде диссоциированные и молекулярные растворы. Кроме того, все компоненты являются удобрениями, т.е. изотерма системы имеет и прикладное значение – позволяет определить составы жидких удобрений с максимальным содержанием азота и минимизировать содержание вредного компонента – хлорид-иона.
16.8.1. Оконтуривающая система CO(NH2)2 – (NH4)2SO4 – H2O при 25°C
Экспериментальные данные о фазовых равновесиях в системе CO(NH2)2 – (NH4)2SO4 – H2O при 25°C, выраженные в истинных концентрациях, сведены в табл. 16. 15. Изотерма растворимости имеет простой эвтонический тип с взаимным всаливанием компонентов и кристаллизацией безводных исходных твердых веществ.
Таблица 16. 15 Фазовые равновесия в системе CO(NH2)2 – (NH4)2SO4 – H2O при 25°C
Т. |
Состав, % мас. |
|
Донная фаза |
||
(NH4)2SO4 |
CO(NH2)2 |
H2O |
|||
|
|
||||
|
|
Жидкие |
фазы |
|
|
R1 |
43,46 |
- |
56,54 |
(NH4)2SO4 |
|
a1 |
40,66 |
6,74 |
52,60 |
(NH4)2SO4 |
|
a2 |
37,75 |
13,23 |
49,02 |
(NH4)2SO4 |
|
a3 |
33,20 |
23,25 |
43,55 |
(NH4)2SO4 |
|
a4 |
29,98 |
30,83 |
39,19 |
(NH4)2SO4 |
|
е12 |
24,98 |
42,22 |
32,80 |
(NH4)2SO4+CO(NH2)2 |
|
b3 |
18,19 |
43,93 |
37,88 |
CO(NH2)2 |
|
b2 |
11,23 |
46,05 |
42,72 |
CO(NH2)2 |
|
b1 |
4,50 |
50,11 |
45,39 |
CO(NH2)2 |
|
R2 |
- |
54,40 |
45,60 |
CO(NH2)2 |
|
|
Реперные т. на предельных нодах |
||||
a |
35,78 |
36,11 |
28,11 |
(NH4)2SO4 |
|
d |
54,21 |
25,79 |
20,00 |
- " - |
|
b |
21,45 |
50,44 |
28,11 |
CO(NH2)2 |
|
c |
15,20 |
64,80 |
20,00 |
- " - |
|
16.8.2. Оконтуривающая система (NH2)2SO4 – NH4Cl – H2O
Экспериментальные данные о фазовых равновесиях в системе (NH4)2SO4 – NH4Cl – H2O при 25°C, выраженные в истинных концентрациях, сведены в табл. 16. 16. Изотерма растворимости имеет простой эвтонический тип с взаимным высаливанием компонентов и кристаллизацией безводных исходных солей.
230
