
Posob_2012_Ok
.pdf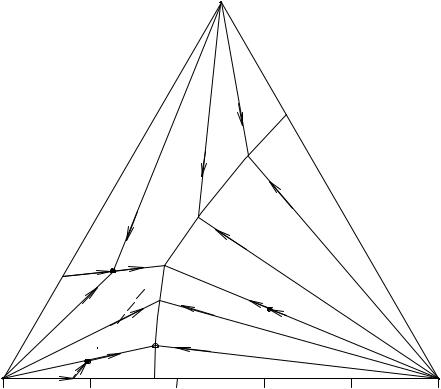
Четвертый способ кристаллизации характерен для тройного эвтонического раствора (точка Е'). В этом случае отсутствует первичная и вторичная кристаллизации. Состав раствора и суммарный состав твердой фазы до полного затвердевания находятся в т. Е'.
Из других предложенных методов изображения диаграмм растворимости трех нереагирующих между собою солей в одном растворителе укажем метод Енеке. Изотермическая диаграмма растворимости трех солей с общим ионом строится следующим образом. Состав солевой массы наносят на треугольник Гиббса-Розебома, принимая сумму солей за 100, строят перпендикуляры к плоскости этого треугольника и откладывают на них содержание воды в определенном количестве раствора или количество воды, приходящееся в нем на определенное количество солевой массы. Получается пространственная диаграмма в виде призмы, аналогичная диаграмме состояния тройных систем плавкости. Входящую в ее состав изотермическую поверхность растворимости можно ортогонально спроецировать на плоскость концентрационного треугольника; соединяя линией т., отвечающие одинаковому содержанию воды, получают "изогидры" (см. выше).
C
E2'
E3' O 
 E'
E'
N
M

 M1
M1
A M2 |
E1' |
B |
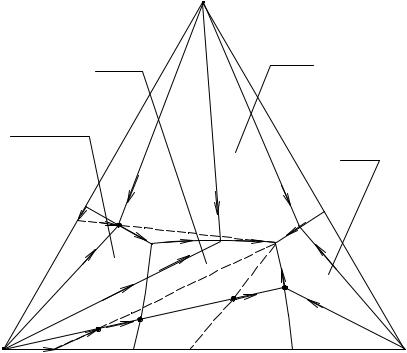
Рис. 16. 6. Перспективная проекция диаграммы растворимости четверной системы простого эвтонического типа
201
16.4. Принципиальная схема изотермы и изобары растворимости трех твердых веществ в одном растворителе с образованием кристаллогидратов или двойных солей
Если одно, два или все три вещества образуют гидраты только одного состава и на всех стадиях испарения не происходит обезвоживания, то перспективная проекция изотермы растворимости будет иметь тот же вид, что и в случае выделения безводных веществ. При этом полюсами соответствующих полей будут служить фигуративные т. безводных компонентов: эти т. являются проекциями всех соответствующих кристаллогидратов и насыщенных относительно них растворов.
Если мы пользуемся ортогональной проекцией, то дело обстоит иначе: каждому гидрату будет отвечать своя проекция полюса; при этом, конечно, проекции полюсов всех гидратов данного вещества будут лежать на проекции соответствующего ребра.
Предположим теперь, что один из компонентов, например А, образует гидрат A·nH2O, причем по достижению известных концентраций одного вещества (В) раствор обезвоживает этот кристаллогидрат и переводит его в кристаллы чистого А. Тогда на перспективной проекции (см. рис. 2. 7), согласно принципу соответствия, мы должны иметь поле гидрата A·nH2O и поле безводного вещества А.
На рис. 16. 7 изображена схема такой центральной проекции; на ней ApPe3 - поле гидрата A·nH2O, pPEe1 - поле кристаллизации безводного А, Ce2EPe3 - поле C, Be1Ee2 - поле В. Кристаллизация в поле безводного А является продолжением тех же путей в поле гидрата, так как проекция полюсов этих полей совпадает (точка А).
Проследим для примера испарение раствора, заданного т. М. Пока происходит испарение растворителя из насыщенного раствора, проекция фигуративной т. последнего находится в т. М, так как в это время фигуративная точка раствора движется по лучу, соединяющему исходную точку с вершиной тетраэдра D, а этот луч как раз и является проектирующим. При изображении диаграммы в ортогональной проекции дело обстоит сложнее: на ней процессу испарения растворителя без выделения растворенного вещества будет отвечать прямолинейный отрезок.
Первым начинает кристаллизоваться гидрат A·nH2O, причем фигуративная точка раствора движется (рис. 16. 7) от М к p1. По достижении т. p1 раствор начинает обезвоживать этот гидрат; таким образом, раствор, гидрат A·nH2O и безводный компонент А будут находиться в равновесии, и, пока весь гидрат не будет обезвожен, фигуративная точка раствора не сойдет со своего положения (точка p1). Когда же последние кристаллики гидрата исчезнут, фигуративная точка раствора сойдет с места и будет двигаться по тому же лучу кристаллизации, но уже в поле безводного А, уда-
202
ляясь от т. p1 и приближаясь к т. М1. Суммарный солевой состав твердой фазы в это время находится в т. А.
|
|
|
C |
|
|
L+A |
L+C |
|
|
|
|
|
||
L+A·nH2O |
|
|
|
L+B |
|
|
|
|
|
e3 |
|
O |
|
e2 |
O2 |
|
E |
|
|
|
|
|
||
|
|
P |
|
|
|
|
|
|
|
|
|
|
M1 |
|
M |
p1 |
N |
|
|
|
|
|||
|
|
|
|
|
A M2 |
|
p N2 |
e1 |
B |
Рис. 16. 7. Перспективная проекция диаграммы растворимости четверной системы с образованием обезвоживающегося кристаллогидрата
По достижении т. М1 начнется совместное выделение А и B, фигуративная точка раствора пойдет по линии е1Е от М1 к Е, а суммарный состав выделившейся твердой фазы - от А к М2.
В последней т. Е происходит окончательное высыхание раствора, причем выделяются совместно А, В и С эвтонического соотношения, точка твердой фазы при этом перемещается от т. М2 до т. М.
Исходный раствор N находится в поле кристаллизации безводного компонента А на том же луче кристаллизации, что и точка М. При испарении этого раствора кристаллизоваться начнет сразу безводный А, солевой состав насыщенного раствора будет изменяться по прямой от т. N до М1. В т. М1 совместно с А начинает кристаллизоваться компонент В, система становится моновариантной, состав насыщенного раствора изменяется по линии двойного насыщения e1E от т. М1 до Е, суммарный состав твердой
фазы - от т. А до N2.
В т. Е происходит кристаллизация эвтонической смеси кристаллов А, В и С, система в это время является нонвариантной, состав насыщенного раствора остается постоянным, точка твердой фазы перемещается по прямой от т. N2 до N.
203
Если исходный раствор задан т. О, то при изотермическом испарении начинается сразу совместная кристаллизация A·nH2O и С, солевой состав насыщенного раствора меняется по линии e3Р от т. О до т. Р, суммарный солевой состав твердой фазы остается приблизительно неизменным и отвечает т. e3.
Вт. Р начинает протекать условно нонвариантная перитоническая реакция: P(L)+ A·nH2O(S) → A(S) + C(S) (жидкость состава Р взаимодействует
ствердым кристаллогидратом с образованием смеси кристаллов компонентов А и С). Реакция протекает до исчерпания кристаллогидрата, после чего раствор меняется по линии РЕ от одной т. до другой, а суммарный состав твердой фазы - по прямой от т. e3 до О2.
Вт. Е происходит кристаллизация эвтонической смеси кристаллов А, В и С, система в это время является нонвариантной, состав насыщенного раствора остается постоянным, точка твердой фазы перемещается по
прямой от т. О2 до О.
Решить вопрос о конгруэнтном характере т. Е и инконгруэнтном Р можно так же, как и при изучении диаграмм плавкости тройных систем. Так, в т. Е мы имеем раствор в равновесии с тремя твердыми фазами А, В и С; точка Е попадает в треугольник АВС - значит, процесс конгруэнтный. В
т. Р раствор находится в равновесии с твердыми фазами A·nH2O, А и С. Треугольник, образованный фигуративными точками этих фаз, на солевой проекции вырожден в отрезок АС, так как А является одновременно фигу-
ративной точкой вещества А и проекцией A·nH2O. Точка Р оказывается вне этого отрезка - вырожденного треугольника, и процесс является инконгруэнтным.
Рассмотрим теперь случай, когда два вещества А и В дают соединение V (например, две соли образуют двойную соль). Это соединение может растворяться конгруэнтно или инконгруэнтно. На рис.2.8. изображена центральная проекция изотермической диаграммы растворимости в четверной системе, образованной тремя веществами А, В, С и растворителем D, когда вещества А и В образуют соединения V, растворяющееся конгруэнтно. В этом случае точка, отвечающая насыщенному раствору соединения V (а по свойству центральной проекции - и самому этому соединению), лежит в
его поле е1Е1Е2е2 (на ребре АВ). Соединительная линия СV делит в этом случае проекцию диаграммы А – В – С на два треугольника АСV и ВСV, отвечающих системам А – С – V – D и B – C – V – D. Каждая из полученных вторичных диаграмм А – V – С и В – V – С вполне аналогична диаграмме для того случая, когда растворимые вещества не образуют соединения (рис. 16. 6).
На рис. 16.8. изображены пути кристаллизации во всех полях нашей системы, причем стрелками указано направление движения фигуративных точек растворов при испарении. На диаграмме имеются две эвтоники Е1 и
204
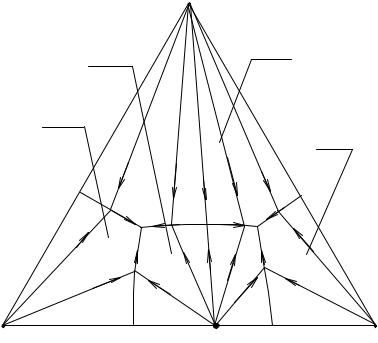
Е2, в которых происходит окончательное испарение раствора: в зависимости от положения фигуративной т. исходного раствора (в треугольнике АVС или треугольнике ВVС) испарение оканчивается в той или другой эвтонике. Кроме этих нонвариантных точек имеется еще третья - эвтоническая точка F тройной системы, образованной веществами V, С и растворителем D.
На рис. 16. 9 представлена принципиальная схема изотермической диаграммы растворимости A – B – C – D с образованием инконгруэнтно растворимого химического соединения V в тройной оконтуривающей системе А – В – D.
В этом случае точка, отвечающая составу соединения V, лежит вне его поля pPЕе1 (на ребре АВ). Соединительная линия СV делит проекцию диаграммы А – В – С – D на два треугольника АСV и ВСV, отвечающих квазичетверным системам А – С – V – D и B – C – V – D. Эти четверные системы не являются изотермами простого эвтонического типа, что и подчеркивается в их названии.
C
L+V |
L+C |
|
L+A
L+B
e4 |
e3 |
E1 |
F E2 |
A |
e1 |
V |
e2 |
B |
Рис. 16. 8. Перспективная проекция диаграммы растворимости четверной системы с образованием конгруэнтно растворимого химического соединения
На диаграмме также представлены Ae3Pp – поле кристаллизации компонента А, Be1Ee2 – поле кристаллизации В, Ce3PEe2 – поле кристаллизации компонента С, e3P – линия двойного насыщения относительно компонентов А и С, РЕ - линия двойного насыщения относительно С и V, e2E - линия двойного насыщения относительно В и С, e1E - линия двойного на-
205
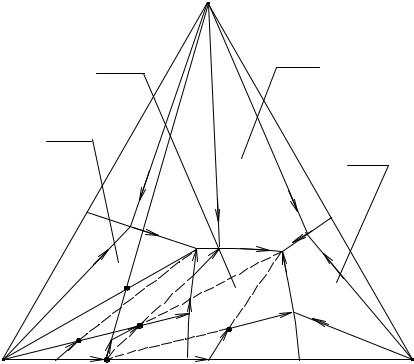
сыщения относительно В и V, pP - линия моновариантного инконгруэнтного превращения кристаллов компонента А в химическое соединение V, Е - конгруэнтная точка тройной кристаллизации компонентов V, В и С, Р - инконгруэнтная точка нонвариантного превращения кристаллов А в смесь V и С через жидкую фазу Р.
Изотермическое испарение растворов, лежащих в квазичетверной системе А – С – V – D, всегда заканчивается в т. Р, а в системе В – С – V – D – в т. Е.
Исходный раствор О находится в поле кристаллизации химического соединения V, а также в треугольнике ВСV, т.е. в системе В – С – V – D. При испарении этого раствора кристаллизация начнется с химического соединения V, солевой состав насыщенного раствора будет изменяться по прямой VО1 от т. О до О1. В т. О1 совместно с V начинает кристаллизоваться компонент В, система становится моновариантной, состав насыщенного раствора изменяется по линии двойного насыщения e1E от т. О1 до Е, суммарный состав твердой фазы – от т. V до О2.
|
C |
|
|
L+V |
|
L+C |
|
|
|
|
|
L+A |
|
|
|
|
|
|
L+B |
e3 |
|
|
e2 |
|
P N2 |
E |
|
F |
N1 |
O1 |
|
N |
M1 |
|
|
|
|
||
M N3 |
O |
|
|
A M2 V |
p O2 |
e1 |
B |
Рис. 16. 9. Перспективная проекция диаграммы растворимости четверной системы с образованием инконгруэнтно растворимого химического соединения
В т. Е происходит кристаллизация эвтонической смеси кристаллов V, В и С, система в это время является нонвариантной, состав насыщенного раствора остается постоянным, точка твердой фазы перемещается по
206
прямой от т. О2 до О и, когда суммарный состав твердой фазы попадает в точку О, исчезает последняя капля эвтонического раствора.
Исходный раствор M находится в поле кристаллизации безводного компонента А, а также в треугольнике AСV, т.е. в системе A – С – V – D. При испарении этого раствора кристаллизоваться начинает компонент А, солевой состав насыщенного раствора будет изменяться по прямой от т. М до М1, точка твердой фазы в это время находится в А.
Вт. М1 начинает протекать условно моновариантная перитоническая реакция: L + A(S) → V(S) (жидкость взаимодействует с кристаллами А с образованием кристаллов химического соединения), состав жидкой фазы
при этом меняется по кривой рР от т. М1 до т. Р, а суммарный состав твердой фазы меняется по прямой от А до М2.
Вт. P заканчивается изменение жидкой фазы в процессе изотермического испарения нонвариантной инконгруэнтной перитонической фазо-
вой реакцией: P(L)+ A (S) → V(S) + C(S) (жидкость состава Р взаимодействует с кристаллами А с образованием смеси кристаллов компонентов V и C), состав жидкой фазы при этом остается постоянным (Р), а точка твердой фазы перемещается по прямой от т. М2 до М.
Исходный раствор N находится в поле кристаллизации компонента А на том же луче кристаллизации, что и точка М, но в треугольнике ВСV, т.е. в системе В - С - V - D. При испарении этого раствора кристаллизоваться начинает компонент А, солевой состав насыщенного раствора будет изменяться по прямой от т. N до М1, точка твердой фазы в это время находится в А.
Вт. М1 начинает протекать условно моновариантная перитоническая реакция: L + A(S) → V(S) (жидкость взаимодействует с кристаллами А с образованием кристаллов химического соединения), состав жидкой фазы
при этом меняется по кривой рР от т. М1 до т. N1, а суммарный состав твердой фазы меняется по прямой от А до V.
После превращения последнего кристалла А в химическое соединение система вновь становится дивариантной, при дальнейшем испарении
солевой состав жидкой фазы изменяется по лучу VN2 от т. N1 до N2, точка твердой фазы при этом остается в V.
Вт. N2 раствор становится двояконасыщенным и из него выделяется смесь кристаллов компонентов V и С. Состав жидкой фазы меняется по кривой РЕ от т. N2 до Е, суммарный состав твердой фазы - по прямой от V
до N3.
В т. Е заканчивается изменение состава жидкой фазы, происходит совместная кристаллизация компонентов V, C и В. Точка твердой фазы при этом двигается по прямой от т. N3 до N.
207

16.5. Четверные водно-солевые системы образующиеся при триангуляции четверных взаимных систем по стабильной диагонали.
Система NH4H2PO4 – NH4Cl – (C2H5)2NH2Cl – H2O при 25°С
Система NH4Cl - NH4H2PO4 - (C2H5)2NH2Cl - H2O является таким примером, образуется при триангуляции четверной взаимной системы NH4+, (C2H5)2NH2+ // H2PO4-, Cl- – H2O при 25°С по стабильной диагонали (см. ниже) и позволяет определить оптимальные концентрационные условия получения дигидрофосфата аммония из хлорида аммония, фосфорной кислоты и диэтиламина при эквимолярных соотношениях исходных компонентов и избытке хлорида аммония.
16.5.1. Оконтуривающая система NH4Cl - NH4H2PO4 - Н2О.
Изотерма растворимости тройной оконтуривающей системы NH4Cl
– NH4H2PO4 – Н2О при 25°С изображена на рис. 16. 10, справочные данные сведены в табл. 16. 1. Состав двойного эвтонического раствора определен экспериментально (% мас.): 0,09 – H3PO4; 26,22 – NH4Cl; 5,23 – NH4H2PO4; 68,46 – H2O; 1,105 г/см3 – плотность.
Таблица 16. 1 Растворимость в системе NH4Cl - NH4H2PO4 - Н2О при 25°С
Состав насыщенного раствора, % мас. |
Донная фаза |
|||
NH4Cl |
NH4H2PO4 |
H2O |
||
|
||||
0,0 |
29,2 |
70,8 |
NH4H2PO4 |
|
3,91 |
21,7 |
74,39 |
- " - |
|
8,38 |
16,2 |
75,42 |
- " - |
|
14,22 |
11,1 |
74,68 |
- " - |
|
18,38 |
8,1 |
73,52 |
- " - |
|
23,48 |
6,1 |
70,42 |
- " - |
|
26,22 |
5,32* |
68,46 |
NH4H2PO4+ NH4Cl |
|
28,2 |
0,0 |
71,8 |
NH4Cl |
|
*– включено 0,09% H3PO4
16.5.2.Оконтуривающая система NH4Cl - (C2H5)2NH2Cl - Н2О
Изотерма растворимости тройной оконтуривающей системы NH4Cl - NH4H2PO4 - Н2О при 25°С изображена на рис. 16. 10 и приведена в табл. 16. 2. Состав двойного эвтонического раствора (% мас.): 3,21 – NH4Cl; 66,56 – (C2H5)2NH2Cl; 30,23– H2O; 1,006 г/см3 – плотность.
16.5.3. Оконтуривающая система NH4H2PO4 - (C2H5)2NH2Cl - Н2О
Изотерма растворимости тройной оконтуривающей системы
NH4H2PO4 - (C2H5)2NH2Cl - H2O при 25°С представлена в табл. 16. 3. и изо-
бражена на рис. 16. 10 в виде комбинированной проекции. На этой проекции содержание фосфорной кислоты в составах насыщенных растворов не отображено, но прибавлено к значению дигидрофосфата аммония. Таким
208
образом, на данной проекции не искажено лишь содержание воды в насыщенных растрах, а система имеет признаки "некорректности".
Таблица 16. 2 Растворимость в системе NH4Cl - (C2H5)2NH2Cl - Н2О при 25°С
Состав насыщенного раствора, % мас. |
Твердая фаза |
|||
NH4Cl |
Et2NH2Cl |
H2O |
||
|
||||
28,2 |
- |
71,8 |
NH4Cl |
|
19,5 |
16,6 |
63,9 |
-"- |
|
12,1 |
33,7 |
54,2 |
-"- |
|
6,5 |
50,2 |
43,3 |
-"- |
|
3,2 |
66,6 |
30,2 |
NH4Cl + (C2H5)2NH2Cl |
|
- |
69,7 |
30,3 |
(C2H5)2NH2Cl |
|
|
|
|
|
Таблица 16. 3 |
|
Растворимость в системе NH4H2PO4 - (C2H5)2NH2Cl - H2O при 25°С |
|||||
Состав насыщенного раствора, % мас |
Твёрдая фаза |
||||
H3PO4 |
(C2H5)2NH2Cl |
NH4H2PO4 |
H2O |
||
|
|||||
0,33 |
|
28,31 |
71,36 |
NH4H2PO4 |
|
1,16 |
16,21 |
16,13 |
66,50 |
- " - |
|
0,49 |
32,97 |
8,40 |
58,14 |
- " - |
|
0,05 |
45,42 |
5,10 |
49,43 |
- " - |
|
0,05 |
58,68 |
3,16 |
38,11 |
- " - |
|
0,00 |
67,49 |
2,45 |
30,06 |
(C2H5)2NH2Cl +NH4H2PO4 |
|
0,00 |
67,42 |
2,39 |
30,19 |
- " - |
|
- |
69,7 |
- |
30,3 |
(C2H5)2NH2Cl |
|
Изотерма растворимости системы NH4H2PO4 – (C2H5)2NH2Cl – H2O имеет простой эвтонический тип с явлением высаливания дигидрофосфата аммония. На изотерме выявлены: поле ненасыщенных растворов; поле кристаллизации дигидрофосфата аммония; слабо развитое поле кристаллизации хлорида диэтиламмония; поле совместной кристаллизации обеих солей.
Простой эвтонический тип изотермы растворимости свидетельствует о том, что четверная взаимная система NH4+, (C2H5)2NH2+ // H2PO4–, Cl– – H2O имеет стабильную диагональ.
16.5.4. Система NH4H2PO4 – NH4Cl – (C2H5)2NH2Cl – H2O
Данные о растворимости в четверной системе NH4H2PO4 –
(C2H5)2NH2Cl – NH4Cl – H2O при 25°С изображена на рис. 6. 10-11 в виде комбинированной ортогональной и перспективной проекции соответственно, а фактические данные сведены в табл. 16. 4. На этой проекции содержание фосфорной кислоты в составах насыщенных растворов не отображено, но прибавлено к значению дигидрофосфата аммония. Таким образом, данная система имеет признаки "некорректности".
209
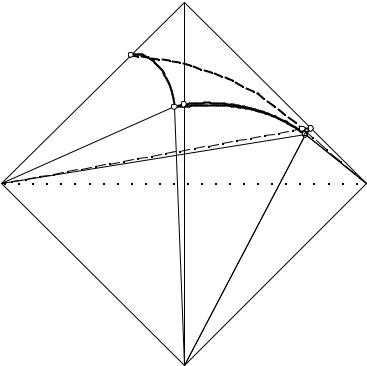
Изотерма растворимости системы NH4H2PO4 – NH4Cl – (C2H5)2NH2Cl – H2O при 25 °С имеет простой эвтонический тип с явлением высаливания дигидрофосфата и хлорида аммония.
H2O
R1
E1 |
E2R |
R2 |
|
|
3 |
E E |
3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
NH4H2PO4 |
|
Et2NH2Cl |
|||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
NH4Cl
Рис. 16. 10. Комбинированная проекция системы
NH4H2PO4 – NH4Cl – (C2H5)2NH2Cl – H2O при 25 °С
На изотерме растворимости четверной системы выявлены поля кристаллизации всех трех слагающих систему солей. Поле кристаллизации хлорида диэтиламмония развито наиболее слабо, что свидетельствует о высаливающем действии этой соли на остальные солевые компоненты системы.
Линия двойного насыщения относительно хлорида и дигидрофосфата аммония является наиболее протяженной и имеет S-образный характер, что говорит о сложном взаимодействии солевых компонентов системы.
Диагональные разрезы четверных взаимных систем имеют большое практическое значение, так как позволяют рассчитывать максимальные выходы наименее растворимой соли в твердую фазу при любом стехиометрическом соотношении исходных компонентов (см. ниже).
Необходимо отметить, что статистическая обработка экспериментальных данных табл. 16. 4 методом главных компонент показывает их расположение вблизи одной плоскости. Мера неплоскостности (отклонения от плоскости) составов жидких фаз, выраженных в % мас., находящих-
210
