
Posob_2012_Ok
.pdf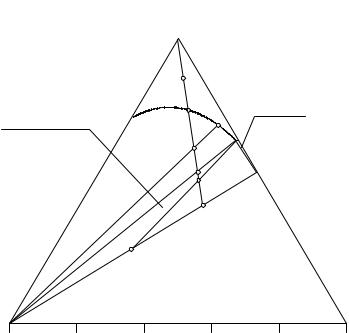
На изотерме имеются поле ненасыщенных растворов (H2O-R1-1-G'- E-R2-H2O), поле кристаллизации безводного хлорида натрия (NaCl-R1-1-G'- E-NaCl), поле кристаллизации шестиводного гидрата хлорида магния (MgCl2·6Н2О-R2-Е-MgCl2·6Н2О), трехфазная область совместного существования эвтонического раствора Е и кристаллов водной и безводной соли
(NaCl-Е-MgCl2·6Н2О-NaCl).
|
|
|
|
H2O |
|
|
|
|
|
|
L F |
|
|
NaCl+MgCl ·6H O+L |
R |
1 |
MgCl2·6H2O+L |
|||
1 |
|
|
|
|||
2 |
2 |
E |
G' |
R2 |
|
|
|
|
|
|
|
||
|
|
|
NaCl+LG 2 |
E MgCl2·6H2O |
||
|
|
|
|
H |
|
|
|
|
|
|
3 |
|
|
|
|
|
H' |
|
|
|
|
|
|
NaCl+MgCl2·6H2O+MgCl2 |
|
||
0 |
20 |
|
40 |
60 |
80 |
100 |
NaCl |
|
|
% мас. |
|
MgCl2 |
|
Рис. 12. 2. Система NaCl - MgCl2 - H2O при 25°C |
||||||
Прямая NaCl-MgCl2·6Н2О является линией солидуса системы. Все составы ИСК, находящиеся в области (NaCl-MgCl2·6Н2О-MgCl2 не могут иметь жидкой фазы, равновесие при их термостатировании не будет устанавливаться в разумные сроки. Эта часть диаграммы состава не имеет фи- зико-химического смысла.
Рассмотрим подробнее, как протекает процесс изотермического испарения исходной смеси F. Он протекает при постоянной температуре, в исходной смеси непрерывно в равновесных условиях уменьшается содержание воды, а соотношение солей остается неизменным. Следовательно, состав исходной смеси будет смещаться по лучу, исходящему из вершины треугольника состава, отвечающей воде, проходящему через состав исходной смеси до пересечения с линией солидуса.
На участке F - 1 луча испарения состав исходной смеси находится в поле ненасыщенных растворов и будет совпадать с составом раствора. В точке 1 раствор становится насыщенным, и при дальнейшем испарении воды появляются кристаллы хлорида натрия.
121
На участке изотермического испарения 1 - 2 в равновесии находятся кристаллы хлорида натрия с насыщенным относительно этой соли раствором, состав которого изменяется по ветви кристаллизации хлорида натрия (R1-1-G'-E) от точки 1 до точки Е, суммарный состав твердой фазы отвечает хлориду натрия. Равновесие является моновариантным. Равновесный состав жидкой фазы, а также соотношение жидкой и твердой фазы определяются по правилу рычага. Например, смесь G распадается на твердый хлорид натрия и раствор состава G'.
В точке 2 равновесная жидкая фаза становится двояконасыщенной, начинает кристаллизоваться совместно с хлоридом натрия шестиводный хлорид магния. Поскольку в изобарно-изотермических условиях в равновесии находятся три фазы, две твердые и жидкая, то оно является нонвариантным.
На участке изотермического испарения 2 - 3 исходные смеси находятся в трехфазной области системы, составы равновесных фаз остаются постоянными, две твердые фазы представляют собой чистые соли (хлорид натрия и шестиводный хлорид магния) и жидкая фаза - двояконасыщенный эвтонический раствор. В процессе изотермического испарения на этом участке меняется соотношение твердых фаз, и суммарный состав твердой фазы изменяется от чистого хлорида натрия до точки 3 по конноде NaCl - MgCl2·6H2O. В момент, когда суммарный состав твердой фазы приходит в точку 3, исчезает последняя капля двойного эвтонического раствора (Е).
Равновесное соотношение твердых фаз и количества фаз определяются по правилу рычага. Например, точка Н распадается на смесь хлорида натрия и шестиводного хлорида магния состава Н' и жидкую фазу состава Е, длина плеча Н'-Н пропорциональна массе эвтонического раствора, а плеча Н-Е - массе твердой фазы. В точке 3 заканчивается процесс изотермического испарения исходной смеси F.
12.3.Диаграммы растворимости тройных водно-солевых систем
собразованием неустойчивых кристаллогидратов
На рис. 12. 3 представлена изотерма растворимости системы LiCl - SrCl2 - H2O при 25°С, иллюстрирующая случай, когда кристаллогидрат обезвоживается в присутствии второй соли, образующей устойчивый кристаллогидрат.
В системах такого типа кроме ветви растворов, насыщенных гидратом с большим содержанием воды, имеется ветвь или ветви растворов, насыщенных относительно гидрата или гидратов с меньшим содержанием воды (вплоть до безводной соли).
Ветвь R1-Е отображает моновариантное двухфазное равновесие кристаллов LiCl·H2O и насыщенного раствора, ветвь R2-1-P – моновариантное двухфазное равновесие кристаллов SrCl2·6H2O и насыщенного рас-
122
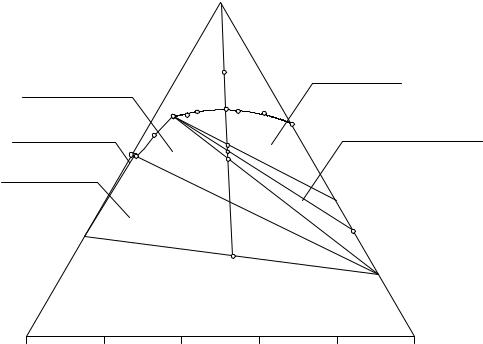
твора, ветвь P-Е – моновариантное двухфазное равновесие кристаллов SrCl2·2H2O и насыщенного раствора.
H2O
SrCl2·2H2O+L
LiCl·H2O+L
R1 
LiCl·H2O+SrCl2·2H2O+LE E
L F |
SrCl2·6H2O+L |
P |
1 |
R2 SrCl ·6H O+SrCl ·2H O+L |
|
|||
|
|
|||||
|
2 |
P |
||||
|
2 |
2 |
2 |
2 |
||
|
3 G |
|
|
|
|
|
4 SrCl2·6H2O
SrCl2·6H2O
LiCl·H2O |
5 |
G' |
|
|
SrCl2·2H2O
0 |
20 |
40 |
60 |
80 |
100 |
LiCl |
|
|
% мас. |
|
SrCl2 |
Рис. 12. 3. Система LiCl - SrCl2 - H2O при 25°С
Точка Р является нонвариантной, так как раствор этого состава находится в равновесии с двумя типами кристаллов - шестиводного и двуводного хлорида стронция (В = 3-3+0). Кроме того эта точка называется переходной, поскольку при изотермическом испарении смесей, лежащих в трехфазной области SrCl2·2H2O-Р-SrCl2·6H2O, идет инконгруэнтный процесс обезвоживания кристаллогидрата, имеющегося в исходной реакционной смеси, до тех пор пока его запас не будет исчерпан. Во время протекания этого процесса состав насыщенного раствора остается постоянным и отвечает точке Р, а после исчезновения кристаллов шестиводного гидрата насыщенный раствор вновь становится моновариантным.
Точка Е - эвтоническая, отвечает нонвариантному конгруэнтному трехфазному процессу, равновесию кристаллов LiCl·H2O и SrCl2·2H2O с насыщенным относительно них двойным эвтоническим раствором. Таким образом, в системе имеется три поля кристаллизации солей: SrCl2·6H2O; SrCl2·2H2O; LiCl·H2O, два поля трехфазных равновесий: SrCl2·6H2O + SrCl2·2H2O + LP и SrCl2·2H2O + LiCl·H2O + LE, а также дивариантное поле ненасыщенных растворов.
Рассмотрим подробнее, как протекает процесс изотермического испарения исходной смеси F.
123
На участке F - 1 луча изотермического испарения состав фигуративной точки будет совпадать с составом раствора. После пересечения ветви насыщенных растворов в точке 1 образующиеся системы будут распадаться на две равновесные фазы - твердую, представляющую собой шестиводный кристаллогидрат хлорида стронция, и жидкую, состав которой лежит на отрезке 1-Р ветви кристаллизации шестиводной соли. Суммарный состав твердой фазы отвечает шестиводному хлориду стронция.
После пересечения предельной ноды SrCl2·6H2O - Р в точке 2 до пересечения предельной ноды SrCl2·2H2O - Р в точке 3 исходная смесь распадается на три фазы - насыщенный раствор, отвечающий составу точки Р, и кристаллы SrCl2·6H2O, SrCl2·2H2O. Состав равновесной твердой фазы определяется по правилу рычага (точка G имеет равновесную твердую фазу, состав которой отвечает точке G', рис.2 10). Суммарный состав твердой фазы на этом участке изотермического испарения изменяется от шестиводного хлорида стронция до двуводного хлорида стронция.
На участке луча испарения 3 - 4 образующиеся смеси распадаются на две фазы - твердую, представляющую собой кристаллы двуводного хлорида стронция, и жидкую, составы которой лежат на линии РЕ. После пересечения предельной ноды SrCl2·2H2O - Е в точке 4 исходный состав вновь попадает в трехфазную область диаграммы растворимости. Эти системы распадаются на три фазы - жидкую, состав которой остается постоянным (Е), и две твердые, представляющие собой дигидрат хлорида стронция и моногидрат хлорида лития. Количества фаз определяются по правилу центра тяжести.
12.4. Тройные водно-солевые системы с образованием конгруэнтно растворимых химических соединений
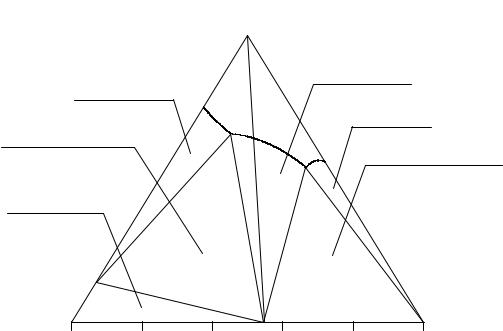
На рис. 12. 4 изображена изотерма растворимости тройной системы Li2SO4 - (NH4)2SO4 - H2O при 30°С с образованием конгруэнтно растворимого химического соединения (насыщенный раствор имеет такое же соотношение ионов, как и исходное вещество).
В случае образования конгруэнтно растворимой двойной соли изотерма растворимости может быть разделена (триангулирована) на две тройные системы: Li2SO4 - LiNH4SO4 - H2O; LiNH4SO4 - (NH4)2SO4 - H2O.
Каждая из этих полученных систем может изучаться самостоятельно, и в нашем случае они представляют собой тройные водно-солевые системы, одна из которых имеет простой эвтонический тип, а другая - с образованием устойчивого кристаллогидрата.
Характерным признаком конгруэнтной растворимости химического соединения является тот факт, что тройные точки системы Е1 и Е2 располагаются по разные стороны от луча, проведенного из вершины воды в состав химического соединения (луч пересекает линию ликвидуса в поле кристаллизации химического соединения, точка R на рис. 2. 11).
124
|
|
H2O |
|
|
|
||
Li2SO4·H2O+L |
L |
|
L+LiNH4SO4 |
||||
|
|
|
|
||||
|
|
R1 |
|
|
L+(NH4)2SO4 |
||
LiNH4SO4+Li2SO4·H2O+E1(L) |
E1 |
R |
|
||||
R2 |
LiNH4SO4+(NH4)2SO4+E2(L) |
||||||
|
|
|
E |
||||
|
|
|
2 |
|
|
|
|
Li2SO4+Li2SO4·H2O+LiNH4SO4 |
|
|
|
|
|
|
|
Li2SO4·H2O |
|
|
|
|
|
|
|
0 |
20 |
LiNH4SO4 |
|
80 |
100 |
||
40 |
60 |
|
|||||
Li2SO4 |
|
% мас. |
|
|
(NH4)2SO4 |
||
Рис. 12. 4. Система Li2SO4 - (NH4)2SO4 - H2O при 30°С |
|||||||
С точки зрения правила фаз система Li2SO4 - (NH4)2SO4 - H2O, которая содержит пять составляющих веществ: Li2SO4; Li2SO4·H2O; LiNH4SO4; (NH4)2SO4; H2O, - является трехкомпонентной. Число независимых компонентов равно количеству всех составляющих веществ системы за вычетом числа химических реакций, их связывающих.
На изотерме растворимости системы кроме поля ненасыщенных растворов имеются поля кристаллизации солей Li2SO4·H2O, LiNH4SO4,
(NH4)2SO4, две трехфазные области: Li2SO4·H2O(S) + LiNH4SO4(S) + E1(L); (NH4)2SO4(S) + LiNH4SO4(S) + E1(L). Область Li2SO4·H2O(S) + LiNH4SO4(S)
+Li2SO4(S) не имеет жидкую фазу и физико-химического смысла. В последней трехфазной области жидкая фаза отсутствует, и системы, находящиеся внутри нее, распадаются согласно правилу центра тяжести на три твердые фазы.
Линия R1 - Е1 отвечает моновариантному равновесию кристаллов Li2SO4·H2O и насыщенного раствора, линия Е1 - Е2 характеризует равновесие кристаллов LiNH4SO4 и насыщенного раствора, а линия R2 - Е2 - кристаллов (NH4)2SO4 и насыщенного раствора. Точки Е1 и Е2 - эвтонические, характеризуют нонвариантные равновесия двух твердых фаз и насыщенных относительно них растворов.
125

|
12.5 Тройные водно-солевые системы с образованием |
|||||||
|
инконгруэнтно растворимых химических соединений |
|||||||
На рис. 12. 5 изображена изотерма растворимости тройной системы |
||||||||
NaHCO3 - Na2CO3 - H2O при 25°С с образованием инконгруэнтно раство- |
||||||||
римого химического соединения, которое называется "трона", имеет состав |
||||||||
NaHCO3·Na2CO3·2H2O и встречается в природе в самородном состоянии. |
||||||||
|
|
|
|
H2O |
|
|
|
|
|
L+NaHCO3 |
R1 |
|
|
|
|
|
|
|
|
L+Tr |
°F |
L |
|
|
|
|
|
|
|
|
|
L+Na2CO3·10H2O |
|
||
|
|
|
|
1 |
|
|
||
|
|
|
|
P |
R2 |
|
|
|
|
|
|
|
|
EL+Tr+Na2CO3·10H2O |
|||
|
|
|
|
|
|
|
||
|
|
|
|
2 |
E |
|
|
|
|
|
|
|
|
|
|
Na2CO3·10H2O |
|
|
|
PL+Tr+NaHCO3 |
|
|
|
|
|
|
|
|
|
|
|
NaHCO3·Na2CO3·2H2O(Tr) |
|
||
0 |
20 |
|
40 (% мас.) 60 |
|
80 |
100 |
||
NaHCO3 |
|
|
|
|
|
Na2CO3 |
||
|
Рис. 12. 5. Система NaHCO3 - Na2CO3 - H2O при 25°С |
|
||||||
С точки зрения правила фаз данная система является трехкомпонентной (пять составляющих систему веществ минус две реакции, их связывающих), но в отличие от систем с конгруэнтно растворимыми соединениями, описанными выше, данная система не может быть разделена на две простые тройные системы.
Характерным признаком инконгруэнтной растворимости химического соединения (см. рис. 12. 5) является тот факт, что тройные точки системы Е и Р располагаются по одну сторону от луча, проведенного из вершины воды в состав химического соединения (луч пересекает линию ликвидуса вне поля кристаллизации химического соединения, точка 1 на рис. 12. 5).
126
Изотерма растворимости имеет поле ненасыщенных растворов (Н2О-R2-Е-Р-1-R1-Н2О), поле кристаллизации десятиводного карбоната натрия (Na2CO3·10H2O-R2-Е- Na2CO3·10H2O), поле гидрокарбоната натрия (NaHCO3-R1-Р- NaHCO3), поле кристаллизации двойного химического со-
единения (NaHCO3·Na2CO3·2H2O - Е - Р - NaHCO3·Na2CO3·2H2O), две трех-
фазные области: NaHCO3·Na2CO3·2H2O + NaHCO3+ Р(L); E(L) + Na2CO3·10H2O + NaHCO3·Na2CO3·2H2O. Область NaHCO3·Na2CO3·2H2O +
NaHCO3 + Na2CO3·10H2O + Na2CO3 не имеет жидкой фазы и физикохимического смысла.
Рассмотрим, как протекает процесс изотермического испарения исходной смеси F. На участке F - 1 луча испарения происходит увеличение содержания солевой массы, но система остается гомогенной. В точке 1 раствор становится насыщенным относительно гидрокарбоната натрия.
На участке 1 - 2 луча испарения происходит кристаллизация гидрокарбоната натрия. В точке 2 раствор становится двояконасыщенным.
На участке 2 - NaHCO3·Na2CO3·2H2O луча испарения в нонвариантном равновесии находятся кристаллы гидрокарбоната натрия и троны с насыщенным раствором состава Р, при этом кристаллы гидрокарбоната натрия, выпавшие ранее, растворяются, а кристаллы троны выделяются в твердую фазу. Состав насыщенного раствора остается постоянным до исчезновения последнего кристалла гидрокарбоната натрия. Точка Р носит название перитонической.
12.6. Тройные водно-солевые системы с расслаиванием
На рис. 12. 6 изображена изотерма растворимости тройной системы с расслаиванием, отличающаяся от изотермы растворимости эвтонического типа наличием области существования двух жидких фаз (LH - К - LB - LH) и трехфазной области совместного существования твердой и двух жидких
фаз ((NH4)2HPO4 - LH - LВ - (NH4)2HPO4).
С точки зрения правила фаз равновесие двух жидких фаз в трехкомпонентной системе при постоянных температуре и давлении является моновариантным (В = К - Ф + О= 3 -2). Это означает, что концы нод, соединяющих равновесные составы жидких фаз, должны находиться на линии моновариантных равновесий.
Равновесие двух жидких и одной твердой фаз в таких условиях нонвариантно (В = 3 - 3 + 0). Это означает, что составы жидких и твердой фаз будут постоянны. В нашем случае составы жидких фаз, нижней и верхней, отвечают точкам LH и LB соответственно, а состав твердой фазы отвечает составу гидрофосфата аммония. Системы, лежащие внутри трехфазной монотектической области, распадаются согласно правилу центра тяжести на три системы - LH, LB и (NH4)2HPO4.
Остальные фазовые области: поля кристаллизации чистых компонентов; поле совместной кристаллизации исходных солей; область нена-
127
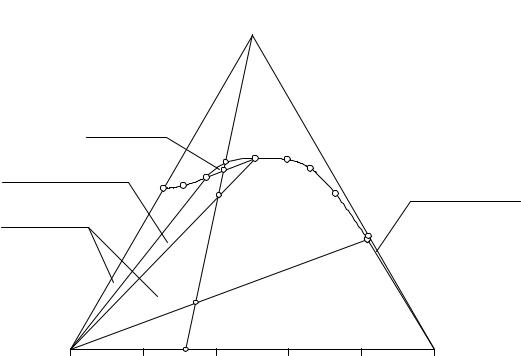
сыщенных растворов - те же, что и на изотерме растворимости эвтониче- |
||||||
ского типа, но поле кристаллизации гидрофосфата аммония разделено |
||||||
трехфазной монотектической областью на две части: (NH4)2HPO4 - R1 - LH - |
||||||
(NH4)2HPO4 и (NH4)2HPO4 - LB - Е - (NH4)2HPO4. |
|
|
||||
|
|
|
H2O |
|
|
|
|
L1+L2 |
|
L |
|
|
|
|
|
|
|
|
|
|
|
|
K |
Lв |
|
|
|
Lн+Lв+(NH4)2HPO4 R1 |
Lн |
1 |
|
|
L+(C2H5)3NHCl |
|
L+(NH4)2HPO4 |
2 |
|
|
|||
|
|
|
||||
|
|
|
R2 |
|
||
|
|
|
|
|
|
|
|
|
|
|
|
E |
|
|
|
3 |
|
|
|
|
|
|
E(L)+(NH4)2HPO4+(C2H5)3NHCl |
||||
|
|
4 |
|
|
|
|
0 |
20 |
40 |
|
60 |
80 |
100 |
(NH4)2HPO4 |
|
% мас. |
|
(C2H5)3NHCl |
||
Рис. 12. 6. Система (NH4)2HPO4 - (C2H5)3NHCl - H2O при 60°C |
||||||
Рассмотрим, как протекает процесс изотермического испарения исходной системы К, лежащей на линии моновариантных равновесий двух жидких фаз. На участке луча испарения К - 1 системы распадаются на две жидкие фазы. Составы нижних жидких фаз при этом смещаются по линии моновариантного равновесия от точки К к точке LB.
Вточке 1 появляются первые кристаллы гидрофосфата аммония, и система становится нонвариантной. Такими системы остаются на всем отрезке луча испарения 1 - 2. Составы жидких и твердой фаз в этих системах
отвечают точкам LH, LB и (NH4)2HPO4, при смещении состава систем от точки 1 до точки 2 изменяются лишь весовые соотношения равновесных фаз: твердой фазы становится все больше, а жидкой фазы LH - все меньше.
Вточке 2 исчезает последняя капля жидкой фазы состава LH, и система вновь становится моновариантной.
На участке луча испарения 2 - 3 происходит кристаллизация чистого гидрофосфата аммония. Составы насыщенных растворов при этом сме-
щаются по линии моновариантного равновесия кристаллов (NH4)2HPO4 и насыщенного раствора от точки LB к точке Е. Раствор становится насы-
128

щенным относительно хлорида триэтиламмония, когда состав исходной смеси приходит в точку 3.
На участке луча испарения 3 - 4 происходит совместная кристаллизация исходных солей. Все системы на этом участке являются нонвариантными и распадаются на три фазы - жидкую состава Е и две твердые, представляющие собой чистые солевые компоненты (C2H5)3NHCl и
(NH4)2HPO4.
В заключение необходимо сделать следующее замечание. Трехфазная область совместного существования твердой и двух жидких фаз названа монотектической по аналогии с двойными системами плавкости. Этот термин не является общепринятым, так как при температурах, достижимых при атмосферном давлении, водно-солевые системы с расслаиванием встречаются достаточно редко.
12.7. Тройные водно-солевые системы с кристаллизацией твердых растворов
Если система слагается из изоморфных солей и воды, в ней отсутствуют поля кристаллизации чистых компонентов. В таких системах кристаллизуются твердые растворы, состав которых непрерывно изменяется от одного исходного компонента к другому.
Согласно принципу соответствия, изотерма растворимости такой системы состоит из одной ветви моновариантного равновесия насыщенных растворов с твердой фазой переменного состава. Розебом показал, что существует пять типов изотерм растворимости тройных систем с образованием твердых растворов.
Тип I. Линия насыщенных растворов не имеет экстремума, соли образуют непрерывный ряд твердых растворов (рис. 12. 7).
H2O
L
(K,NH4)I+L
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Рис. 12. 7. Система KI - NH4I |
|
0 |
20 |
40 |
60 |
80 |
100 |
||||||||||||||
- H2O при 21°C |
|||||||||||||||||||
NH4I |
|
|
|
|
|
|
% мас. |
|
|
|
KI |
||||||||
Тип II. Линия насыщенных растворов имеет минимум растворимости. Твердые фазы представляют непрерывный ряд твердых растворов.
129

Тип III. Линия насыщенных растворов имеет экстремум - максимум растворимости (рис. 12.8), твердые фазы при этом представляют собой непрерывный ряд твердых растворов.
H2O
 L
L
L+(K,NH4)2SO4
0 |
20 |
40 |
60 |
80 |
100 |
Рис. 12. 8. Система K2SO4 - |
|
K2SO4 |
|
|
% мас. |
|
(NH4)2SO4 |
(NH4)2SO4 |
- H2O при 0°C |
|
|
|
H2O |
|
|
||
|
|
|
|
|
|
|
|
|
|
|
L |
|
|
|
|
L+(K,NH4)Cl |
|
|
E |
L+(NH4,K)Cl |
|
|
|
|
|
|
|
|
|
|
|
E(L)+(K,NH4)Cl+(NH4,K)Cl
|
|
|
|
|
|
|
|
|
|
|
|
Рис. 12. 9. Система |
|
|
|
|
|
|
|
|
|
|
|
|
|
0 |
20 |
40 |
60 |
80 |
100 |
|||||||
KCl |
|
|
|
|
% мас. |
|
|
NH4Cl |
KСl - NH4Cl - H2O при 21°C |
|||
H2O
L
Na(Br,Cl)·2H2O+Na(CL,Br)+P(L)
Na(Cl,Br)+L |
P Na(Br,Cl)·2H2O+L |
NaBr·2HO
2
|
|
|
|
|
|
|
|
|
|
|
|
Рис. 12. 10. Система NaCl - |
|
|
|
|
|
|
|
|
|
|
|
|
|
0 |
20 |
40 |
60 |
80 |
100 |
|||||||
NaCl |
|
|
|
|
% мас. |
|
|
NaBr |
NaBr - H2O при 25°C |
|||
|
|
|
|
|
|
|
|
130 |
|
|
|
|
