
Posob_2012_Ok
.pdf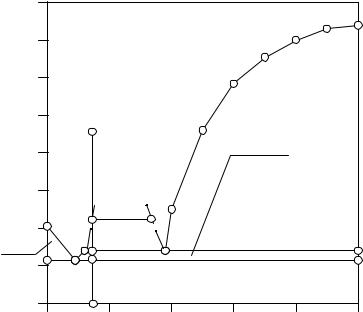
900 |
|
|
|
|
|
|
800 |
|
|
|
|
|
|
700 |
|
|
|
|
|
|
600 |
|
I |
|
|
|
|
500 |
|
L |
|
As+L |
|
|
|
|
|
|
|
|
|
400 |
1 |
L1+L2 |
1' |
|
|
|
300 |
|
|
|
|||
п |
2 |
п |
|
|
|
|
L+Tl |
L 1 |
L 2 |
|
|
|
|
200 |
E |
3 |
Tl+As |
|
|
|
100 |
|
|
|
|
||
|
I 20 |
|
|
|
|
|
0 |
|
40 |
60 |
80 |
100 |
|
Tl |
|
|
% мас. |
|
As |
|
Рис. 10. 12. Система Tl - As с расслаиванием монотектического типа
При температуре точки 2 начинает кристаллизоваться мышьяк, и система становится нонвариантной. Составы первой и второй жидких фаз остаются постоянными, равными составам точек LП1 и LП2. На кривой охлаждения наблюдается температурная задержка. Протекает фазовая реакция: As (S)+ LП2 = LП1. При отводе тепла фазовая реакция завершается исчезновением второй жидкой фазы, после чего система становится моновариантной.
От точки 2 до точки 3 участка охлаждения кристаллизуется мышьяк, состав жидкой фазы меняется по кривой ликвидуса от точки LП1 до точки Е. Соотношение жидкой и твердой фазы определяется по правилу рычага.
При температуре точки 3 в системе начинается эвтектическая фазовая реакция: Е(L) = As(S) + Tl(S). На кривой охлаждения вновь наблюдается температурная задержка. Составы всех равновесных фаз остаются постоянными. Соотношение фаз при этом изменяется - количество жидкой фазы уменьшается, а количество твердой фазы увеличивается. Суммарный состав твердой фазы меняется от чистого мышьяка до состава выбранного сечения (точка 3).
После исчезновения эвтектического расплава в равновесии находится смесь двух твердых фаз - мышьяка и таллия. На участке охлаждения при температурах меньших точки 3 происходит охлаждение смеси кристаллов, суммарный состав которой равен составу выбранного сечения.
111
11.Общие сведения о тройных системах
Втрехкомпонентных (тройных) системах также возможно появление фаз переменного состава: растворы (S и L), газовая фаза (V), имеется несколько компонентов и возникающий вопрос о способе выражения концентрации решается также как и в двойных системах.
Традиционными способами выражения концентраций являются:
1. Массовые доли - отношение массы какого-либо вещества к массе всей смеси. Массовые доли, умноженные на 100, дают % мас. Сумма массовых долей равна единице, а % мас. - 100.
2. Мольные доли - отношение числа молей данного вещества к общему числу молей всех веществ в данной смеси. Если умножить мольные доли на 100, то получим % моль. Сумма мольных долей смеси равна 1, а %
мол. - 100.
Кроме того, применяются специфические способы выражения концентраций компонентов, которые обсуждаются ниже в специальных разделах.
Если в системе образуется химическое соединение, то состав его можно выразить двумя способами. Во-первых, можно указать концентрации смешанных компонентов, считая, что химическое соединение как бы не образуется; заданные таким образом концентрации называются аналитическими. Во-вторых, можно указать концентрации исходных компонентов и химического соединения в образовавшейся равновесной смеси; определенные таким образом концентрации называются истинными.
Как правило, пользуются аналитическими концентрациями, а истинные концентрации служат для некоторых расчетов, которые будут показаны далее.
Вотличие от диаграмм состояния двойных систем, составы которых изображаются точками на прямой, для изображения состава тройных систем используют так называемый концентрационный треугольник, вершинам которого отвечают чистые компоненты, а тройные смеси могут быть представлены точками на плоскости треугольника.
Рассмотрим основной метод изображения составов в тройных сис-
темах.
11.1.Графическое изображение тройных систем
по способу Гиббса-Розебома
Для изображения состава тройной системы по способу Гиббса-Розе- бома пользуются свойствами равностороннего треугольника, а именно: сумма длин перпендикуляров (MA' + MB' + MC', см. рис. 11.1), опущенных из точки, находящейся внутри него, на стороны равна его высоте, а сумма отрезков (MA'' + MB'' + MC'', рис. 11.1), параллельных каждой из сторон, равна стороне треугольника. Таким образом, если разделить высоту или
112
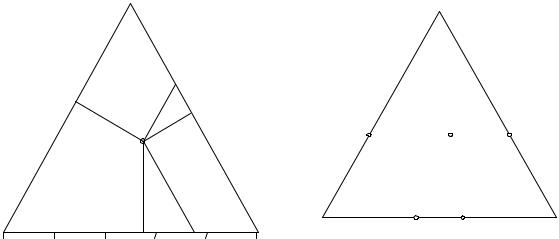
сторону на сто равных частей и принять их за масштаб, при котором одна сотая стороны или высоты приравнивается одному проценту, то любой состав трехкомпонентной системы будет изображаться точкой внутри треугольника.
Так, если дана смесь состава а % вещества А, b % вещества В, с % вещества С, то отрезки MA' и MA'' на рис. 11.1 будут равны а, отрезки MB' и MB'' равны b, отрезки MC' и MC'' равны с. Необходимо также отметить, что положение фигуративной точки M, изображающей состав смеси, не зависит от того, что мы берем за основу масштаба, высоту или сторону. Положение точки целиком определяется абсолютными величинами а, b, с. Данное изображение концентраций называется способом Гиббса-Розебома.
С |
С |
|
|
|
B' |
|
|
|
A" |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
a |
A' |
|
|
|
|
|
|
|
|
M a |
|
|
|
|
||
|
|
|
|
b |
|
|
|
|
|
E |
|
b |
|
D |
|
|
|||||
|
|
B" |
|
M |
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
c |
|||||||||
|
|
|
|
|
|
|
|
|
|
|
c |
|
|
|
|
||||||
|
|
|
|
|
|
c |
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
c |
C' |
C |
c |
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
0 |
20 |
40 |
60 |
80 |
100 |
||||||
|
|
|
|
|
C'60 |
C"80 |
|
|
|||||||||||||
0 |
20 |
40 |
100 |
A |
|
|
|
|
|
|
|
|
B |
||||||||
A |
|
|
|
|
|
|
B |
|
|
|
|
|
|
|
|
|
|
|
|
||
Рис. 11.1. Основные способы изо- |
Рис. 11.2. Удобный способ изобра- |
||||||||||||||||||||
бражения состава в тройных систе- |
жения состава в тройных системах |
||||||||||||||||||||
|
|
|
|
|
мах |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
На практике в качестве масштаба, как правило, применяют сотую долю длины стороны, а концентрационный треугольник строят на миллиметровой бумаге, что позволяет использовать параллельные основанию треугольника линии бумаги. На рис. 11.2 показан порядок построения фигуративной точки М с координатами а (% соли А), b (% соли В) и с (% со-
ли C).
Сначала измерителем или циркулем отмеряют отрезок, равный с (содержание С) и от точки В откладывают его на стороне B - С, получают точку D. Находят на миллиметровой бумаге линию ED, параллельную солевому основанию треугольника состава. Отмеряют измерителем отрезок, равный а (содержание соли А), откладывают его на параллели от точки D и находят точку М, характеризующую состав смеси.
113

Аналогичные построения можно выполнить от вершины А треугольника состава. На стороне А - С от точки А откладывают отрезок, равный c, находят точку Е и параллель ED. От точки Е на ней откладывают отрезок, равный b, и находят ту же самую точку М. Необходимо подчеркнуть, что отрезок ED равен сумме содержаний компонентов А и В.
При малом содержании солевых компонентов в тройной водносолевой системе (а % соли А, b % соли В, с % воды) иногда возникает необходимость изобразить водный угол диаграммы в укрупненном масштабе. В этих случаях поступают так, как изображено на рис. 11.3.
H2О
a+b a+b
E b M a
b M a  D
D
A B
A b C a B
Рис. 11.3. Водный угол |
Рис. 11.4. Правило рычага |
От вершины угла, отвечающей составу воды, отмеряют в выбранном масштабе сумму содержания солевых компонентов и находят отрезок ED, равный этой сумме. От точки D откладывают отрезок, равный а, или от точки Е откладывают, отрезок равный b, находят точку М, характеризующую состав данной смеси на диаграмме.
11.2. Основные свойства диаграммы Гиббса - Розебома
Остановимся на некоторых свойствах диаграммы Гиббса - Розебома
(см. рис. 11.5).
1.Вершины треугольника отвечают составам чистых компонентов.
2.Стороны треугольника состава отвечают двойным системам.
3.Точки, лежащие на прямой, проведенной внутри треугольника состава параллельно его стороне, изображают составы с постоянным содержанием того вещества, которое соответствует противоположной вершине.
4.Точки, лежащие на прямой, проведенной внутри треугольника через его вершину, изображают системы с постоянным отношением концентраций двух веществ, отвечающих двум другим вершинам треугольника.
114
5.Если смешать а весовых частей системы А с b весовыми частями системы В, то состав полученной смеси изобразится точкой С, лежащей на отрезке прямой АВ, причем а / b = ВС / АС (см. рис 11.4). Это положение носит название правила рычага.
Для графического определения положения точки С измеряют длину отрезка АВ, решают пропорцию ВС / АВ = а / (а+b) и откладывают длину отрезка ВС от точки В.
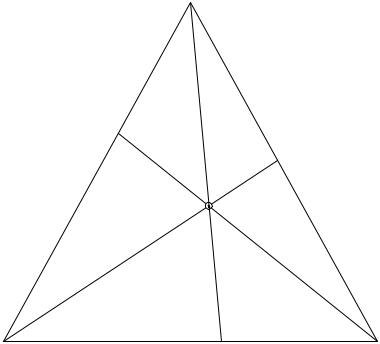
6.Если смешать а весовых частей системы А, b весовых частей системы В и с весовых частей системы С, то получится смесь (система Р), состав которой изобразится точкой Р, лежащей в центре тяжести масс а, b, с треугольника АВС (см. рис. 11.5). Это положение носит название правила центра тяжести.
A
|
b |
|
c |
|
|
|
|
|
|
|
C' |
b+c |
B' |
|
|
|
|
||
|
|
c |
|
|
|
|
|
|
|
|
a |
P |
b |
|
|
|
a+b |
a |
|
|
a+c |
|
||
|
|
|
|
|
|
|
a |
|
|
B |
c |
A' |
b |
C |
Рис. 11.5. Основные свойства диаграммы Гиббса - Розебома
Для графического определения центра тяжести масс а, b, с треугольника АВС выбирают любую сторону треугольника (АВ), измеряют ее длину, решают пропорцию BC'/ AB = a/(a+b) и откладывают длину отрезка BC' от точки В. Затем проводят линию СС', измеряют ее длину, решают пропорцию C'P / C'C = c/(a+b+c), откладывают длину отрезка C'P от точки C' и находят искомое положение центра масс в точке Р.
Правило рычага является частным случаем правила центра тяжести. Важным следствием правила рычага является тот факт, что если система распадается на две другие системы, то точка, изображающая ее состав, обязательно лежит между этими системами на одной прямой с ними.
115
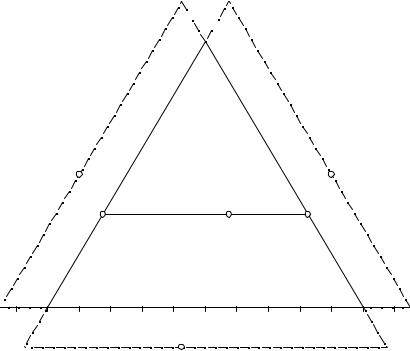
11.3. "Отрицательные" области концентраций диаграммы Гиббса – Розебома
Как правило, табличные данные о составах равновесных жидких фаз в системах положительны, но иногда возникает необходимость изображения фигуративных точек в пограничных системах, находящихся вблизи от изображаемой диаграммы состояния (подробнее см. ниже). В этих случаях при взаимном пересчете составов появляются отрицательные концентрации компонентов.
На рис. 11.6 изображено положение точек F(65, 50, -15); G(-15, 65, 50); H(65, -15, 50) и M(25, 40, 35).
H" G"
 C
C 
H |
G |
b |
M a |
c |
c |
H' |
A |
|
|
|
|
|
|
|
|
|
B |
G' |
-10 |
0 |
10 |
20 |
30 |
40 |
50 |
60 |
70 |
80 |
90 |
100 |
110 |
F' |
|
|
|
|
F |
|
|
|
|
|
|
F" |
Рис. 11.6. "Отрицательные" области концентраций на диаграмме Гиббса - Розебома
Для графического изображения точек G, H, F с отрицательным содержанием компонентов А, В, С соответственно необходимо продлить стороны концентрационного треугольника, отложить отрицательное содержание компонента в масштабе сторон треугольника состава (СG"; CG' для компонента А; СН"; АН' для компонента В; АF'; BF"' для компонента C). Провести линию постоянного содержания компонента (G'G", H'H", F'F" соответственно) и определить положение искомой точки, откладывая содержания второго или третьего компонента от точек их нулевого содержания также в масштабе стороны состава (G"G; G'G для компонентов В и С при отрицательном значении А; H"H; H'H для компонентов A и С при отрицательном значении B; F'F; F"F для компонентов A и B при отрицатель-
116

ном значении C). Ортогональный набор координат точек F, G и H вычисляется по формулам, приведенным выше.
Таким образом, на концентрационной на диаграмме Гиббса – Розебома имеются следующие области: АВС (традиционная) – положительного содержания всех трех компонентов; CBG'G"C – отрицательного содержания компонента А; ACH"H'A – отрицательного содержания компонента B; ABF"F'A – отрицательного содержания компонента C.
Кроме того, имеется три области (AH'F'A; BF"G'B; CG"H"C) с отрицательным содержанием двух компонентов. Однако практические задачи с фигуративными точками состава в этих областях авторам пока не встречались.
11.4. Компьютерное изображение тройных систем по способу Гиббса-Розебома
Для построения рисунков в компьютерных программах необходимы ортогональные координаты изображаемых точек. Рис. 11. 7 иллюстрирует алгоритм пересчета положения исходной смеси М (a, b, c), находящейся в треугольнике состава системы А – В – С, в ортогональную систему координат (x, y).
C
M" c/2 |
E |
b |
M |
a |
|
D |
y |
|
|
|
|
|
c |
|
|
x |
|
|
|
|
0 |
20 |
40 |
M'60 |
|
80 |
100 |
A |
|
|
|
|
|
B |
Рис. 11. 7. Пересчет положения точки М (a, b, c) в ортогональную систему координат (x, y)
Для вычисления ортогональных координат x, y исходных смесей как в положительной, так и в отрицательной областях концентраций диа-
граммы состава можно использовать следующие уравнения: |
(11.1) |
x = b + c/2; |
|
y = с 3 /2. |
(11.2) |
117 |
|
Иногда возникает необходимость решения обратной задачи определения координат (a, b, c) точки М по известным, снимаемым с графика
программными средствами, координатам (x, y): |
|
c = 2y/ 3 ; |
(11.3) |
b = x – y/ 3 ; |
(11.4) |
a= 100 – b – c. |
(11.5) |
12. Основные типы диаграмм растворимости тройных систем
Применение правила фаз к тройным водно-солевым системам позволяет сделать следующие выводы. В общем случае, когда давление и температура являются независимыми термодинамическими параметрами и могут изменяться, нонвариантный процесс возможен при совместном существовании пяти фаз (В =К-Ф+2 = 3-5+2= 0). Если давление или температура в системе постоянно (изобара или изотерма), то нонвариантное равновесие будет существовать при совместном присутствии четырех фаз (В= = К-Ф+1 = 3-4+1 = 0) . При постоянном давлении и температуре (изобарноизотермические условия) в системе будет наблюдаться нонвариантный процесс при равновесии трех фаз (В= 3-3+0 = 0).
Исследования растворимости в системах при изобарно-изотерми- ческих условиях встречаются на практике наиболее часто. Ниже будут обсуждаться диаграммы растворимости, изучаемые именно в этих условиях. Для краткости они будут называться диаграммами растворимости.
Итак, нонвариантное равновесие наблюдается при совместном присутствии трех фаз. Такими фазами наиболее часто бывают две соли и насыщенный относительно них раствор, подобное равновесие носит название эвтонического, а точка, изображающая состав такого раствора на диаграмме, называется эвтоникой системы.
Кроме того, такими фазами могут быть соль (твердая фаза) и две расслаивающиеся жидкости (две жидкие фазы), находящиеся в равновесии друг с другом. Подобное равновесие будем называть монотектическим.
Согласно правилу фаз двухфазное равновесие в изобарно-изотер- мических условиях будет моновариантно (В = 3-2 = 1). Наиболее часто встречающимся в водно-солевых системах моновариантным равновесием является совместное существование соли (твердой фазы) и насыщенного относительно нее раствора (жидкая фаза). Гораздо реже встречается равновесие двух жидких фаз - не смешивающихся друг с другом растворов.
12.1. Диаграммы растворимости тройных водно-солевых систем простого эвтонического типа
Сначала рассмотрим наиболее простой тип диаграмм растворимости - это системы, составленные водой и солями, которые не вступают в соединение ни друг с другом, ни с водой. Диаграмма растворимости сис-
118
темы (C2H5)2NH2Cl (AX) - NH4Cl (BX) - H2O при 25°С имеет именно такой тип и приведена на рис. 12. 1.
H2O
b
BX+L
|
O' |
|
BX |
|
AX+L |
O |
|
|
|
E a |
|
L |
AX+BX |
C |
H |
|
|
AX+BX+LE |
LE |
|
|
|
|
BX |
H' |
AX |
Рис. 12. 1. Тройная водно-солевая система простого эвтонического типа
Согласно принципу соответствия, каждому фазовому равновесию на диаграмме должен соответствовать определенный геометрический образ. Чистым компонентам - нонвариантным однокомпонентным системам (В =1-1 + 0) - отвечают точки - вершины концентрационного треугольника. Двойным системам отвечают стороны концентрационного треугольника, причем сторона треугольника АХ - ВХ носит название солевого основания и отвечает моновариантному равновесию двух твердых фаз - солей АХ и ВХ.
Двойные системы АХ - Н2О и ВХ - Н2О (боковые стороны треугольника) устроены несколько сложнее. В них имеются нонвариантные точки а и b соответственно, отображающие составы растворов, находящихся в равновесии с кристаллическими солями (В= 2-2+0). Эти растворы называются насыщенными.
Отрезки а - Н2О и b - Н2О отображают моновариантные однофазные равновесия жидких фаз - ненасыщенных растворов (В =2-1+0). Системы, лежащие между точками а и АХ; b и BХ, с содержанием солей большим, чем в насыщенных растворах, распадаются согласно правилу рычага на две системы - соль и насыщенный раствор, составы этих систем отображаются точками АХ и а; BХ и b соответственно.
Например, система С распадается на насыщенный раствор и твердую фазу АХ, массы этих систем относятся как длины отрезков АХ - С и а - С соответственно.
119
Тройным системам отвечают точки внутри треугольника состава. Часть плоскости Н2О-а-Е-b-Н2О характеризует дивариантное одно-
фазное равновесие (В = 3-1+0) и является полем ненасыщенных растворов. Часть плоскости АХ-а-Е-АХ называется полем кристаллизации соли АХ, часть плоскости ВХ-Е-b-ВХ - полем кристаллизации соли ВХ. Эти
области описывают моновариантные двухфазные равновесия (В = 3-2+0) кристаллов солей и насыщенных растворов, составы которых находятся на линиях а - Е (ветвь растворимости, иначе кристаллизации, кристаллов АХ)
иb - Е (ветвь кристаллизации, иначе растворимости, соли ВХ). Любая система, лежащая внутри полей кристаллизации солей, распадается по правилу рычага на две системы, одна из которых является составом соответствующей соли, а вторая лежит на линии насыщенных растворов (а - Е или b
- Е).
Для определения состава насыщенного раствора исходной ИСК(точка О), лежащей в поле кристаллизации одной из солей, необходимо из вершины треугольника, отвечающей составу равновесной твердой фазы (ВХ), провести прямую через состав исходной смеси и продолжить ее до пересечения с ветвью растворимости данной соли (точка О'). Полученная точка пересечения ветви растворимости и построенной прямой, называемой лучом кристаллизации или нодой, отвечает составу равновесной жидкой фазы.
Нонвариантное трехфазное равновесие насыщенного раствора и кристаллов обеих солей описывается треугольником АХ-Е-ВХ, образуемым составами равновесных фаз. Точка Е называется эвтонической или эвтоникой системы, отвечает составу раствора, насыщенного двумя твердыми фазами. Любая смесь, находящаяся внутри треугольника АХ-Е-ВХ, распадается по правилу центра тяжести на три фазы (чистые соли: АХ; ВХ
иэвтонический раствор Е).
Например, система Н распадается на насыщенный раствор состава Е и смесь кристаллов АХ и ВХ соотношения Н'. Причем массы жидкой и твердых фаз относятся также, как плечи НН' и ЕН, а соотношение солей АХ и ВХ в донной фазе будет равно отношению плеч Н'-ВХ и Н'-АХ.
Линии АХ-Е и ВХ- Е называются предельными нодами, конечными нодами или конодами. Ветви кристаллизации солей и эвтоника системы образуют линию ликвидуса системы – границу исчезновения твердой фазы. Солевое основание треугольника состава является линией солидуса – границей исчезновения жидкой фазы.
12.2.Диаграммы растворимости тройных водно-солевых систем
собразованием устойчивых кристаллогидратов
Изотерма растворимости тройной системы NaCl - MgCl2 - H2O при 25°C, в которой хлорид магния образует устойчивый кристаллогидрат, изображена на рис. 12. 2.
120
