
Posob_2012_Ok
.pdf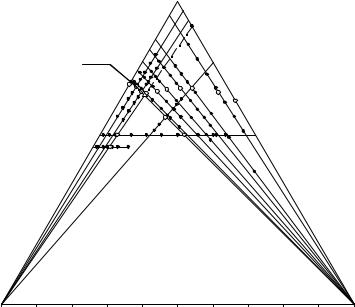
Изотерма растворимости и фазовые равновесия в системе NaCl – Na2CO3·2Na2SO4 – H2O при 50°C представлены на рис. 3.12 и табл. 3.8.
Система имеет простой эвтонический тип, и в ней наблюдается взаимное высаливание беркеита и хлорида натрия, причем беркеит высаливается значительно сильнее.
|
|
|
a |
H2O |
|
|
|
|
1 |
b1 |
|
|
|
|
|
b2EB |
|
|
|
|
a4 |
|
|
|
|
a |
|
|
|
|
|
2 |
|
|
|
b1' b2' |
|
a5 |
|
B |
|
|
|
aa3 |
|
|
|
|
R1 |
6 |
|
|
a2' a1' |
|
|
|
|
||
|
|
E |
|
R2 |
|
F |
f |
|
b |
|
G |
|
|
|
|||
H |
h |
K |
|
|
g |
|
|
|
|||
|
|
|
|
|
|
0 |
10 |
20 |
30 |
40 |
50 |
60 |
70 |
80 |
90 |
100 |
NaCl |
|
|
|
|
% мас. |
|
|
Na2CO3·2Na2SO4 |
||
Рис. 13. 11. Направления сечений, составы ИСК и границы фазовых областей системы NaCl – Na2CO3·2Na2SO4 – H2O при 50°C
13.2.5. Комбинированный метод исследования
Комбинированный метод изучения растворимости в многокомпонентных водно-солевых системах использует лучшие стороны изотермических методов для достижения наиболее надежных результатов исследований с минимальными затратами времени, ресурсов и сил с определением составов фазовых равновесий без изоляции и разделения твердых фаз. Наиболее значимыми сторонами комбинированного метода являются:
−осознанный выбор состава ИСК; −быстрое аналитическое определение составов нонвариантных и
моновариантных растворов в системах с любым количеством компонентов;
−быстрое аналитическое определение составов нонвариантных и моновариантных расслаивающихся жидких фаз, эффективное исследование многокомпонентных монотектических систем;
−корреляция изотермы физического свойства с изотермической диаграммой состояния, определение координат точек, лежащих не только
161
на поверхности ликвидуса, но и на любых границах фазовых областей;
−экономичность и скромные требования к экспериментальной базе; −отсутствие дополнительных исследований для определения соста-
вов равновесных жидких и твердых фаз.
Таблица 13. 7 Характеристика сечений, использованных для изучения фазовых равновесий в системе NaCl – Na2CO3·2Na2SO4 – H2O при 50°С
№ |
Состав насыщенного |
nD50 |
Примечание |
|||
раствора, % мас. |
|
|||||
|
NaCl |
Беркеит |
|
H2O |
|
|
|
Изогидрический разрез FG (56% H2O) |
|
||||
F |
44,00 |
− |
|
56,00 |
|
раствор+NaCl |
G |
− |
44,00 |
|
56,00 |
|
раствор+Бр |
|
Изогидрический разрез HK (52%H2O) |
|
||||
H |
− |
48,00 |
|
52,00 |
− |
раствор+Бр |
K |
48,00 |
− |
|
52,00 |
− |
E+NaCl+Бр |
|
|
Сечение B- |
NaCl |
|
|
|
B |
− |
20,20 |
|
52,00 |
1,3623 |
раствор |
NaCl |
100,00 |
− |
|
− |
|
твердая соль |
|
|
Сечение b1- |
NaCl |
|
|
|
b1 |
− |
3,01 |
|
96,99 |
1,3350 |
раствор |
NaCl |
100,00 |
− |
|
− |
|
твердая соль |
|
|
Сечение b2- |
NaCl |
|
|
|
b2 |
− |
6,14 |
|
93,86 |
1,3400 |
раствор |
NaCl |
100,00 |
− |
|
− |
|
твердая соль |
|
Сечение a6-Na2CO3·2Na2SO4 |
|
||||
a6 |
25,74 |
− |
|
74,26 |
1,3745 |
раствор |
Na2CO3·2Na2SO4 |
− |
100,00 |
|
− |
|
твердая соль |
|
Сечение a3-Na2CO3·2Na2SO4 |
|
||||
a3 |
22,68 |
− |
|
77,32 |
1,3692 |
раствор |
Na2CO3·2Na2SO4 |
− |
100,00 |
|
− |
|
твердая соль |
|
Сечение a5-Na2CO3·2Na2SO4 |
|
||||
a5 |
19,90 |
− |
|
80,10 |
1,3644 |
раствор |
Na2CO3·2Na2SO4 |
− |
100,00 |
|
− |
|
твердая соль |
|
Сечение a2-Na2CO3·2Na2SO4 |
|
||||
a2 |
15,91 |
− |
|
84,09 |
1,3574 |
раствор |
Na2CO3·2Na2SO4 |
− |
100,00 |
|
− |
|
твердая соль |
|
Сечение a4-Na2CO3·2Na2SO4 |
|
||||
a4 |
12,51 |
− |
|
87,49 |
1,3515 |
раствор |
Na2CO3·2Na2SO4 |
− |
100,00 |
|
− |
|
твердая соль |
|
Сечение a1-Na2CO3·2Na2SO4 |
|
||||
a1 |
4,63 |
− |
|
95,37 |
1,3380 |
раствор |
Na2CO3·2Na2SO4 |
− |
100,00 |
|
− |
|
твердая соль |
|
|
162 |
|
|
|
|
H2O
|
R1 b1' a5' |
a4' a1' |
|
NaCl |
b2' E |
R2 |
|
b |
Na2CO3·2Na2SO4 |
||
|
|||
|
f |
g |
|
|
h |
|
NaCl+Na2CO3·2Na2SO4
|
0 |
|
10 |
20 |
30 |
40 |
50 |
60 |
|
70 |
80 |
90 |
100 |
|
NaCl |
|
|
|
|
% мас. |
|
|
|
Na2CO3·2Na2SO4 |
|||
|
Рис. 13. 12. Системы NaCl – Na2CO3·2Na2SO4 – H2O при 50°C |
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
Таблица 13. 8 |
Фазовые равновесия в системе NaCl – Na2CO3·2Na2SO4 – H2O при 50°C |
|||||||||||||
Точка |
Составы насыщенных растворов |
|
|
|
Примечание: |
||||||||
или ИСК на границах фазовых областей, % мас. |
|
||||||||||||
|
донная фаза, нода |
||||||||||||
|
NaCl |
|
|
Na2CO3·2Na2SO4 |
|
|
H2O |
|
|||||
|
|
|
|
|
|
|
|||||||
R1 |
27,36 |
|
|
|
− |
|
|
|
|
72,64 |
|
NaCl |
|
b1′ |
25,90 |
|
|
|
2,23 |
|
|
|
|
71,87 |
|
-"- |
|
b2′ |
25,15 |
|
|
|
4,60 |
|
|
|
|
70,25 |
|
-"- |
|
E |
25,24 |
|
|
|
5,98 |
|
|
|
|
68,78 |
NaCl+Na2CO3·2Na2SO4 |
||
a6′ |
24,13 |
|
|
|
6,24 |
|
|
|
|
69,63 |
|
Na2CO3·2Na2SO4 |
|
a3′ |
20,65 |
|
|
|
8,97 |
|
|
|
|
70,38 |
|
-"- |
|
a5′ |
17,62 |
|
|
|
11,45 |
|
|
|
|
70,93 |
|
-"- |
|
a2′ |
13,52 |
|
|
|
15,04 |
|
|
|
|
71,44 |
|
-"- |
|
a4′ |
10,21 |
|
|
|
18,41 |
|
|
|
|
71,38 |
|
-"- |
|
a1′ |
3,48 |
|
|
|
26,49 |
|
|
|
|
70,03 |
|
-"- |
|
R2 |
− |
|
|
|
32,78 |
|
|
|
|
67,22 |
|
-"- |
|
|
|
|
|
Составы ИСК на предельных нодах |
|
||||||||
h |
43,50 |
|
|
|
4,50 |
|
|
|
|
52,00 |
|
E-NaCl |
|
f |
39,15 |
|
|
|
4,85 |
|
|
|
|
56,00 |
|
-"- |
|
b |
22,75 |
|
|
|
15,56 |
|
|
|
|
61,69 |
|
E-Na2CO3·2Na2SO4 |
|
g |
20,42 |
|
|
|
23,58 |
|
|
|
|
56,00 |
|
-"- |
|
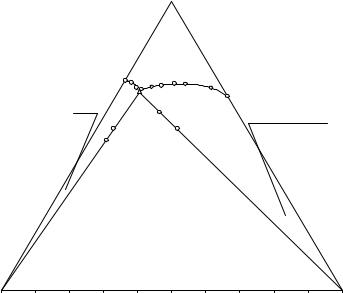
Оптимальный план изучения тройной водно-солевой системы простого эвтонического типа комбинированным методом (на примере системы NaCl – NH4Cl – H2O при 25°С; см. рис. 13. 13) является следующим.
1. Определяем состав двойного эвтонического раствора прогностическим методом (см. выше). Для чего вычисляем два оптимальных состава ИСК (т.т. 1 и 2 на рис. 3.10) по уравнению прямой, заданной предполагае-
163

мым составом двойного эвтонического раствора (т. Epr) и равным количеством безводных хлоридов натрия и аммония. Соотношение твердой и жидкой фаз должно быть в интервале 10–30:90–70% мас. Оптимальные составы ИСК рассчитываем по уравнениям (3.1) и (3.2).
|
|
|
|
a H2O |
|
|
|
|
|
|
|||
|
|
|
|
11 |
|
|
|
|
|
|
|
||
|
|
|
|
a10 |
|
|
|
|
|
|
|
|
|
|
|
EAa9 |
L |
|
|
EB |
|
|
|
|
|||
|
R A |
|
|
|
|
|
B |
R |
|
|
|
||
|
|
1 |
|
|
|
|
|
|
|
|
|
||
|
|
3''4''5'' |
E |
9''10''11'' |
2 |
|
|
|
|||||
F |
3 |
4 |
5 |
a |
b |
9 |
10 |
|
G |
L+NH |
Cl |
||
g16 7 |
8 |
11 |
|||||||||||
L+NaCl(s) |
|
|
|
|
|
|
|||||||
|
|
|
E g2 |
|
|
|
4 |
(s) |
|||||
|
|
|
|
|
|
pr |
|
|
|
|
|
|
|
|
|
|
|
2 |
1 |
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
E(L)+NH4Cl(s)+NaCl(s) |
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
0 |
20 |
|
|
2' |
1' |
|
|
80 |
100 |
||||||||
40 % мас. |
60 |
||||||||||||||||
NaCl |
|
|
|
|
|
|
|
|
|
|
|
|
NH4Cl |
||||
Рис. 13. 13. Изучение растворимости в системе NaCl – NH4Cl – H2O при 25°С различными методами
Далее проводим термостатирование оптимальных ИСК. После установления равновесия отбираем и аналитически определяем составы жидких фаз, равенство которых устанавливает положение Е на диаграмме состояния. Совместное использование составов равновесного нонвариантного раствора Е и ИСК (т.т. 1 и 2 на рис. 3.10) позволяют установить только соотношение исходных компонентов в донной фазе (т.т. 1′ и 2′ на рис. 1), но не гарантируют от появления в ней новых фаз – двойного соединения или ограниченных твердых растворов.
2. На следующем этапе устанавливаем составы равновесных жидких и твердых фаз, участвующих в нонвариантных равновесиях:
1)вычисляем соотношение солевых компонентов к воде в нонвари-
антном растворе: c1 = {NaCl}E/{H2O}E; c2 = {NH4Cl}E/{H2O}E;
2)на каждой предельной ноде определяем хотя бы по одной точке (a, g1; b, g2; см. рис. 3.13, табл. 13. 9). С этой целью исследуем два различ-
164
ных типа сечений: изогидрические – наподобие FG (рис. 3.10) с различным содержанием воды, меньшим, чем в эвтоническом растворе системы, а также типа А-NH4Cl и B-NaCl, где А и B – растворы, содержащие меньшее количество воды, чем в т.т. EA и EB.
Таблица 13. 9 Исходные данные для расчета составов равновесных жидких и твердых
фаз в системе NaCl – NH4Cl – H2O при 25°С
Точка |
Составы жидких фаз или ИСК, % мас. |
c1={NaCl}/{H2O} |
c2={NH4Cl}/{H2O} |
||
|
|
H2O |
|||
|
NaCl |
NH4Cl |
|
|
|
E |
17,70 |
13,80 |
68,50 |
0,2584 |
0,2015 |
a |
21,60 |
13,14 |
65,26 |
|
0,2014 |
g1 |
27,91 |
12,09 |
60,00 |
|
0,2015 |
b |
16,27 |
20,53 |
63,20 |
0,2575 |
|
g2 |
15,50 |
24,50 |
60,00 |
0,2584 |
|
Е ср. |
17,68 |
13,78 |
68,54 |
c1 ср.= 0,258 |
c2 ср.= 0,201 |
На функциональных зависимостях определяем координаты точек изломов на границах нонвариантной области. В этих точках вычисляем основные коэффициенты равные отношениям к воде содержаний солей, отсутствующих в равновесной донной фазе на данной границе:
c1 = {NaCl}b/{H2O}b; c1 = {NaCl}g2/{H2O}g2; c2 = {NH4Cl}a/{H2O}a; c2 = {NH4Cl}g1/{H2O}g1.
Сопоставляем отличия коэффициентов, полученных различными методами и лежащих на одной границе относительно друг друга. Если все отличия не превышают нескольких тысячных долей единицы, вычисляем средние значения коэффициентов на каждой границе.
Значительные отличия основных коэффициентов возможны в случаях, когда конноды не исходят из вершин безводных солевых компонентов (образуются кристаллогидраты, химические соединения или ограниченные ряды твердых растворов). Тогда обязательно методом сечений определяем еще по одной репéрной точке на каждой предельной ноде и вычисляем составы равновесных фаз.
Состав нонвариантного раствора определяем, используя формулы (3.4) и (3.5), по средним коэффициентам на всех границах нонвариантных областей. Составы равновесных твердых фаз, при соблюдении равенства основных коэффициентов, представляют собой безводные солевые компо-
ненты NaCl и NH4Cl.
3. Исследуем линии моновариантных равновесий, последовательно соединяющие все нонвариантные растворы системы, любым изотермическим методом (прогностическим методом – ИСК 3–5; методом сечений –
(р-р)а9÷а11-NH4Cl).
4. Обобщаем результаты исследований, сводя экспериментальные данные в итоговые таблицы основного текста и приложений и изображая их на соответствующих рисунках.
165
14. Тройные конденсированные системы плавкости простого эвтектического типа
14. 1. Объемная диаграмма состояния
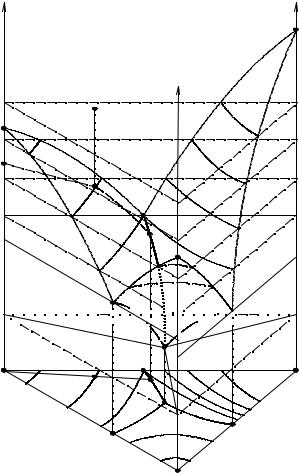
Простейшая диаграмма состояния тройной конденсированной системы плавкости приведена на рис. 14.1. Эта диаграмма описывает процесс кристаллизации в том случае, когда из расплава выделяются только чистые кристаллические компоненты системы. Диаграмма представляет собой трехгранную призму, основанием которой служит концентрационный треугольник; температуры фазовых переходов откладываются на перпендикулярах, восстановленных из каждой точки треугольника.
T T
|
t,° C |
|
|
T B |
|
|
|
|
|
|
|
T |
|
|
T 1 |
S |
|
|
|
T A |
|
|
|
|
|
|
|
|
|
T 2 |
|
|
|
|
a ' |
|
|
|
|
T 3 |
|
|
|
|
|
e I I |
|
|
|
T 4 |
S ' |
|
|
T I I |
|
|
|
||
T I |
S " |
T |
C |
T I I I |
|
||||
|
|
|
||
|
|
|
|
|
T E 






 e I
e I 





 e I I I
e I I I 


 T E
T E
|
|
E |
|
|
|
|
A |
|
e 'I I |
|
|
|
B |
s ,s ' |
s " |
|
|
|
|
|
T 2 |
|
|
|
|
T 1 |
|
T |
|
E ' |
|
|
|
|
3 |
|
T E |
TT 2 |
|||
|
|
T |
4 |
3 |
||
|
T 4 |
e 'I |
|
e 'I I I |
|
|
|
|
T 4 |
|
|
|
|
|
|
T 3 |
C |
|
|
|
|
|
|
|
|
|
|
Рис. 14. 1. Объемная диаграмма состояния тройной системы плавкости
Боковые поверхности объемной диаграммы представляют собой три диаграммы состояния двойных систем простого эвтектического типа . Температуры затвердевания этих трех эвтектик различны (ТI, TII, TIII).
Точки, отвечающие началу выделения кристаллов каждого из компонентов А, В, С из тройных расплавов различного состава , образуют соответственно три кривые поверхности TA-eII -E-eI -TA , TB-eII -E-eIII -TB и TC-
166
eI -E-eIII -TC. Если спроецировать границы eIE, еIIE и eIIIE, представляющие собой линии двойного выделения, на основание диаграммы, то их проекции e'IE', е'IIE' и e'IIIE' разбивают концентрационный треугольник на три области. Из систем, составы которых отвечают областям Ае'IE'e'IIA, Be'IIE'e'IIIB и Ce'IE'e'IIIC, в первую очередь начинают выделяться кристаллы А, В или С соответственно.
Рассмотрим процесс охлаждения системы, отвечающей фигуративной точке S. Состав расплава не меняется, пока фигуративная точка исходной смеси не достигнет в процессе охлаждения точки S'. Эта точка лежит на поверхности кристаллизации компонента А. В момент достижения точки S' система еще однофазна. При дальнейшем охлаждении система распадается на две фазы - кристаллический компонент А и остаточный расплав, фигуративная точка которого при охлаждении перемещается по кривой S'- S", лежащей на поверхности кристаллизации компонента А. Расплав при этом обедняется компонентом А, выделяющимся в твердую фазу.
Расплав, отвечающий точке S", находится в равновесии с кристаллами двух компонентов А и В, поэтому последующее охлаждение сопровождается одновременным выделением кристаллов А и В. Фигуративная точка расплава при этом перемещается по кривой S"- E, представляющей собой часть кривой еIIE.
Вточке Е расплав находится в равновесии с кристаллами всех трех компонентов и представляет собой тройную жидкую эвтектику. Кристаллизация эвтектики происходит при постоянной температуре, отвечающей
точке Е (ТЕ). Система в это время является псевдононвариантной, поскольку в процессе кристаллизации давление остается постоянным, а в равновесии находятся четыре фазы - жидкая, состава Е, и три твердые, чистые компоненты А, В и С (0 = 3 - 4 + 1).
Вобычной работе пользуются проекциями объемных диаграмм на их основание. Подобные проекции представляют собой отображение на плоскость изотермических кривых на поверхностях первичных выделений, пограничных кривых двойной кристаллизации, эвтектической точки и т. д. Проекции получают совершенно также, как это делают при вычерчивании географических карт: на картах нанесены горизонтали, отвечающие определенным высотам над уровнем моря, горизонтали же на поверхности проекций объемных диаграмм представляют собой кривые линии составов сплавов, начинающих кристаллизоваться при одинаковой температуре. Пример подобного построения приведен на рис. 14. 1.
Рассекая объемную диаграмму горизонтальными плоскостями Т1, Т2, Т3, Т4 и т. д., получаем на поверхностях первичных выделений кривые, отвечающие этим температурам. Проекция этих линий на основание образует сеть кривых, которая позволяет судить о рельефе поверхности и пред-
167
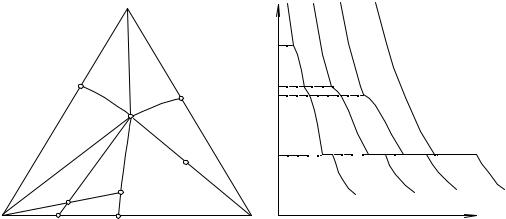
сказывать последовательность выделения различных фаз при кристаллизации расплавов не хуже, чем с помощью объемной диаграммы.
14.2. Плоская диаграмма состояния. Основные пути протекания процессов кристаллизации
На рис. 14. 2 приведена ортогональная проекция объемной диаграммы состояния тройной системы простого эвтектического типа на плоскость треугольника состава (так называемая плоская диаграмма ликвидуса). На диаграмме имеются следующие элементы: А, В, С - точки, отвечающие чистым компонентам; АВ, ВС и АС - отрезки, отвечающие двойным системам; eI, eII, eIII - точки, отвечающие двойным эвтектикам; площа-
ди АеIEeIIA, BeIIEeIIIB и CeIEeIIIC - поля кристаллизации компонентов А, В и С соответственно; кривые еIE, еIIE и еIIIE - линии вторичных выделений;
точка Е - тройная эвтектика. Кроме основных элементов на рис. 14. 2 имеется ряд вспомогательных линий и точек, необходимых для дальнейших объяснений.
|
C |
T |
S F |
G E |
|
|
|
|
|
|
|
|
|
TS |
1 |
|
|
e |
e |
TF |
2 |
1 |
1 |
I |
TG |
|
|
||
|
III |
|
|
|
|
E |
|
|
G |
TE 3 4 2 3 |
3 |
1 |
|
2 |
|
|
|
|
2 |
|
|
|
S |
F |
|
5 |
4 |
|
4 |
3 |
A H |
eII |
B |
|
|
|
|
τ |
Рис. 14. 2. Основные типы кривых охлаждения в тройной системе простого эвтектического типа
При помощи рис. 14. 2 рассмотрим, как будут изменяться составы равновесных фаз при охлаждении расплава S. Сначала исходная реакционная смесь S нагрета выше температуры ликвидуса и представляет собой гомогенный расплав. При охлаждении этого расплава до температуры ликвидуса изменения состава жидкой фазы не происходит, этот состав отображается точкой S.
При дальнейшем охлаждении начинает кристаллизоваться компонент А. Состав жидкой фазы обедняется этим компонентом и изменяется по лучу AF от точки S до точки F. Суммарный состав выпавших кристаллов равен чистому компоненту А. Вариантность равновесия (L+A(s)) систе-
168
мы уменьшается на единицу, и на кривой охлаждения (точка 1 на кривой S) наблюдается излом.
Точка F находится на линии вторичных выделений. При дальнейшем охлаждении реакционной смеси происходит совместная кристаллизация компонентов А и В. Вариантность равновесия (L+A(s)+B(S))снова уменьшается на единицу, и на кривой охлаждения (точка 2 на кривой S) наблюдается излом. Состав жидкой фазы изменяется по кривой еIIE от точки F до точки Е. При этом суммарный состав выделившихся кристаллов меняется от точки А до точки Н на стороне АВ треугольника состава. Для определения положения точки Н необходимо провести ноду из состава тройной эвтектики через состав исходной реакционной смеси и продолжить ее до пересечения с соответствующей стороной треугольника состава.
Точка Е является тройной эвтектикой системы. При отводе тепла будет происходить нонвариантный (при постоянном давлении) процесс кристаллизации сразу трех твердых фаз. На кривой охлаждения наблюдается температурная задержка (точки 3-4 на кривой S). Состав жидкой фазы остается постоянным, равным Е. Суммарный состав выделившейся твердой фазы изменяется по лучу НЕ от точки Н до точки S. Когда суммарный состав твердой фазы становится равным составу исходной реакционной смеси, исчезает последняя капля эвтектического расплава.
Аналогично описанному выше процессу кристаллизации исходной смеси S будет протекать кристаллизация любого расплава, состав которого находится внутри одного из кривосторонних треугольников АеIE, АeIIЕ,
BeIIE, ВeIIIЕ, CeIE и СeIIIЕ.
Рассмотрим, как будет протекать кристаллизация исходного расплава F, а также любой другой исходной смеси, лежащей на линии вторичного выделения. В отличие от смеси S охлаждение гомогенного расплава F до температуры ликвидуса приведет к кристаллизации сразу двух твердых фаз - смеси чистых компонентов А и В. Вариантность равновесия (L+A(s)+B(S)) при этом уменьшается сразу на две единицы и становится равной 1 (3-3+1=1), на кривой охлаждения (точка 1 на кривой F) наблюдается излом.
При дальнейшем охлаждении состав расплава меняется по кривой еIIЕ от точки F до точки Е. Суммарный состав твердой фазы меняется незначительно, он приблизительно равен составу двойной эвтектики в системе А - В. Для определения равновесного состава твердой фазы любого промежуточного расплава достаточно провести ноду из этого расплава через состав исходной смеси (точка F) и продолжить ее до пересечения со стороной треугольника состава. Точка пересечения ноды со стороной треугольника и даст состав равновесной смеси кристаллов А и В.
169
Точка Е является тройной эвтектикой системы. При отводе тепла будет происходить нонвариантный (при постоянном давлении) процесс кристаллизации сразу трех твердых фаз. На кривой охлаждения наблюдается температурная задержка (точки 2-3 на кривой F). Состав жидкой фазы остается постоянным, равным Е. Суммарный состав выделившейся твердой фазы изменяется приблизительно от точки еII до точки F. Когда суммарный состав твердой фазы становится равным составу исходной реакционной смеси, исчезает последняя капля эвтектического расплава.
Состав исходной реакционной смеси G находится на предельной ноде ВЕ. Особенностью кристаллизации данного расплава, а также любой другой исходной смеси, лежащей на предельной ноде (АЕ, СЕ или ВЕ), является тот факт, что после первичной сразу начинается третичная кристаллизация. В процессе первичной кристаллизации расплава G состав жидкой фазы изменяется по лучу ВЕ от точки G до точки Е. Суммарный состав твердой фазы при этом равен В.
При третичной кристаллизации расплава G состав жидкой фазы остается постоянным, равным Е, составы трех кристаллизующихся твердых фаз также неизменны, а суммарный состав твердой фазы меняется по лучу ВЕ от точки В до точки G.
Исходная реакционная смесь, отвечающая составу тройной эвтектики (точка Е), является единственным расплавом, при охлаждении которого отсутствует и первичная, и вторичная кристаллизация, а сразу начинается третичная кристаллизация (точки 1-2 на кривой E).
На рис. 14. 3 приведена диаграмма состояния системы совместно с изотермическими линиями.
14. 3. Политермические разрезы тройной системы простого эвтектического типа
Политермическими разрезами являются сечения пространственной диаграммы состояния вертикальными плоскостями. Проекции этих сечений на плоской диаграмме получаются в виде прямолинейных отрезков, которые также называются разрезами или сечениями.
Прежде всего рассмотрим разрез D-F (см. рис. 14.4), параллельный стороне АВ треугольника состава и проходящий между ней и тройной эвтектикой системы. На левой части рисунка мы видим, что данный разрез пересекает вспомогательные линии АЕ и ВЕ в точках 1 и 3, а также линию двойного выделения в точке 2. На правой части рисунка (собственно политермическом разрезе) на концентрационном отрезке отложено содержание смесей D и F во всех получившихся характеристических точках. На вертикалях отложены температуры фазовых превращений.
170
