
- •1 Вопрос. Физико-химические свойства.
- •2 Вопрос
- •Цветные реакции на белки.
- •3 Вопрос. Белки, их биологическая роль:
- •4 Вопрос Совместные представления о пространственной структуре белков.
- •5 Вопрос. Общая характеристика сложных белков: нуклеотиды, хромопротеиды, фосфопротеиды, гликопротеиды, липопротеиды.
- •6 Вопрос Расщепление аминокислот в печени.
- •7 Вопрос Хромопротеиды и их физиологическая функция.
- •8 Вопрос Обмен белков.
- •Переваривание
- •Пять основных путей метаболизма аминокислот.
- •9 Вопрос
- •10 Вопрос Биосинтез белка. Регуляция синтеза.
- •Главные открытия 50-х годов 20 века.
- •Стадии биосинтеза
- •Моменты инициирования
- •Генетический код и его характеристики.
- •11. Рибосомы, их строение и функции в синтезе белка. Инициация биосинтеза. Элонгация, терминация.
- •12.Регуляция биосинтеза
- •13 Вопрос Строение ферментов
- •Свойства ферментов.
- •14 Вопрос Ингибирование ферментов. Ингибиторы.
- •Обратимое ингибирование. Типы.
- •15 Вопрос Отличие белков-ферментов от других катализаторов.
- •Химизм ферментативной реакции. Факторы, влияющие на способность фермента ускорять реакцию.Пример.
- •Факторы, влияющие на способность ферментов ускорять реакцию.
- •16 Вопрос. Мультиферментные системы.
- •Изоферменты
- •17 Вопрос. Регуляторные ферменты (регуляция ферментативной активности).
- •Аллостерическая регуляция.
- •18 Вопрос
- •3 Класс – гидролазы
- •19 Вопрос
- •2 Класс – трансфераза
- •20 Вопрос
- •22 Вопрос. Оксидоредуктазы
- •23 Вопрос. Биоэнергетика. Биологическое окисление.
- •Аэробные (флабиновые) ферменты.
- •Коанзим – ку (убиксины)
- •Оксидазы
- •Цитохромы.
- •Процесс окисления начинается с окисления субстрата:
- •Энергетический обмен:
- •24. Окислительное фосфорилирование, сопряженное с дыханием. Теория Митчела.
- •25. Нуклеопротеиды. Их строение. Биологически важные моно - , динуклеотиды.
- •26. Рнк – локализация в клетке, микро и макроструктура. Биологическая роль.
- •27. Днк – структура, нуклеотидный состав, принципы комплиментарности и ее биологическая роль.
- •28. Углеводы, их биологическая роль, классификация. Структура и свойства моносахаридов.
- •29. Строение и свойства дисахаридов.
- •30 Вопрос. Гетерополисахариды
- •31 Вопрос. Обмен углеводов
- •Инсулин
- •Глюкогон
- •32 Вопрос Гликолиз (распад глюкозы)
- •Гликолиз
- •Спиртовое брожение
- •33 Вопрос. Цикл Кребса
- •Пентозный цикл
- •34 Вопрос. Липиды Классификация. Наименование липидов. Основные понятия
- •35 Вопрос. Фосфолипиды (мембранные липиды)
- •Глицерофосфолипиды
- •Сфингофосфолипиды
- •Желчные кислоты
- •38. Синтез триглицеридов и фосфоглицеридов.
- •39Вопрос. Обмен липидов. Внутриклеточное превращение. Кетонные тела.
- •Внутриклеточное превращение
- •40 Вопрос Кетонные тела
14 Вопрос Ингибирование ферментов. Ингибиторы.
Ингибиторы– вещества, попадающие из вне. Влияют на организм подавляя активность ферментов.
Действие большинства ферментов можно ингибировать определенными веществами. Действием ингибиторов можно получить сведение о природе функциональной группы активного центра, механизм действия ферментов.
Ингибиторы– инструмент при исследовании метаболических путей в клетке.
Механизм действия лекарств состоит в том, что они ингибируют определенные ферменты в клетках с нарушенными функциями (бактериальных клетках).
Энзимология – наука о ферментах. все ингибиторы приводят к нарушению обмена веществ.
Ингибиторы:
Необратимое ингибирование
Боевые отравляющие вещества, ковалентно связываются в активном центре ферментов: действие диизопропилфторфосфата на серин, тирозин (соединение с ОН группой)
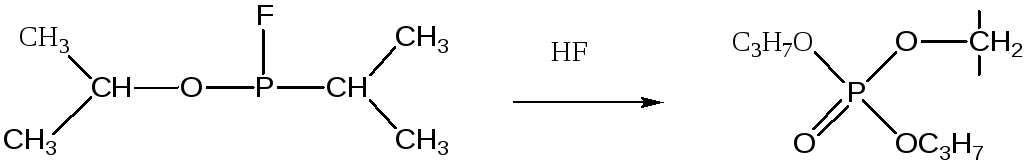
Обратимое ингибирование
Ингибиторы нековалентно связываются с ферментом. Рассматривают три типа конкурентное; неконкурентное; безконкурентное.
Ацетилхалиностераза– нервно-паралитическое действие, она расщепляет ацетилхалин гидролитически. Он является нейтрализатом.


Ацетилхалин расщепляется иначе, он накапливается затем наступает паралич дыхания и других органов с нервными окончаниями.
Иодоацетамид– взаимодействует с ферментами у которых есть цистеин (серосодержащее соединение).

Обратимое ингибирование. Типы.
Ингибитор нековалентно связан с активным ценром. Неконкурентное ингибирование.

Если ингибитор связывается с активным центром, то

Чтобы снять действие ингибитора, нужно увеличить [S].

Неконкурентное ингибирование – ингибитор связывается с ферментом в каком-то другом месте, не в активном центре, но форма активного центра меняется.
 такой фермент не может
взаимодействовать с субстратом
такой фермент не может
взаимодействовать с субстратом

Безконкурентное ингибирование – ингибитор взаимодействует с фермент-субстратным комплексом и продукты реакции уже возникнуть не могут.

15 Вопрос Отличие белков-ферментов от других катализаторов.
Важное свойство ферментов – способность специфически и очень эффективно влиять на скорость различных реакций, регулируя динамику жизненных процессов.
Особенности, отличающие белки-ферменты:
Биокатализаторы исключительно эффективные при оптимальных условиях. Большинство реакций протекает 1020 раз скорее, чем в отсутствие катализаторов.
Для большинства ферментативных реакций характерна высокая специфичность как в отношении природы катализируемой реакции, так и в отношении структуры субстрата.
Круг реакций, катализируемых ферментами широк. Белки –катализаторы с исключительно широким спектром действия, работают во всех метаболитеских процессах.
Активность самих ферментов в клетке строго регулируется скоростью синтеза ферментов и их конечная концетрация находится под генетическим контролем и регулируется с помощью малых молекул, которые часть являются субстратом или продуктами реакции. Ферменты могут быть в активной и не активной форме, причем скорость и степень их превращения в каждую форму зависит от свойств окружающей среды. Процесс биосинтеза ферментов катализируется тоже ферментами.
