
- •ВВЕДЕНИЕ
- •Тема 2. ОСНОВНЫЕ ЗАКОНЫ ХИМИИ
- •Оксиды
- •Кислоты
- •Соли
- •Тема 4. ЭНЕРГЕТИКА ХИМИЧЕСКИХ РЕАКЦИЙ
- •Тема 5. ТЕРМОХИМИЧЕСКИЕ РАСЧЕТЫ
- •Тема 7. ПОНЯТИЕ ОБ ЭНТРОПИИ
- •Тема 9. СМЕЩЕНИЕ ХИМИЧЕСКОГО РАВНОВЕСИЯ
- •Тема 13. РАСТВОРЫ ЭЛЕКТРОЛИТОВ
- •Тема 15. ВОДОРОДНЫЙ ПОКАЗАТЕЛЬ
- •Тема 16. ГИДРОЛИЗ СОЛЕЙ
- •Тема 17. ПРОИЗВЕДЕНИЕ РАСТВОРИМОСТИ
- •Тема 20. ТЕОРИИ КИСЛОТ И ОСНОВАНИЙ
- •Гальванические элементы
- •Тема 23. ЭЛЕКТРОЛИЗ
- •Кислотно-основные свойства соединений
- •Тема 32. ТЕОРИЯ КРИСТАЛЛИЧЕСКОГО ПОЛЯ
- •ЛИТЕРАТУРА
Тема2. ОСНОВНЫЕ ЗАКОНЫ ХИМИИ
Закон сохранения массы веществ (М. В. Ломоносов, 1748 г.;
А. Лавуазье, 1789 г.): масса всех веществ, вступивших в химическую реакцию, равна массе всех продуктов реакции.
С точки зрения атомно-молекулярного учения закон сохранения массы объясняется так: в результате химических реакций атомы не исчезают и не возникают, а происходит их перегруппировка. Так как число атомов до реакции и после остается неизменным, то их общая масса также не изменяется.
Закон постоянства состава (Ж. Пруст, 1808 г.): все индивиду-
альные химические вещества молекулярного строения имеют постоянный качественный и количественный состав и определенное химическое строение независимо от способа получения.
Из закона постоянства состава следует, что химические элементы соединяются в определенных количественных соотношениях.
Например, углерод с кислородом образует соединения с различным массовым соотношением элементов углерода и кислорода:
СО (m(С) : m(О) = 3 : 4); СО2 (m(С) : m(О) = 3 : 8). Ни в каких других отношениях углерод с кислородом не соединяются. Это значит, что
соединения СО и СО2 имеют постоянный состав, который определяется степенями окисления углерода в соединениях.
Закон постоянства состава строго выполняется для веществ молекулярного строения (исключения – высокомолекулярные соединения, состоящие из молекул разной длины) и имеет ограниченное применение для немолекулярных веществ.
Ввеществах немолекулярного строения нельзя выделить отдель-
ные молекулы. Например, для оксида железа(II) FeO закон постоянства состава требует, чтобы число ионов Fe2+ точно равнялось числу ионов O2–. В идеальном кристалле должно сохраняться чередование Fe2+
O2– Fe2+ O2– и т. д.
Вреальном кристалле неизбежны нарушения регулярности. Оксид железа(II) может содержать измененное количество кислорода в зависимости от условий получения. Реальный состав оксида выража-
ется формулой Fe1 – хO, где 0,16 ≥ х ≥ 0,04. Это бертоллид, соединение переменного состава в отличие от дальтонидов с х = 0. При нестехио-
метрическом составе ионного соединения обеспечивается электронейтральность. Вместо отсутствующих ионов Fe2+ присутствуют Fe3+.
13
Зная количественный элементный состав соединения, можно установить его простейшую молекулярную формулу. При установлении простейшей молекулярной формулы:
1)обозначают формулу соединения Ax By Cz;
2)рассчитываютотношениеx : y : z черезмассовые долиэлементов:
ω(A) = |
х Ar (А) |
; ω(B) = |
y Ar (B) |
; ω(C) = |
z Ar (С) |
; |
Mr (AхByCz ) |
M r (AхByCz ) |
Mr (AхByCz ) |
x = |
ω(А) Мr |
; y = ω(B) Мr |
; z = ω(С) Мr |
; |
||||||
|
А (A) |
|
|
А (B) |
|
|
А (С) |
|
||
|
r |
|
|
r |
|
|
|
|
r |
|
|
x : y : z = |
ω(А) |
: |
ω(B) |
|
: |
ω(С) |
; |
|
|
|
А (A) |
А (B) |
А (С) |
|
||||||
|
|
|
|
|
|
|
||||
|
|
|
r |
|
r |
|
|
r |
|
|
3)чтобы определить x, y, z, полученные цифры делят на наименьшее из них и при необходимости удваивают (утраивают);
4)записывают формулу соединения.
Закон кратных отношений (Д. Дальтон, 1803 г.): если два хими-
ческих элемента дают несколько соединений, то массовые доли одного и того же элемента в этих соединениях, приходящиеся на одну и ту же массовую долю второго элемента, относятся между собой как небольшие целые числа. Например, для оксидов азота
N2O |
N2O3 |
NO2(N2O4) |
N2O5 |
число атомов кислорода в молекулах, приходящиеся на два атома азота, относятсямеждусобойкак1 : 3 : 4 : 5.
Эквивалент – реальная или условная частица, которая в данной кислотно-основной реакции, реакции ионного обмена равноценна одному молю атомарного (одному молю ионов) водорода или в окисли- тельно-восстановительной реакции – одному молю электронов.
Фактор эквивалентности fэкв(Х) – число, обозначающее долю реальной или условной частицы, которая в реакции ионного обмена равноценна одному молю атомарного (одному молю ионов) водорода или в окислительно-восстановительной реакции – одному молю элек-
тронов. Фактор эквивалентности (fэкв = 1z ) может равняться единице или быть меньше ее (таблица).
Например, fэкв(ZnCl2) = 12 (эквивалентом ZnCl2 является 12 моля хлорида цинка), fэкв(НCl) = 1, fэкв(Н3РО4) = 13 .
14
Таблица
|
|
|
Расчет фактора эквивалентности |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
Частица |
|
Фактор эквивалентности |
|
Примеры |
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||
Элемент |
|
|
fэкв |
= |
|
|
1 |
|
, |
|
|
|
|
|
fэкв(Mg) = 1 |
; fэкв(Al) = |
1 |
||||||||||||||||||||
|
|
|
|
В(Э) |
|
|
|
|
|
3 |
|||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
где В(Э) – валентность элемента |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
Простое |
|
|
fэкв = |
|
|
|
|
1 |
|
|
|
|
|
|
, |
|
fэкв(H2) = |
|
|
1 |
|
|
|
= |
|
|
1 |
|
|
||||||||
вещество |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
n(Э) В(Э) |
|
|
|
2 1 |
2 |
|
|
||||||||||||||||||||||||||||
|
где n(Э) – число атомов элемента (ин- |
fэкв(O2) = |
|
|
1 |
|
|
|
= |
|
1 |
|
|
||||||||||||||||||||||||
|
декс в химической формуле), В(Э) – |
|
2 2 |
|
4 |
|
|
||||||||||||||||||||||||||||||
|
валентность элемента |
|
|
|
|
|
|
|
|
|
|
fэкв(Cl2) = |
|
|
1 |
|
|
= |
1 |
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 1 |
2 |
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
fэкв(O3) = |
|
|
|
|
|
|
1 |
|
|
= |
|
|
1 |
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3 |
2 |
6 |
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
Оксид |
|
|
fэкв = |
|
|
|
|
1 |
|
|
|
|
|
|
, |
|
fэкв(Cr2O3) = |
1 |
|
|
= 1 |
|
|
||||||||||||||
|
|
|
n(Э) |
В(Э) |
|
2 |
3 |
|
|
||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
6 |
|
|
||||||||||||||||||||||
|
где n(Э) – число атомов элемента (ин- |
fэкв(CrO) = |
|
|
|
|
1 |
|
|
|
= |
1 |
|
|
|||||||||||||||||||||||
|
|
|
1 2 |
|
2 |
|
|
||||||||||||||||||||||||||||||
|
декс в химической формуле оксида), |
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||
|
В(Э) – валентность элемента |
|
fэкв(H2O) = |
|
|
|
|
|
1 |
|
|
|
|
= |
1 |
|
|
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 1 |
|
|
2 |
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
fэкв(P2O5) = |
|
|
|
|
|
1 |
|
|
= |
|
1 |
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 5 |
10 |
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
Кислота |
|
|
fэкв = |
|
|
1 |
|
|
|
, |
|
|
|
fэкв(H2SO4) = 1 |
= 1 |
|
|
||||||||||||||||||||
|
|
|
n(Н+ ) |
|
|
|
|
||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
||||||||||||
|
где n(H+) – число отданных в ходе ре- |
(основность равна 1) или |
|||||||||||||||||||||||||||||||||||
|
акции ионов водорода (основность ки- |
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
||||||||||||||||||
|
fэкв(H2SO4) = 2 |
|
|
|
|
||||||||||||||||||||||||||||||||
|
слоты) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(основность равна 2) |
|||||||||||||||||||
Основание |
|
|
fэкв = |
|
|
|
1 |
|
|
|
|
, |
|
|
|
fэкв(Cu(OH)2) = |
1 |
|
|
= 1 |
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|||||||||||||||||||||
|
|
|
|
|
n(ОН− ) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
где n(ОH–) – число отданных в ходе |
(кислотностьравна1) или |
|||||||||||||||||||||||||||||||||||
|
реакции гидроксид-ионов (кислот- |
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
||||||||||||||||||||
|
fэкв(Cu(OH)2) = 2 |
|
|
||||||||||||||||||||||||||||||||||
|
ность основания) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(кислотностьравна2) |
|||||||||||||||||||
Соль |
fэкв |
= |
1 |
|
|
|
|
|
|
= |
|
|
|
1 |
, |
fэкв(Cr2(SO4)3) = |
|
1 |
|
|
|
= |
1 |
||||||||||||||
|
n(Ме) В(Ме) |
|
|
|
n(А) В(А) |
|
2 3 |
6 |
|||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
|
где n(Ме) – число атомов металла (ин- |
(расчет по металлу) или |
|||||||||||||||||||||||||||||||||||
|
декс |
в |
химической |
|
формуле соли), |
fэкв(Cr2(SO4)3) = |
1 |
|
|
|
= |
1 |
|||||||||||||||||||||||||
|
В(Ме) – валентность металла; n(А) – |
|
|
|
6 |
||||||||||||||||||||||||||||||||
|
|
3 2 |
|||||||||||||||||||||||||||||||||||
|
число кислотных остатков, В(А) – за- |
(расчет по кислотному |
|||||||||||||||||||||||||||||||||||
|
ряд кислотного остатка |
|
|
|
|
|
|
|
|
остатку) |
|
|
|
|
|
|
|
|
|
||||||||||||||||||
15
|
|
|
|
|
|
|
|
Окончание таблицы |
||||||
|
|
|
|
|
|
|
|
|
|
|
||||
Частица |
Фактор эквивалентности |
Примеры |
|
|
|
|
||||||||
Частица в |
fэкв = |
1 |
, |
Fe2+ + 2е– = Fe0 |
|
|
||||||||
окислительно- |
|
n е − |
fэкв(Fe |
2+ |
) = |
1 |
|
|
|
|||||
восстанови- |
где nе– – число электронов, участ- |
|
2 |
– |
|
|
||||||||
тельных |
вующих в процессе окисления или |
− |
|
+ |
|
= |
|
|||||||
реакциях |
MnO 4 + 8Н + 5е |
|
|
|||||||||||
восстановления |
|
|
|
|
|
|
= Mn2+ + 4H2O |
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
fэкв(MnO 4− ) = 1 |
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
5 |
|
|
|
Ион |
fэкв = |
1 |
|
|
, |
fэкв(SO 42− ) = |
1 |
|
|
|
||||
|
|
|
z |
|
|
2 |
|
|
|
|||||
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
где z – заряд иона |
|
|
|
|
|
|
|
|
|
|
|
|
|
Как видно из таблицы, фактор эквивалентности некоторых веществ имеет различные значения и зависит от реакции, в которой участвует соединение, например:
NaOH + H3PO4 → NaH2PO4 + H2O, fэкв(Н3РО4) = 1;
2NaOH + H3PO4 → Na2HPO4 + 2H2O, fэкв(Н3РО4) = 12 .
Эквивалент, как частица, может быть охарактеризован молярной массой и определенным количеством вещества nэкв. Молярная масса эквивалента (Мэкв) – это масса одного моля эквивалента. Она равна произведению молярной массы вещества на фактор эквивалентности:
Мэкв = М fэкв.
Молярная массаэквивалентаимеетразмерностьг/моль, например:
|
М( |
1 H2SO4) = |
1 |
|
М(H2SO4) = |
1 |
98 = 49 г/моль; |
|||||||
|
|
|
|
2 |
2 |
M (Са(OH)2 ) |
|
|
2 |
|
|
|||
М( |
1 |
Са(ОН)2) = |
= |
1 |
74 = 37 г/моль; |
|||||||||
2 |
2 |
|
2 |
|||||||||||
|
|
|
|
|
|
|
|
|
|
|||||
|
1 |
|
|
|
|
|
|
M (Al2 (SO4 ) |
) |
|
|
1 |
|
|
М( |
|
Al 2+3 (SO4)3) = |
|
3 |
|
|
= |
|
342 = 57 г/моль. |
|||||
6 |
6 |
|
|
|
6 |
|||||||||
|
|
|
|
|
|
|
|
|
|
|
||||
Газообразные вещества помимо молярной массы эквивалента имеют молярный объем эквивалента (Vm экв или Vэкв) – объем, зани-
маемый молярной массой эквивалента, или объем одного моля эквивалента. Размерность – л/моль. При н. у. получаем:
Vm экв = fэкв Vm = fэкв 22,4.
16

Закон эквивалентов (И. Рихтер, 1792 г.): массы реагирующих друг с другом веществ, а также массы продуктов реакции пропорциональны молярным массам эквивалентов этих веществ:
m |
|
Мэкв(1) |
|
1 |
= |
|
|
m2 |
Мэкв(2) |
||
|
Все вещества в уравнении реакции связаны законом эквивалентов, поэтому
nэкв(реагента1) = … = nэкв(реагентаn) = = nэкв(продукта1) = … = nэкв(продуктаn).
Закон эквивалентов можно сформулировать в следующем виде: моль эквивалента одного вещества реагирует с одним молем эквивалента другого вещества. Например, в реакции
Mg(OH)2 + H3PO4 → MgНPO4 + 2H2O
два моля эквивалентов Mg(OH)2 взаимодействуют с двумя молями эквивалентов H3PO4 с образованием двух молей эквивалентов MgНPO4.
Пример 1. Определить молярную массу эквивалента Mg, зная, что 3 весовых части магния соединяются с 2 весовыми частями О.
Решение. Mэкв(Mg) определим исходяиз значения Мэкв(О) = 8 г/моль. 3 г Mg реагируют с 2 г О,
Мэкв (Mg) реагирует с 8 г О.
Мэкв (Mg) = 328 = 12 г/моль.
Пример 2. CaCl2 содержит 36% Са и 64% Cl. Определить молярную массу эквивалента кальция, зная, что молярная масса эквивалента хлора равна 35,5 г/моль.
Решение.
36 г Са реагируют с 64 г Cl, Мэкв (Са) реагирует с 35,5 г Cl.
Мэкв (Са) = 36 35,5 = 20 г/моль. 64
Физическое состояние газа определяют три параметра: Р – давление, V – объем, Т – температура.
В научных исследованиях используются две шкалы измерения тем-
ператур: абсолютная шкала (Кельвина) и температурная шкала Цель-
сия. Переводтемпературыизшкалы Цельсияв абсолютнуюшкалу:
Т (К) = 273,15 + t°С, или приближенно Т (К) ≈ 273 + t°С.
17
Нормальные условия для газов (н. у.): давление 1,013 105 Па (1 атм = 760 мм рт. ст.), температура 273,15 К (0○С).
Закон Авогадро: в равных объемах (V) различных газов при одинаковых условиях (температуре Т и давлении Р) содержится одинаковое число молекул.
Следствия из закона Авогадро.
Следствие 1: одинаковое число молекул различных газов при одинаковых условиях (Р, Т) занимают одинаковый объем.
Следствие 2: при нормальных условиях (T = 273,15 К, P = 1 атм (1,013 105 Па) 1 моль любого газа занимает объем 22,4 л. Молярный
объем любого газа при нормальных условиях Vm = 22,4 л/моль. Молярный объем газа Vm – величина, равная отношению объема
определенной порции газа V(X) к химическому количеству вещества
n(X) этой порции газа: |
|
Vm = V (X ) |
, откуда n(Х) = V (X ) . |
n(X ) |
Vm |
Следствие 3: относительная плотность одного газа X по другому Y равна отношению их молярных масс М при заданных давлении и температуре:
DY(Х) = M (X ) ,
M (Y )
где DY(Х) – относительная плотность газа X по газу Y, М(X) и М(Y) – их молярные массы.
Например, плотность некоторого газа по водороду и по воздуху:
D ( X ) = |
M (X ) |
= M (X ) |
, Dвозд(Х) = M( X ) = M (X ) . |
|
M (H2 ) |
||||
H2 |
2 |
Mвозд 29 |
||
|
|
|
Пример 3. Какой объем водорода при н. у. выделится в результате растворения 4,8 г магния в избытке соляной кислоты?
Решение.
Mg + 2HCl = MgCl2 + H2↑.
При растворении 24 г (1 моль) магния в HCl выделяется 22,4 л (1 моль) водорода; при растворении 4,8 г магния – х л водорода.
х = 4,8 22,4 = 4,48 л водорода. 24
Пример 4. 3,17 г хлора занимают объем, равный 1 л (н. у.). Вычислить молярную массу хлора.
18

Решение. Находим массу 22,4 л хлора: 1 л – 3,17 г хлора; 22,4 л – х г хлора.
х = 3,17 22,4 = 71 г.
Следовательно, молярная масса хлора равна 71 г/моль.
Пример 5. Плотность некоторого газообразного вещества по водороду равна 17. Чему равна его плотность по воздуху (М(возд.) = 29)?
Решение. D (в-ва) = |
M (в-ва) . |
|
|
|
|||
|
H2 |
M (H2 ) |
|
|
|
||
|
|
|
|
|
|
|
|
М(в-ва) = 2D (в-ва) = 2 · 17 = 34 г/моль. |
|||||||
|
|
H2 |
|
|
|
|
|
Dвозд(в-ва) = |
|
M(в-ва) |
|
= M(в-ва) |
= |
34 |
= 1,17. |
|
M(возд.) |
29 |
|||||
|
|
29 |
|
|
|||
Пример 6. Определить плотность по воздуху смеси азота, аргона и углекислого газа, если массовые доли компонентов составляют 15, 50 и 35% соответственно.
Решение. Dвозд(смеси) = |
M(смеси) = M(смеси) . |
|
|
|
M(возд.) |
29 |
|
M(смеси) = 15 28 + 50 40 + 35 44 = |
420 + 2000 +1540 |
= 39,6 г/моль. |
|
100 |
|
100 |
|
Dвозд(смеси) = M(смеси) = 39,6 = 1,37. |
|
||
29 |
29 |
|
|
Молярную массу газа можно определить, умножив плотность
(г/л) на 22,4 л/моль.
Если плотность Н2 при н. у. ρ(Н2) = 0,089 г/л, то его молярная
масса М(Н2) = ρ Vm = 0,089 г/л 22,4 л/моль = 2 г/моль.
При нормальных условиях физическую плотность можно определить по формуле
ρ = M , г/л.
Vm
Средняя молярная масса смеси газов равна общей массе смеси, деленной на общее число молей:
Mср = m1 + ... + mn . n1 + ... + nn
Если учесть, что объемная доля (φ) газообразного компонента А в системе равна
19
φ(А) = |
V (А) |
= |
n(А) |
, |
|
V (сист.) |
n(сист.) |
||||
|
|
|
то средняя молярная масса смеси газов
Mср = M1 φ1 + ... + Mn φn.
Закон объемных отношений (Гей-Люссак, 1808 г.): объемы га-
зов, вступающих в химические реакции, и объемы газов, образующихся в результате реакции, относятся между собой как небольшие целые числа.
Следствие: стехиометрические коэффициенты в уравнениях химических реакций для молекул газообразных веществ показывают, в каких объемных отношениях реагируют или получаются газообразные вещества.
Пример 7. Рассмотрим реакцию
2CO + O2 = 2CO2.
При окислении двух объемов оксида углерода(II) одним объемом кислорода образуется 2 объема оксида углерода(IV), т. е. объем исходной реакционной смеси уменьшается на 1 объем.
Пример 8. При синтезе аммиака из простых веществ: N2 + 3H2 = 2NH3,
один объем азота реагирует с тремя объемами водорода; при этом образуется 2 объема аммиака – объем исходной газообразной реакционной массы уменьшится в 2 раза.
Объединенный газовый закон: для данной массы газа произведение давления на объем, деленное на абсолютную температуру, есть величина постоянная:
PV |
= сonst или |
P1V1 |
= |
P2V2 |
, |
|
T |
T |
T |
||||
|
|
|
||||
|
|
1 |
|
2 |
|
где индексы 1 и 2 определяют разные физические условия.
Точное значение постоянной (сonst) зависит от количества газа. Если количество газа равно одному молю, то соответствующая постоянная обозначается буквой R и называется «молярная газовая постоянная» или «универсальная газовая постоянная». Если давление выражено в паскалях (Па), постоянная R имеет значение
R = 8,314 Дж/(моль К).
Если Р – атм, V – л, R = 0,082 (л атм)/(моль К).
20

Объединенный газовый закон для одного моля газа приобретает вид PTVm = R, где Vm – объем одного моля газа. Для n молей газа получаем уравнение
PV |
= nR или PV = nRT; |
||
T |
|
|
|
|
PV = |
m |
RT, |
|
M |
||
|
|
|
|
где Р – давление; V – объем; T – абсолютная температура (К); R – универсальная газовая постоянная; m – масса газа; M – молярная масса. В такой форме объединенный газовый закон называется уравнением со-
стояния идеального газа или уравнением Менделеева – Клапейрона.
Единицы измерения в системе СИ: Р – Па, V – м3, n – число моль, Т – К,
m – кг, М – кг/моль, R = 8,314 Дж/(моль К).
Газ, который полностью подчиняется уравнению Менделеева – Клапейрона, называется идеальным газом. Такой газ не существует в действительности. Реальные газы хорошо подчиняются уравнению состоянияидеальногогазапринизкихдавленияхивысокихтемпературах.
21
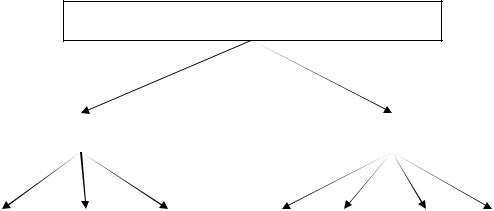
Тема3. ОСНОВНЫЕ КЛАССЫ
НЕОРГАНИЧЕСКИХ ВЕЩЕСТВ
Основными классами неорганических соединений являются оксиды, основания, кислоты и соли.
Неорганические вещества
Простые |
|
Сложные |
|
|
|
Металлы |
|
Металлоиды |
|
Неметаллы |
|
Оксиды |
|
Основания |
|
Кислоты |
|
Соли |
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Химическая номенклатура
В настоящее время практически все химические издания используют номенклатуру, разработанную Международным союзом теоретической и прикладной химии – ИЮПАК (IUPAС). В английском варианте Правил IUPAC названия веществ строятся «по ходу формул» (например, KCl – калия хлорид, H2S – водорода сульфид), что не согласуется с правилами русского литературного языка. В соответствии с традицией, существующей в русском химическом языке, используется вариант номенклатуры с «обратным» чтением формул (например, NaCl – хлорид натрия, CaS – сульфид кальция). Порядок расположения элементов в формуле основывается на их положении в периодической системе и электроотрицательности неметаллов. В формуле соединения электроотрицательные части располагаются по возрастанию электроотрицательности неметаллов: Rn, Xe, Kr, B, Ge, Si, C, Sb, As, P, H, Te, Se, S, At, I, Br, Cl, N, O, F (например, PICl2, а не PCl2I). Катион всегда ставитсяв формуленапервое место(слева), анион– навторое.
22
