
- •ВВЕДЕНИЕ
- •Тема 2. ОСНОВНЫЕ ЗАКОНЫ ХИМИИ
- •Оксиды
- •Кислоты
- •Соли
- •Тема 4. ЭНЕРГЕТИКА ХИМИЧЕСКИХ РЕАКЦИЙ
- •Тема 5. ТЕРМОХИМИЧЕСКИЕ РАСЧЕТЫ
- •Тема 7. ПОНЯТИЕ ОБ ЭНТРОПИИ
- •Тема 9. СМЕЩЕНИЕ ХИМИЧЕСКОГО РАВНОВЕСИЯ
- •Тема 13. РАСТВОРЫ ЭЛЕКТРОЛИТОВ
- •Тема 15. ВОДОРОДНЫЙ ПОКАЗАТЕЛЬ
- •Тема 16. ГИДРОЛИЗ СОЛЕЙ
- •Тема 17. ПРОИЗВЕДЕНИЕ РАСТВОРИМОСТИ
- •Тема 20. ТЕОРИИ КИСЛОТ И ОСНОВАНИЙ
- •Гальванические элементы
- •Тема 23. ЭЛЕКТРОЛИЗ
- •Кислотно-основные свойства соединений
- •Тема 32. ТЕОРИЯ КРИСТАЛЛИЧЕСКОГО ПОЛЯ
- •ЛИТЕРАТУРА
Малликен предложил определять электроотрицательность (χ) как полусумму энергий ионизации (Еи) и сродства к электрону (Ее_):
χ = Еи + Ее− . 2
Значения электроотрицательности, полученные разными способами, не совпадают, однако общие тенденции их изменения по периодической системе сохраняются. Электроотрицательность служит мерой неметалличности элемента: чем больше χ, тем сильнее элемент проявляет неметаллические свойства.
Пользуясь значениями электроотрицательности, можно определить направление перехода электронов в различных реакциях. Так, в реакции между водородом и фтором
H2 + F2 = 2HF
водород будет восстановителем, а фтор – окислителем, так как χH < χF.
Кислотно-основные свойства соединений
Свойства оксидов и гидроксидов элементов зависят главным образом от заряда и радиуса центрального атома. С ростом положительного заряда (точнее, степени окисления) центрального атома кислотный характер этих соединений становится более выраженным:
Na+ |
Mg2+ |
Al3+ |
Si4+ |
P5+ |
S6+ |
Cl7+ |
Na2O |
MgO |
Al2O3 |
SiO2 |
P2O5 |
SO3 |
Cl2O7 |
NaOH |
Mg(OH)2 |
Al(OH)3 |
H2SiO3 |
H3PO4 |
H2SO4 |
HClO4 |
основные |
амфотерные |
|
кислотные |
|
||
Сверху вниз в подгруппе кислотные свойства оксидов и гидроксидов элементов ослабевают, а основные – усиливаются, например:
B3+ |
H3BO3 |
слабая кислота |
Al3+ |
Al(OH)3 |
амфотерные |
Ga3+ |
|
|
Ga(OH)3 |
гидроксиды |
|
In3+ |
In(OH)3 |
|
Tl3+ |
Tl(OH)3 |
более выражены основные свойства |
211
Тема29.КОВАЛЕНТНАЯ СВЯЗЬ.
МЕТОД ВАЛЕНТНЫХ СВЯЗЕЙ
Ковалентная связь
Атомы объединяются в молекулы при возникновении между ними химических связей.
Образование химического соединения (молекулы, сложного иона и др.) происходит потому, что оно более энергетически устойчиво, чем состояние отдельных атомов. Природа химической связи объясняется взаимодействием электрических полей, электронов и ядер атомов, участвующих в образовании химического соединения. В зависимости от характера распределения электронной плотности между взаимодействующими атомами различают три основных типа химической связи: ковалентную, ионную, металлическую (табл. 29.1).
Таблица 29.1
Типы химических связей и их основные отличительные признаки
Химиче- |
Связываемые |
Процесс |
Образующиеся |
Кристал- |
|
|
вэлектронной |
лическая |
Примеры |
||||
скаясвязь |
атомы |
оболочке |
частицы |
решетка |
|
|
|
|
|
|
|||
Ионная |
Атом металла |
Переход |
ва- |
Положительные |
Ионная |
NaCl, CaO, |
|
и атом неме- |
лентных элек- |
и отрицательные |
|
NaOH |
|
|
талла |
тронов |
|
ионы |
|
|
Ковлент- |
Атомы неме- |
Образование |
Молекулы |
Молекляр- |
Br2, CO2, |
|
ная |
таллов |
общих |
элек- |
|
ная |
C6H6 |
|
|
тронныхпар |
Атомы |
Атомная |
Алмаз, Si, |
|
|
|
|
|
|
|
SiC |
Металли- |
Атомы метал- |
Обобществле- |
Положительные |
Металличе- |
Металлы |
|
ческая |
лов |
ние валентных |
ионы и электрон- |
ская |
исплавы |
|
|
|
электронов |
ныйгаз |
|
|
|
Ковалентная связь – связь, образованная общими электронными парами атомов.
Для описания химических связей в любых молекулах в настоящее время наибольшее распространение получили полуэмпирические методы– метод валентных связей (ВС) и метод молекулярных орбиталей(МО). Восновеэтихметодовлежатпредставленияквантовоймеханики.
Метод валентных связей (ВС)
В 1916 г. американский ученый Льюис высказал предположение о том, что химическая связь образуется за счет обобществления двух
212
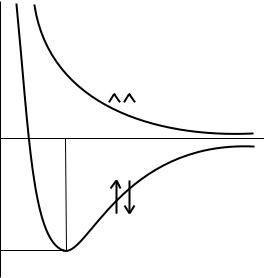
электронов. При этом электронная оболочка атома стремится по строению к электронной оболочке благородного газа. В дальнейшем эти предположения послужили основой для развития метода валентных связей. В 1927 г. Гайтлером и Лондоном был выполнен теоретический расчет энергии двух атомов водорода в зависимости от расстояния между ними. Оказалось, что результаты расчета зависят от того, одинаковы или противоположны по знаку спины взаимодействующих электронов. При совпадающем направлении спинов сближение атомов приводит к непрерывному возрастанию энергии системы. При противоположно направленных спинах на энергетической кривой имеется минимум, т. е. образуется устойчивая система – молекула водорода Н2 (рис. 29.1).
E
E0 |
r0 |
|
r |
||
|
E1
Рис. 29.1. Зависимость энергии от расстояния между атомами водорода при одинаково и противоположно направленных спинах
Межъядерное расстояние r0, соответствующее минимуму, называется длиной связи, а энергия связи равна глубине потенциальной ямы E0 – E1, где Е0 – энергия двух невзаимодействующих атомов, находящихся на бесконечном расстоянии друг от друга.
Образование химической связи между атомами водорода является результатом взаимопроникновения (перекрывания) электронных облаков. Вследствие этого перекрывания плотность отрицательного заряда в межъядерном пространстве возрастает, и положительно заряженные ядра притягиваются к этой области. Такая химическая связь называется ковалентной.
213
Основные положения метода ВС:
1.Ковалентная связь образуется между двумя атомами за счет взаимодействия электронных орбиталей с антипараллельными спинами электронов.
2.Связь располагается в направлении, обеспечивающем наибольшую степень перекрывания электронных орбиталей.
3.Ковалентная связь тем прочнее, чем более полно перекрываются электронные орбитали.
Различают следующие механизмы образования ковалентной связи: обменный (спин-валентный) и донорно-акцепторный.
Обменный (спин-валентный) механизм образования ковалентной связи – механизм, по которому каждый из связываемых атомов предоставляет для ее образования по одному неспаренному электрону. Его можно выразить следующей схемой:
+  =
=
Примеры образования связей по обменному механизму:
HF (H F) |
2s |
2p |
NH 3 |
2s |
2p |
|
|
|
|
|
|||
F |
|
|
N |
|
|
|
|
|
H |
|
H |
H |
H |
|
|
1s |
|
1s |
1s |
1s |
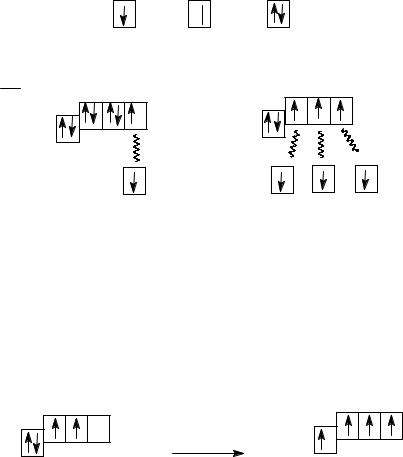
В приведенных примерах электронные пары ковалентной связи получаются из неспаренных электронов атомов. Но, например, у атома углерода только два неспаренных электрона, и он может образовать только две ковалентные связи по обменному механизму. Если атом углерода возбудить, т. е. сообщить ему некоторую дополнительную энергию, то один из 2s-электронов может перейти на свободную 2р-орбиталь:
|
2p |
2s |
2p |
|
2 s |
|
|
C |
возбуждение |
* |
|
|
C |
|
Неспаренных электронов у атома углерода станет уже четыре. В этом состоянии углерод может образовать четыре ковалентные связи, например, с атомами водорода или кислорода:
214

|
|
2p |
CO2 |
|
2s |
|
2p |
CH4 |
2s |
|
|
|
|||
|
|
* |
|
|
|
||
C* |
|
|
|
C |
|
|
|
|
|
|
|
|
|
|
|
H |
H H |
H |
O |
|
|
O |
2p |
|
|
|
|||||
|
|
1s |
|
2p |
|
|
2 s |
1s |
1s |
1s |
2s |
|
|
|
|
|
|
|
|
При образовании четырех ковалентных связей выделяется больше энергии, чем при образовании только двух ковалентных связей. Избытка энергии в данном случае вполне достаточно, чтобы компенсировать затраты на возбуждение атома углерода.
Не только атомы углерода склонны образовывать ковалентные связи в возбужденном состоянии, но и другие атомы, у которых есть неподеленные пары валентных электронов и свободные валентные орбитали, например атомы бериллия, бора, кремния, фосфора.
Второй механизм образования ковалентной связи, называемый до- норно-акцепторным, приводит к образованию химической связи за счет предоставления одним атомом в общее пользование пары электронов, а другим – свободной орбитали. Атом, предоставляющий электронную пару, называется донором, а атом, имеющий свободную орбиталь, – акцептором. Схема образования связи в этом случае выглядит так:
+ 
 =
=
Например, молекула аммиака за счет электронной пары азота может образовать четвертую связь с элементом, имеющим вакантную
орбиталь:
NH3 + H+ = NН+4 .
2p
2s N
N 



H+ 



 1s H 1s H 1s H 1s
1s H 1s H 1s H 1s
В случае дативной связи оба атома либо обе частицы одновременно выступают в роли и донора, и акцептора электронов.
Электронные облака атомов имеют различную форму, их взаимное перекрывание может осуществляться разными способами. В зави-
215
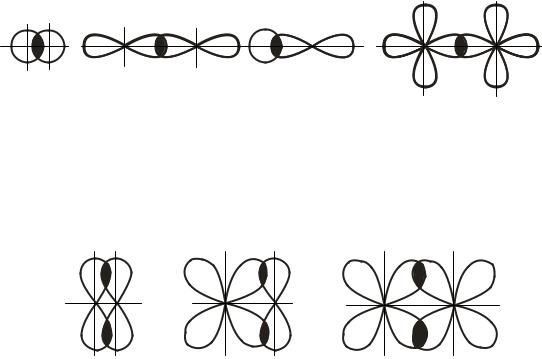
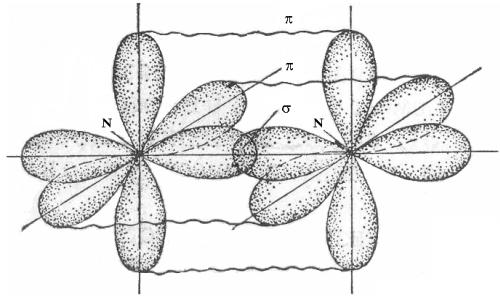
симости от способа перекрывания и симметрии образующегося облака различают σ- (сигма), π- (пи) и δ- (дельта) связи.
σ-Связи образуются при перекрывании облаков по линии, соединяющей ядра атомов (рис. 29.2).
|
|
|
|
|
|
– |
|
– |
+ + |
– |
+ + |
– |
+ + |
– |
+ |
+ + |
+ |
|
|
|
|
|
|
– |
|
– |
s-s |
|
р-p |
|
|
s-p |
|
d-d |
|
|
|
|
Рис. 29.2. Примеры σ-связи |
|
|
|
||
π-Связи образуются при перекрывании электронных облаков по обе стороны от линии, соединяющей ядра атомов (рис. 29.3). π-Связь менее прочна, чем σ-связь: перекрывание происходит диффузными боковыми частями орбиталей.
+ |
+ |
– |
+ |
+ |
+ |
+ |
– |
– |
– |
+ |
– |
– |
– |
– |
+ |
|
р-р |
|
d-р |
|
d-d |
|
|
Рис. 29.3. Примеры π-связи
Сравнение характеристик σ- и π-связи приведены в табл. 29.2.
|
Таблица 29.2 |
|
Основные характеристики σ- и π-связи |
||
|
|
|
σ-связь |
π-связь |
|
Одна область перекрывания |
Две области перекрывания |
|
Электронные облака перекрываются |
Электронные облака перекрываются |
|
частями с наибольшей электронной |
своими периферийными частями |
|
плотностью |
|
|
Перекрывание эффективное |
Перекрывание менее эффективное |
|
Связь прочная |
Связь менее прочная |
|
Химическая связь характеризуется следующими параметрами:
1)длиной связи – межъядерным расстоянием между двумя химически связанными атомами;
2)валентным углом – углом между воображаемыми линиями, проходящими через центры химически связанных атомов;
216
3)энергией связи – количеством энергии, затрачиваемой на ее разрыв в газообразном состоянии;
4)кратностью связи – числом электронных пар, посредством которых осуществляется химическая связь между атомами.
Так как π-связь между элементами может быть образована только после образования σ-связи, следовательно, π-связь возможна только в случае образования кратных связей (двойных и тройных).
Кратные связи короче и прочнее одинарных, поскольку осуществляются не одной, а двумя и тремя поделенными парами. Например, кислород может образовать двухатомную молекулу с октетом электронов у каждого атома только тогда, когда между атомами размещаются две электронные пары, у молекулы азота между атомами размещаются три электронные пары (рис. 29.4).
Рис. 29.4. Схема связей в молекуле N2
Ковалентная связь обладает насыщаемостью, направленностью и поляризуемостью.
Если электронная пара, связывающая в молекуле два одинаковых атома, в равной мере принадлежит обоим атомам, то в молекуле нет разделения центров тяжести положительного и отрицательного зарядов. Такая связь называется ковалентной неполярной. Для наглядного изображения ковалентной связи в химических формулах используются точки (каждая точка соответствует валентному электрону, две точки между элементами – электронной паре), а также черточки (чертой обозначают общую электронную пару).
217
Например, образование молекулы хлора можно изобразить так:
. |
.. |
|
.. .. .. |
|
||||
|
. |
|
. . . . |
или Сl–Cl |
||||
|
|
Cl |
+ Cl |
.Cl Cl |
||||
|
|
.. .. |
= .. .. |
|
||||
. |
|
|
|
. |
. |
. . |
|
|
|
|
|
|
|
|
|||
Формулы |
.. .. |
|
и Сl–Cl равнозначны. При образовании ковалент- |
|||||
Cl Cl |
||||||||
. |
. . |
|
|
|
||||
.. .. |
|
|
|
|
|
|||
. |
. . |
|
|
|
|
|||
ной связи реализуется тенденция атомов преобразовывать свой внеш-
ний электронный слой в октет. Оба атома предоставляют для образования ковалентной связи по одному неспаренному электрону, и эти электроны становятся общими для двух атомов хлора.
Ковалентная неполярная связь существует в молекулах одноэлементных газов: H2, O2, N2, Cl2 и др.
Если же электронная пара связывает два атома с различной электроотрицательностью, то она смещается в сторону более электроотрицательного атома.
Элементы с большей электроотрицательностью будут оттягивать общие электроны от элементов с меньшей электроотрицательностью. Центры тяжести положительного и отрицательного зарядов разделяются, связь становится полярной и носит название ковалентной полярной связи. Такая связь существует в молекулах HCl, H2O, NF3, CO2 и др. За счет смещения электронов от водорода к хлору атом хлора заряжается частично отрицательно (δ−), водорода − частично положительно (δ+):
. . . |
= H |
. . . . |
H. + . Cl. |
.Cl. |
|
. . |
|
. . |
При образовании химической связи между двумя элементами по разности электроотрицательностей этих элементов ( χ) можно судить о характере связи. Существует условная граница между ковалентной полярной и ионной связями. При разности электроотрицательностей менее 1,7 связь является ковалентной полярной. Если разность электроотрицательностей более 1,7, связь может считаться ионной.
Насыщаемость ковалентной связи обусловлена ограниченными валентными возможностями атомов, т. е. их способностью к образованию строго определенного числа связей. Общее число валентных орбиталей в атоме, т. е. тех орбиталей, которые могут быть использованы для образования химических связей, определяет максимально возможную валентность элемента. Число использованных для этого орбиталей определяет валентность элемента в данном соединении. Например, в соединении PCl3 фосфор трехвалентен, в соединении SiF4 кремний имеет валентность четыре:
218

3p |
|
3p |
3s |
|
|
3s |
|
|
Si |
|
|
P |
|
|
|
|
|
Cl Cl Cl |
F |
F F F |
|
Направленность ковалентной связи обусловливается тем, что электронные облака атомов имеют определенную конфигурацию – расположение в пространстве. Часто в образовании связи участвуют орбитали разных конфигураций. Для объяснения того, как неравноценные по исходному состоянию орбитали образуют равноценные химические связи используются представления о гибридизации валентных орбиталей. Гибридизация сопровождается изменением формы и энергии электронных облаков, которое происходит при поглощении энергии и ведет к образованию одинаковых по форме и энергии гибридных облаков (орбиталей). Понятно, что незначительные затраты энергии при таких изменениях окупаются при образовании равноценных связей. Гибридные орбитали изображают в виде неправильной сильно смещенной в одну сторону гантели  .
.
Например, образование BeCl2 с учетом электронного строения атомов бериллия и хлора выражается следующей схемой:
2s |
2p |
|
|
|
|
|
|
Be* |
|
|
|
3p |
|
|
|
3s |
|
|
|
Cl |
Cl |
|
3p |
|
|
3s |
|
|
|
|
|
Если бы один атом хлора |
связывался с бериллием за счет |
||
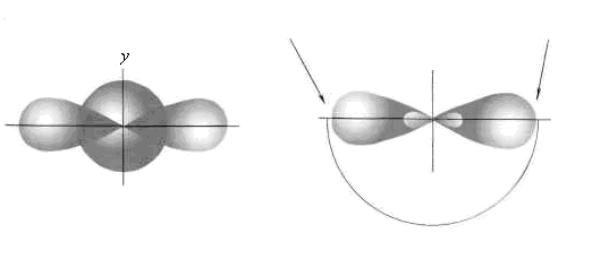
2s-, а другой – 2px-электрона бериллия, то связи Be–Cl не были бы равноценными. Однако на самом деле обе связи имеют одинаковую длину, прочностьирасположеныподуглом180°.
Для объяснения равноценности связей Be−Cl, используют концепцию о sp-гибридизации валентных атомных орбиталей бериллия. При гибридизации одна s-орбиталь и одна p-орбиталь атома бериллия как бы смешиваются и выравниваются по форме и энергии, давая две одинаковые sp-гибридные орбитали (рис. 29.5). Химическая связь, образуемая с участием электронов гибридных орбиталей, более прочная, чем связь с участиемчистыхs- иp-орбиталей.
219
|
|
места присоединения атомов Cl |
|
|
|
y |
|
y |
|
x |
x |
|
|
(s + px)-орбитали |
180° |
две sp-гибридные орбитали Рис. 29.5. sp-Гибридизация валентных орбиталей бериллия
Линейную форму имеют и все другие молекулы с sp-гибри- дизацией атомных орбиталей (табл. 29.3).
|
|
|
Типы гибридизации атомных орбиталей |
Таблица 29.3 |
||
|
|
|
|
|||
|
|
|
|
|
|
|
n |
m |
Тип |
Тип |
|
|
|
гибриди- |
Форма молекул |
|
Примеры |
|||
молекул |
|
|||||
|
|
|
зации |
|
|
|
2 |
0 |
AX2 |
sp |
Линейная |
|
BeH2, BeCl2 |
|
|
|
|
|
|
|
3 |
0 |
AX3 |
sp2 |
Плоскостная |
|
С2Н4, BF3 |
4 |
0 |
AX4 |
|
Тетраэдр |
|
CH4, SiCl4 |
|
|
|
sp3 |
|
|
|
3 |
1 |
AX3 |
Тригональная пирамида |
|
NH3, PCl3 |
|
2 |
2 |
AX2 |
|
Угловая |
|
H2O, SCl2 |
|
|
|
|
|
|
|
5 |
0 |
AX5 |
sp3d |
Тригонально-дипирамидальная |
|
PF5, Fe(CO)5 |
6 |
0 |
AX6 |
sp3d2 |
Октаэдр |
|
SF6, [SiF6]2– |
Примечание. n – число поделенных электронных пар; m – число неподеленных электронных пар.
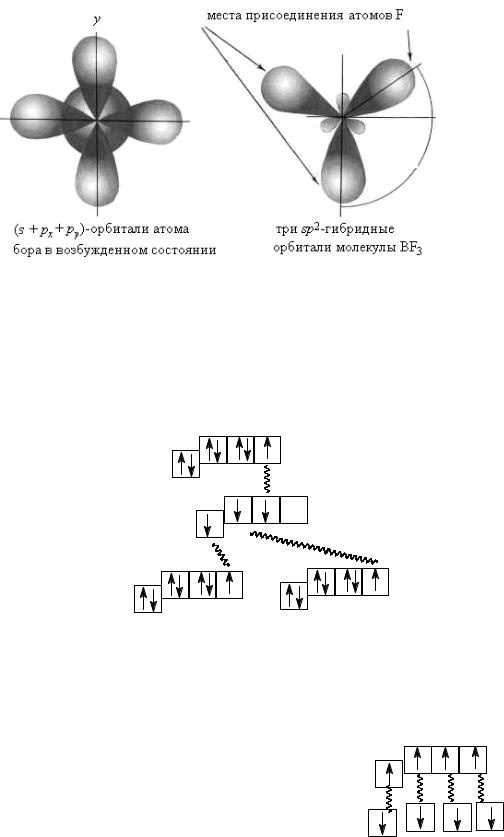
Если валентная оболочка центрального атома включает электроны на одной s-орбитали и двух p-орбиталях, имеет место sp2-гибри- дизация, дающая плоскостную геометрию молекулы.
Примером может служить sp2-гибридизация бора при образовании молекулы BF3 (рис. 29.6).
220
|
|
|
|
|
места присоединения атомов F |
y |
|
|
|
y |
|
|
|
x |
x |
120°
|
|
|
(s + px + py)-орбитали атома |
три sp2-гибридные |
|
бора в возбужденном состоянии |
|
орбитали молекулы BF3 |
|
|
|
Рис. 29.6. sp2-Гибридизация валентных орбиталей бора
Электронная конфигурация валентной оболочки бора 2s22р1. При образовании химической связи бор переходит в возбужденное состояние и образует три связи по обменному механизму с атомами фтора. Образование BF3 с учетом электронного строения атомов происходит по следующей схеме:
|
2p |
|
|
2s |
|
|
F |
|
|
2p |
|
|
2s |
|
|
B* |
|
|
2p |
|
|
2s |
|
F |
F |
2p |
|
|
2s |
При образовании химических связей в молекуле ВF3 одна s- и две p-орбитали гибридизуются.
Когда смешиваются одна s- и три p-орбитали, возникают sp3-гибри- дизованныеорбитали, имеющиегеометриютетраэдра.
Примером может служить соединение СН4. |
2p |
Электронная конфигурация валентной оболочки |
2s |
атома углерода 2s22р2, а атома водорода − 1s1. При |
C* |
образовании химической связи углерод переходит |
|
в возбужденное состояние. При этом на внешнем |
H 1s H 1s H 1s H 1s |
электронном уровне у атома углерода образуется |
221

четыре неспаренных электрона. Образование химических связей между атомами углерода и водорода в молекуле СН4 происходит по обменному механизму. При образовании химических связей в молекуле СН4 возникает sp3-гибридизация(рис. 29.7).
|
|
H |
y |
||
|
|
|
|
|
|
x |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
||
|
z |
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
H |
|
|
|
|
|
|
|
|
|
H |
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
||
|
(s + px + py + pz)-орбитали |
|
|
|
|
109°28′ |
|
|
|||||
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
четыре sp3-гибридные |
|||||||||
атома углерода в возбужденном |
|
|
|
орбитали молекулы CH4 |
|||||||||
|
|
состоянии |
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|||||
Рис. 29.7. sp3-Гибридизация валентных орбиталей углерода
При гибридизации число гибридных орбиталей всегда равно числу исходных атомных орбиталей.
Гибридизации могут подвергаться как орбитали с неспаренными электронами, так и орбитали, на которых находятся неподеленные электронные пары.
Например, в молекуле воды H2O кислород находится в состоянии sp3-гибридизации:
2p
2s
O
H 1s H 1s
Электронная конфигурация валентной оболочки атома кислорода 2s22р4. На внешнем электронном уровне у него находятся две неподеленные электронные пары и два неспаренных электрона. При образовании химических связей гибридизации подвергаются все четыре атомные орбитали кислорода. Атом кислорода расположен в центре неправильного тетраэдра, две неподеленные электронные пары кислорода занимают две вершины тетраэдра, а две другие заняты атомами водорода, что приводит
222

к угловому строению молекулы воды. Валентный угол HОН составляет 104,5°, чтодовольноблизкоктеоретическомузначению109°.
В молекуле аммиака (NH3) атом азота также находится в sp3- гибридномсостоянии:
2p
2s
N
H 1s H 1s H 1s
Три пары электронов являются общими с атомами водорода и участвуют в образовании связей. Одна электронная пара (неподеленная) принадлежит только атому азота. В результате sp3-гибридизации молекула NH3 имеетпирамидальнуюформу, валентныйуголравен107°.
Неподеленная электронная пара образует более размытое электронное облако, чем общая (обобществленная, связывающая), поэтому она занимает больший объем. Это приводит к уменьшению валентных углов по сравнению с тетраэдрическими 109°28′. В табл. 29.3 приведены примеры соединенийсразличными типамигибридизации.
Орбитали центрального атома, участвующие в образовании π-связей, не подвергаются гибридизации. Например, в ацетилене С2Н2 реализуется sp-гибридизация орбиталей атома углерода, в этилене С2Н4 – sp2-гибридизация:
H 1s H 1s
CH |
CH |
H 1s |
CH2 |
CH2 |
|
2s |
2p |
|
2s 2p |
|
|
|
||
|
C* |
|
|
C* |
|
C* |
|
|
C* |
|
|
H 1s |
|
|
H 1s H 1s
Поскольку ковалентные связи обладают пространственной направленностью, в результате ковалентного связывания атомов образуются либо молекулы, либо атомные кристаллические решетки со строго определенным геометрическим расположением атомов. Каждому веществу соответствует своя структура.
223
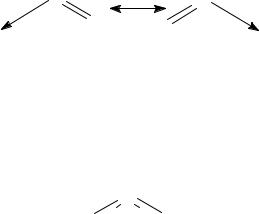
Строение многих молекул нельзя изобразить только одной схемой с локализованной π-связью. В таких случаях строение молекулы может отражаться несколькими структурами с помощью метода ВС, которые по отношению друг к другу являются резонансными.
Например, молекула SO2 может быть изображена в виде двух резонансных структур:
.. |
|
|
.. |
|
S |
О |
|
S |
|
О |
О |
О |
||
|
||||
|
|
Истинная структура молекулы оказывается промежуточной между ними. В молекуле SO2 оба атома кислорода связаны равноценными по длине и энергии связями. Ее строению в большей степени соответствует промежуточная структура с делокализованной π-связью:
. .
S
О


 О
О
Делокализованная π-связь изображена пунктирной линией. В этом случае электронная пара, образующая π-связь, принадлежит не двум, а трем атомам и является трехцентровой.
Полярность ковалентной связи объясняется различной электроотрицательностью атомов, образующих молекулу. Двухэлектронное облако сдвигается к более электроотрицательному атому, и в молекуле проявляется электрический момент диполя. Чем больше различие в электроотрицательности двух элементов, тем больше связь отличается от ковалентной и тем больше в ней доля ионной связи. Расстояние между центрами тяжести эффективных зарядов (q+ и q–) называется длиной диполя (l).
Мерой полярности связи является электрический момент диполя μ, представляющий собой произведение длины диполя на абсолютный эффективный заряд q:
μ = q · l.
Электрический момент диполя (ЭМД) – векторная величина, направленная от положительного полюса диполя к отрицательному. В многоатомных молекулах суммарный ЭМД равен векторной сумме ЭМД отдельных связей. ЭМД обычно выражают в Кл · м. В качестве единицы измерения используют также внесистемную
224
единицу измерения дебай (D), причем 1 D = 3,33564 · 10−30 Кл · м. В справочной литературе дипольные моменты молекул приводят в дебаях. Большинство полярных молекул имеет дипольный момент порядка 1 дебая.
Дипольный момент молекулы характеризует ее способность ориентироваться в электрическом поле между положительными и отрицательными электродами. Следует различать полярность связей и полярность молекул. Связи в молекуле могут быть полярными, а сами молекулы неполярными в случае ее высокой симметрии. Например, электрический момент диполя симметрично связанных молекул СО2 (sp-гибридизация), SO3 (sp2-гибридизация), СН4 (sp3-гибридизация) равен нулю, хотя связи С=О, S=O и С–Н полярны.
Вследствие углового строения μ (SO2) = 1,79 D. Дипольные моменты NF3 и NH3 при одинаковой гибридизации атома азота (sp3), примерно одинаковой полярности связей N–F и N–H и сходной геометрии молекул существенно различаются, поскольку дипольный момент неподеленной пары электронов азота при векторном сложении ЭМД в случае NH3 увеличивает μ молекулы, а в случае NF3 уменьшает его.
225
Тема30.МЕТОДМОЛЕКУЛЯРНЫХОРБИТАЛЕЙ
Основная идея метода молекулярных орбиталей (МО) заключа-
ется в том, что все электроны находятся на молекулярных орбиталях, единых для всей системы ядер и электронов данной молекулы. Для определения волновых функций молекулярных орбиталей используют приближение, называемое линейной комбинацией атомных орбиталей (ЛКАО): молекулярная волновая функция МО получается простым сложением или вычитанием атомных волновых функций АО. Основные положения метода МО ЛКАО (метода молекулярных орбиталей в предположении линейной комбинации атомных орбиталей) заключаются в следующем:
–в образовании МО могут участвовать АО, имеющие сходную симметрию и близкую энергию;
–количество МО в молекуле равно сумме АО атомов, входящих в
еесостав;
–АО должны в достаточной степени перекрываться при образовании МО. Поэтому орбитали внутренних электронных слоев атомов практически не участвуют в образовании связи и в методе МО обычно не рассматриваются.
По аналогии с атомными s-, p-, d-, f-орбиталями молекулярные
орбитали обозначают греческими буквами σ, π, δ, ϕ. Заполнение молекулярных орбиталей происходит так же, как и атомных, с соблюдением принципа Паули, принципа наименьшей энергии и правила Хунда; на каждой МО может находиться не более двух электронов.
В методе МО образование молекулярных орбиталей рассматривается как результат сложения и вычитания комбинируемых АО. Молекулярная орбиталь, возникающая в результате сложения АО, отвечает более низкому значению энергии, чем сумма энергий исходных АО. Такая МО имеет повышенную электронную плотность в пространстве между ядрами и способствует образованию химической связи, она на-
зывается связывающей.
Молекулярная орбиталь, возникающая в результате вычитания атомных орбиталей, отвечает более высокому значению энергии, чем сумма энергий исходных АО. Электронная плотность в этом случае сконцентрирована за ядрами атомов, а между ними равна нулю. Подобные МО энергетически менее устойчивы, они приводят к ослаблению химической связи и называются разрыхляющими (их часто обозначают звездочками на схемах).
226

Образование молекулярных орбиталей из атомных изображают схематически в виде энергетических диаграмм, на которых молекулярные и атомные орбитали обозначаются либо в виде клеточек  ,
,
либо в виде кружочков ○, а электроны на них – стрелками, направленными вверх (↑) или вниз (↓). Орбитали на диаграммах размещают в соответствии с их энергией.
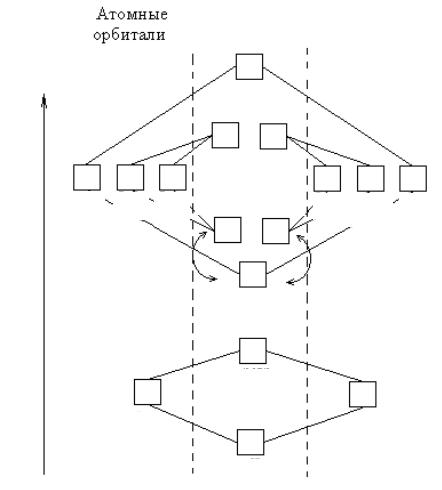
Рассмотрим построение такой энергетической диаграммы на примере молекулы водорода Н2, ионов Н+2 , Не+2 (рис. 30.1).
Е
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
σразр |
||||||
|
|
|
|
|
σразр |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
σразр |
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Не+ |
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
Н |
|
|
|
|
|
|
|
|
|
|
Не |
|
|
|
|
||||
|
Н |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Н+ |
||||||||||||
|
|
|
|
|
|
|
|
Н |
|
|
|
|
|
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1s |
|||
1s |
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
1s |
|
|
|
|
|
|
1s |
|
|
|
|
|
|||||||||||
|
|
|
|
|
1s |
|
|
|
|
|
|
|
|
|
1s |
|
|
|
|
|||||||||||||
AO |
|
|
|
|
|
AO |
|
AO |
|
|
|
|
|
AO |
|
|
AO |
|
|
|
|
|
|
AO |
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
σсв |
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
σсв |
|
|
|
|
|
|
|
|
|
|
|
|
|
σсв |
||||||||||||||
|
|
|
|
|
MO |
|
|
|
|
|
|
|
|
|
|
MO |
|
|
|
|
|
|
|
|
|
MO |
|
|
||||
|
|
|
|
|
H2 |
|
|
|
|
|
|
|
|
|
|
|
H2+ |
|
|
|
|
|
|
|
|
|
He2+ |
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Рис. 30.1. Энергетические уровни МО молекулы Н2
Электроны, занимающие связывающие и разрыхляющие МО, называются соответственно связывающими и разрыхляющими. Устойчивая молекула образуется в случае, если сумма электронов, расположенных на связывающихМО, превышаетсуммуэлектроновнаразрыхляющих МО.
Порядок связи равен половине разности числа электронов на связывающих Nсв и разрыхляющих Nразр МО:
Порядок связи = Nсв − Nразр . 2
Если порядок связи = 0, то молекула не образуется. Порядок связи может принимать как целые, так и дробные положительные значения. Чем выше порядок связи, тем прочнее молекула.
Е(связи), кДж/моль
порядок связи (Н2+ ) = |
|
(1− 0) |
= 0,5 |
256 |
|
|
2 |
|
|
порядок связи (Н2) = |
(2 − 0) |
= 1 |
432 |
|
|
|
2 |
|
|
порядок связи (Не2+ ) = |
(2 − 1) = 0,5 |
250 |
||
|
|
2 |
|
|
227
Таким образом, энергия связи в молекуле Н2 больше, чем в ионе Н2+. Молекула Не2 существовать не может, так как число связывающих и разрыхляющих электронов в ней одинаково и порядок связи равен нулю.
Рассмотрим использование метода МО на примере двухатомных гомоядерных молекул элементов II периода периодической системы. Согласно спектроскопическим данным, молекулярные орбитали двухатомных гомоядерных молекул элементов II периода по энергии располагаются следующим образом:
а) для молекул Li2, Be2, B2, C2, N2 этот порядок σ св2s |
< σ 2разрs < π св2 ру = |
||||
= π св |
< σ св |
< π разр |
= π разр < σ разр ; |
|
|
2 рz |
2 рх |
2 ру |
2 рz |
2 рх |
|
б) для молекул О2, F2, Ne2 этот порядок σ св2s < σ 2разрs |
< σ св2 рх < π св2 ру = |
||||
= π св |
< π разр |
= π разр |
< σ разр |
(рис. 30.2). |
|
2 рz |
2 ру |
2 рz |
2 рх |
|
|
Возрастание энергии
|
Атомные |
|
Молекулярные Атомные |
||
|
орбитали |
|
орбитали |
орбитали |
|
|
|
|
σ разр |
|
|
|
|
|
|
2 рх |
|
|
|
|
π разр |
π разр |
|
|
|
|
2 ру |
2 рz |
|
2 px 2 py 2 pz |
π св2 ру |
π св2 рz |
2 pz 2 py 2 px |
||
σсв2 рх
σразрs2
2s |
2s |
σ св2s
Рис. 30.2. Расположение атомных и молекулярных орбиталей в соответствии с их энергией
228
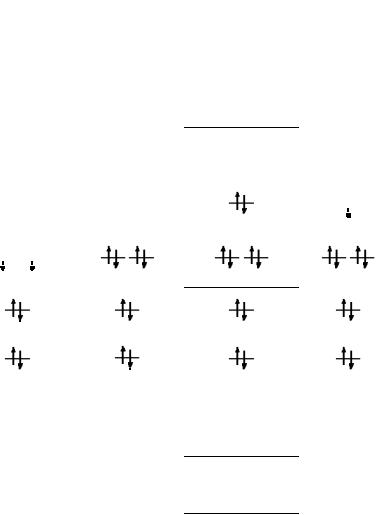
Записав электронную конфигурацию молекулы, можно судить о прочности и длине связи в ней, о ее магнитных свойствах.
Метод МО позволяет характеризовать не только молекулы, но и молекулярные ионы. Свойства двухатомных молекул II периода p- элементов приведены в табл. 30.1, 30.2.
Таблица 30.1
Схемы МО, электронных конфигураций и молекулярные параметры двухатомных гомоядерных молекул (ионов) p-элементов начала II периода
Типы орбиталей, |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
C2 |
|
|
N2 |
|
N 2+ |
||||||||||||||||
характеристики |
|
|
|
|
|
|
B2 |
|
|
|
|
|
||||||||||||||||||||||||||
|
связей |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
разр |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
σ 2 рх |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
разр |
разр |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
π 2 ру |
, π 2 рz |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
σ св2 рх |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
π св2 рy , π св2 рz |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
σ 2разрs |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
σ св2s |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||
Порядок связи |
1 |
|
|
|
|
|
|
2 |
|
|
|
3 |
|
|
|
2,5 |
|
|
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||
Длина связи, нм |
0,159 |
|
0,131 |
|
0,110 |
|
0,112 |
|
||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||
Энергия связи, |
288,4 |
|
627,0 |
|
842,0 |
|
828,0 |
|
||||||||||||||||||||||||||||||
кДж моль–1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Как видно из табл. 30.1, с увеличением порядка связи происходит увеличение энергии связи. При образовании молекулярного иона N +2
электрон уходит со связывающей орбитали σ2р х , что сопровождается
уменьшением порядка связи от 3 до 2,5 и, соответственно, уменьшением энергии связи от 842 до 828 кДж/моль.
229

Таблица 30.2
Схемы МО, электронных конфигураций и молекулярные параметры двухатомных гомоядерных молекул (ионов) p-элементов конца II периода
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Типы орбиталей, |
+ |
|
|
|
|
|
|
О2 |
|
F2 |
Ne2 |
|||||||||||||
характеристики связей |
|
|
|
О2 |
|
|
|
|
|
||||||||||||||||
разр |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
σ 2 рх |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
разр |
разр |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
π 2 ру |
, π 2 рz |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
π св2 рy , π св2 рz |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
σ св2 рх |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
σ 2разрs |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
σ св2s |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
Порядок связи |
2,5 |
|
2 |
|
|
|
|
0 |
|||||||||||||||||
Длина связи, нм |
0,112 |
|
0,121 |
|
0,142 |
– |
|||||||||||||||||||
Энергия связи, кДж моль–1 |
629 |
|
494 |
|
|
|
159 |
– |
|||||||||||||||||
МО(О2) КК(σ св2s )2(σ р2азрs )2(σ св2 рх )2 (π св2 рy )2(π св2 рz )2(π р2азррy )1(π р2азррz )1, где К –
электронная конфигурация К-слоя атомов кислорода, которые практическинеучаствуютвобразованиисвязи.
МО(O+2 ) КК(σ св2s )2(σ разр2s )2(σ св2 рх )2 (π св2 рy )2(π св2 рz )2(π р2азррy )1.
Так как порядок связи иона О+2 выше, чем молекулы О2, то ион О+2 более устойчив, чем молекула О2, длина связи в ионе О2+ меньше, чем в
молекуле О2. Наличие неспаренных электронов в МО молекулы О2 и иона О+2 определяет их парамагнитные свойства (втягиваются во внешнее
магнитное поле). В случае отсутствия неспаренных электронов в МО молекулы проявляются диамагнитные свойства молекул. Следует отметить, что порядок связи иона О−2 ниже, чем молекулы О2 (1,5), а иона О22− еще
ниже(1,0).
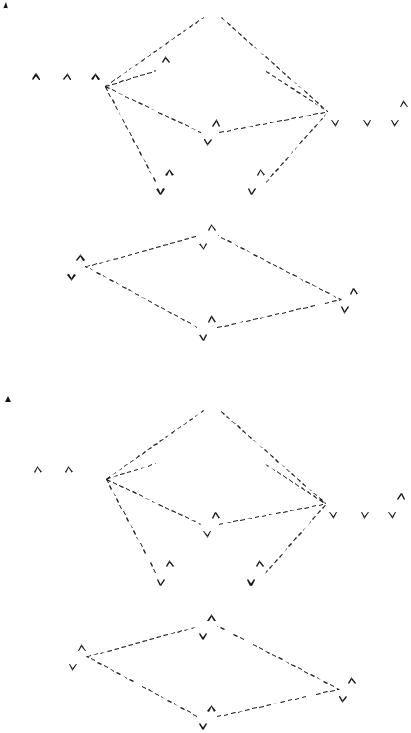
Гетероядерные двухатомные молекулы метод МО описывает так же, как и гомоядерные двухатомные молекулы. В этом случае энергии атомных орбиталей разных атомов различаются. В связывающую орбиталь большой вклад вносит орбиталь более электроотрицательного атома, а в разрыхляющую – орбиталь менее электроотрицательного атома. Энергетическими диаграммами молекул такого типа, где атомы различаются по электроотрицательности, являются, например, диаграммы молекул NO, СО (рис. 30.3; 30.4).
230
E |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
MO |
(NO) разр |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||
|
|
|
|
|
|
|
|
AO (N) |
|
|
|
|
|
|
|
|
|
|
|
|
σ |
|
|
|
AO (O) |
|
|
|
|
|||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
π разр |
|
π разр |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
p |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
x |
|
py p |
z |
|
|
σ св |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
pz |
|
|
py |
p |
x |
||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
π св |
|
|
π св |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
σ разр |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
s |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
σ св |
|
|
|
|
|
s |
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
Рис. 30.3. Энергетическая диаграмма молекулы NO |
|
|
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||
E |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
MO (CO) разр |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||
|
|
|
|
|
|
|
|
AO (C) |
|
|
|
|
|
|
|
|
|
|
|
|
σ |
|
|
|
|
AO (O) |
|
|
|
|
||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
π разр π разр |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
p |
|
|
|
|
|
|
|
|
|
pz |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
x |
|
|
|
p |
y |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
σ св |
|
p |
z |
|
py |
p |
x |
||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
π св |
|
|
π св |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
σ разр |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
s |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
σ св |
|
|
|
|
|
s |
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
Рис. 30.4. Энергетическая диаграмма молекулы CO
В случае, когда молекула имеет три и более атома, энергетические диаграммы все более усложняются. Поэтому описание многоатомных молекул с позиций метода МО становится менее наглядным, а следовательно, и менееудобным.
231

Тема 31. ИОННАЯ ХИМИЧЕСКАЯСВЯЗЬ.
МЕТАЛЛИЧЕСКАЯ СВЯЗЬ. ВОДОРОДНАЯ СВЯЗЬ. ТИПЫ КРИСТАЛЛИЧЕСКИХ РЕШЕТОК
Ионная связь
Предельным случаем ковалентной полярной связи является ионная связь. Она образуется атомами, электроотрицательности которых значительно различаются.
Ионная связь – химическая связь, образованная электростатическим притяжением друг к другу разноименно заряженных ионов.
Молекулы с наиболее выраженной ионной связью образуются из атомов типичных металлов и типичных неметаллов (NaCl, CsF), т. е. когда различие в электроотрицательности атомов велико.
При образовании ионной связи происходит почти полный переход электронной пары к более электроотрицательному атому и образуются положительный и отрицательный ионы, удерживаемые вблизи друг друга электростатическими силами.
Например, при образовании связи между атомами натрия (Z = 11) и хлора (Z = 17) элементы приобретают внешнюю электронную оболочку благородных газов: неона (Z = 10) и аргона (Z = 18). В электронных формулах этих элементов подчеркнуты электронные конфигурации внешних уровней:
Na: 1s2 2s2 2p6 3s1; Ne: 1s2 2s2 2p6;
Cl: 1s2 2s2 2p63s2 3p5; Ar: 1s2 2s2 2p63s2 3p6.
Атом натрия, отдав атому фтора свой 3s1-электрон, становится ионом Na+ и остается с заполненной 2s22p6-оболочкой, что отвечает электронной конфигурации атома неона. Атом хлора, приняв один электрон от атома натрия, превращается в ион Сl–. При этом ионы Cl– и Na+ продолжают оставаться все теми же элементами (хлором и натрием), поскольку число протонов в их ядрах не изменилось.
- |
|
- |
= |
|
+ |
|
|
|
|
|
|
|
|
|
|
||||
|
– |
Na |
|
оболочки |
|
|
|||
Na – e |
|
|
|
|
|
– |
|||
Cl + e- |
= |
Cl- |
|
инертных газов |
+ |
Cl- |
|||
|
|||||||||
|
|
Na |
|
||||||
|
– |
|
– |
|
|
|
|
||
r
При отдаче или присоединении электронов группой атомов образуются многоатомные ионы, например NO −2 – нитрит-ион.
232
Ионная связь может быть описана в рамках методов ВС и МО, однако обычно ее рассматривают с помощью законов электростатики.
Характеристики ионной связи
1.Ненаправленность. Любой простой ион (точечный заряд) притягивает противоположно заряженные ионы по всем направлениям с одинаковой силой. Эта особенность ионной связи называется ненаправленностью.
2.Ненасыщаемость. Смысл ненасыщаемости ионной связи в том, что каждый ион с одинаковой силой притягивает один, два, три, четыре и т. д. ионов противоположного знака (если они находятся на одинаковом от него расстоянии). Число таких ионов зависит только от их размера.
Вещества с ионной кристаллической решеткой при обычных условиях находятся в твердом состоянии, они имеют высокие температуры плавления и кипения.
Металлическая связь
Металлы и их сплавы кристаллизуются в форме металлических решеток. Узлы в металлической решетке заняты положительными ионами металлов. Валентные электроны, отделившиеся от атомов металлов, более или менее свободно перемещаются в пространстве между катионами иобусловливают электрическуюпроводимостьметаллов.
Между катионами и свободными электронами существуют электростатические взаимодействия, которые и являются причиной возникновения металлической связи.
Металлическая связь имеет сходство как с ионной, так и с ковалентной. Сходство с ионной связью в том, что обе они образуются за счет взаимодействия между заряженными частицами: электронами и ионами. Сходство с ковалентной в том, что происходит обобществление электронов. Однако, в отличие от ковалентной связи, где электроны локализованы около определенных атомов, электроны в металлах обобществляются всем кристаллом. Совокупность электронов иногда называют электронным газом. Катионы в металлических решетках совершают колебания вокруг узлов решетки. Амплитуда этих колебаний возрастает при повышении температуры, а при достижении температуры плавления металла решетка разрушается. Температура плавления металлов, как правило, возрастает с увеличением числа валентных электронов в их атомах. Наибольшую температуру плавления из металлов имеют d-элементы, что объясняется наличием в кристаллах этих элементов ковалентной связи, образованной не-
233
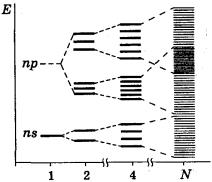
спаренными d-электронами, помимо металлической, образованной s-электронами.
При повышении температуры происходит падение электропроводности металлов.
Для объяснения существования проводников, полупроводников и изоляторов разработана «зонная теория» – теория молекулярных орбиталей для системы с очень большим числом частиц (N ≈ 1023). При одновременном взаимодействии N атомов в кристалле число возникающих молекулярных орбиталей равно сумме орбиталей отдельных атомов. Даже если учитывать только внешние s- и р-орбитали, то при содержании в кристалле N атомов образуется 4N молекулярных орбиталей (рис. 31.1). Как видно из рисунка, взаимодействие в кристалле большого числа атомов приводит к появлению практически сплошного спектра энергий молекулярных орбиталей, т. е. к образованию энергетической зоны.
Рис. 31.1. Расщепление энергетических уровней электронов при последовательном присоединении атомов
Подобно тому как в изолированном атоме электроны могут находиться только на строго определенных энергетических уровнях, в кристалле существуют зоны разрешенных и запрещенных энергий. Энергетические уровни, на которых находятся валентные электроны, образуют валентную зону. Совокупность свободных, не занятых электронами уровней, расположенных энергетически выше валентной зоны, в некоторых случаях в пределах ее, называется зоной проводимости.
В зависимости от природы взаимодействующих атомов и типа кристаллической решетки валентная зона и зона проводимости могут перекрываться и не перекрываться друг с другом. В последнем случае между валентной зоной и зоной проводимости возникает энергетический разрыв, называемый запрещенной зоной. В зависимости от шири-
234

ны запрещенной зоны Е все кристаллические вещества подразделяют на проводники (металлы), полупроводники и диэлектрики (изоляторы) (рис. 31.2).
Рис. 31.2. Возникновение энергетических зон (В – валентной, З – запрещенной, П – проводимости) для кристаллов:
а– диэлектриков, б – полупроводников, в – металлов
Вметалаллах валентная зона и зона проводимости перекрываются между собой, т. е. Е = 0. Это обусловливает способность валентных электронов в металле свободно перемещаться по всему объему кристалла или двигаться направленно под влиянием внешнего электрического поля. Отсутствие запрещенной зоны у металлов объясняется тем, что в их кристаллах s- и p-зоны перекрываются, а число валентных электронов мало по сравнению с числом вакантных орбиталей в валентной зоне. Например, в кристалле натрия 3s-зона занята лишь наполовину и полностью свободна перекрывающаяся с ней 3p-зона. В кристалле магния 3s-зона занята полностью, но с ней перекрывается свободная 3p-зона. У алюминия 3s-зона занята полностью, а 3p-зона – только на 1/6.
Благодаря наличию вакантных орбиталей в валентной зоне, а также перекрыванию s- и p-зон электроны в кристаллической решетке беспрепятственно переходят из валентной зоны в зону проводимости. При повышении температуры все большее число электронов переходит на вакантные молекулярные орбитали в зоне проводимости, что приводит к уменьшению числа вакантных МО и, соответственно, снижению электрической проводимости. У d-элементов происходит перекрывание ns-,
235
np- и (n – 1)d-зон. Однако d-зона относительно неширокая, поэтому часть d-электронов в металлах локализованы, т. е. образуются ковалентные связи между соседними атомами, что обусловливает повышение температуры плавления и механической прочности кристаллических решеток d-элементов.
В отличие от металлов кремний образует ковалентный кристалл, в котором связи образованы четырьмя эквивалентными sp3-гибридными орбиталями третьего электронного слоя, образующими единую sp3-гибридную валентную зону. Все связывающие орбитали в кристалле кремния заселены электронными парами, т. е. валентная зона полностью занята. Если валентная зона полностью занята электронами, вещества не обладают металлической проводимостью. Электроны этой зоны локализованы на своих энергетических уровнях и перемещаются внутри нее, участвовать в электрической проводимости не могут. Ближайшей по энергии зоной проводимости к sp3-гибридной валентной зоне в кристалле кремния является зона, образованная перекрыванием вакантных 3d-орбиталей того же слоя и близких к ним по энергии 4s-орбиталей. Эта зона не перекрывается с валентной, т. е. разделена запрещенной зоной. Электрофизические свойства кристаллов зависят от ширины запрещенной зоны. Для перехода электронов в зону проводимости необходимо их возбуждение. Так как атомы Si обладают свободными 3d-орбиталями, близкими по энергии к 3р-орбиталям, зона проводимости, образуемая 3d-орбиталями, располагается близко к валентной зоне, в результате кристалл кремния при сообщении ему небольшой энергии (нагревание, облучение и др.) способен проводить электрический ток. Подобные материалы, которые в нормальном состоянии являются диэлектриками, а в возбужденном– проводникамиэлектричества, называютполупроводниками.
Если ширина запрещенной зоны существенна (рис. 31.2, а), то возбудить электрическую проводимость в веществе путем нагревания невозможно, поскольку кристалл расплавится раньше, чем возникнет проводимость. К диэлектрикам относятся, например, алмаз, кварц.
Следует отметить, что при некоторых внешних условиях, например при сверхвысоком давлении, атомы кристаллов настолько сближаются друг с другом, что валентная зона и зона проводимости перекрываются, и полупроводники, и даже диэлектрики, могут превращаться в металлы.
Водородная связь
Атомы азота, кислорода и фтора являются самыми электроотрицательными. Они сильно смещают на себя электронную плотность в молекулах водородных соединений. Связи в HF, H2O и NH3 сильно полярны.
236
Вследствие кулоновского взаимодействия происходит притяжение противоположно заряженных концов разных молекул и возникает межмоле-
кулярнаяводороднаясвязь(рис. 31.3).
- O - |
|
|
-O- |
H |
H |
H |
H |
+ |
+ |
+ |
+ |
|
|
-O- |
|
HH
++
- |
- |
|
-O- |
|
|
O |
H |
H |
|
H |
H |
|||
+ |
+ |
|||
+ |
+ |
|
|
Рис. 31.3. Образование водородных связей между молекулами воды
Как видно из представленных данных (рис. 31.4 и табл. 31.1), температуры кипения H2O и HF выпадают из общей закономерности в приведенных рядах соединений, что свидетельствует о наличии специфическоговзаимодействия между молекулами – водородныхсвязей.
o |
|
|
|
|
|
t, °C |
|
|
|
|
|
20 |
|
|
|
|
|
–-20 |
|
2 |
|
|
|
|
|
|
|
|
|
–-60 |
|
|
|
|
|
–-100 |
1 |
|
|
|
|
|
|
|
|
|
|
–-140 |
HFHF |
HCl |
HBr |
HI |
HI |
|
|||||
|
|
HBr |
|
||
Рис. 31.4. Температуры плавления (1) и кипения (2) НF |
|||||
Таблица 31.1
Температуры кипения некоторых соединений
Соединение |
tкип, °С |
Соединение |
tкип, °С |
H2O |
+100 |
HF |
+19 |
H2S |
–60 |
HCl |
–84 |
H2Se |
–41 |
HBr |
–67 |
H2Te |
–2 |
HI |
–35 |
237
Энергия водородной связи значительно меньше энергии ковалентной связи. Тем не менее, водородная связь обусловливает существование в газовой фазе димерных молекул воды и фтороводорода
(например, H2F2).
Среди межмолекулярных взаимодействий можно выделить дипольдипольное. Очевидно, что два диполя будут стремиться ориентироваться относительно друг друга противоположными полюсами (рис. 31.5).
Рис. 31.5. Схема диполь-дипольного взаимодействия
Другой тип межмолекулярного взаимодействия – индукционное. Любой диполь, безусловно, оказывает электростатическое воздействие на рядом находящиеся неполярные молекулы, вызывая их поляризацию (рис. 31.6).
Рис. 31.6. Схема индукционного взаимодействия
Например, неполярная молекула брома, подходя к π-облаку молекулы этилена, поляризуется так, что атакующим центром оказывается атом брома с частично положительным зарядом на нем. Об этом свидетельствует образование промежуточного бромониевого катиона. Индукционный эффект возрастает с увеличением поляризуемости молекулы.
Возможно межмолекулярное взаимодействие и между совершенно неполярными молекулами. Электронная плотность подвержена колебаниям (флуктуациям). Смещение электронной плотности у одного атома (образование мгновенного диполя) вызовет соответствующее смещение и у другого (рис. 31.7).
Рис. 31.7. Схема дисперсионного взаимодействия
Следствием подобных сдвигов электронной плотности является взаимное притяжение атомов. Данное взаимодействие называется
238
дисперсионным и позволяет объяснить возможность существования конденсированных фаз (жидкой и твердой) для совершенно неполярных атомов и молекул, например для гелия, иода.
Силы межмолекулярного взаимодействия по сравнению с обычными валентными силами ненасыщаемы, имеют низкую энергию, действуют на небольших расстояниях. Например, энергия связи Cl–Cl составляет 245 кДж/моль, а энергия связи между молекулами Cl2 в кристалле хлора на порядок ниже и составляет 25 кДж/моль. Сила межмолекулярного взаимодействия возрастает с увеличением размеров молекул.
Типы кристаллических решеток
Вещества могут существовать в трех агрегатных состояниях: твердом, жидком, газообразном. В твердом состоянии вещества образуют кристаллические решетки.
Кристаллические решетки веществ – это упорядоченное распо-
ложение частиц (атомов, молекул, ионов) в определенных точках пространства. Кристаллическое состояние характеризуется дальним порядком, т. е. трехмерной периодичностью структуры по всему объему твердого тела.
Точки размещения частиц называют узлами кристаллической ре-
шетки.
В зависимости от вида частиц, расположенных в узлах кристаллической решетки, и характера связи между ними различают 4 типа кристаллических решеток: атомные, молекулярные, ионные, металлические.
Вещества, молекулы которых характеризуются ковалентной неполярной связью, могут в твердом состоянии образовывать молекулярные и атомные кристаллические решетки.
Атомными называют кристаллические решетки, в узлах которых находятся отдельные атомы, соединенные очень прочными ковалентными связями (рис. 31.5, а).
Примерами веществ с атомной кристаллической решеткой могут служить алмаз, SiO2.
Вещества с молекулярной кристаллической решеткой (рис. 31.5, б) имеют малую твердость, плавятся при низкой температуре, летучие, при обычных условиях находятся в газообразном или жидком состоянии. В узлах кристаллической решетки молекулы удерживаются за счет слабого межмолекулярного взаимодействия. Силы, связывающие молекулы,
называют ван-дер-ваальсовыми.
239

а |
|
б |
Рис. 31.8. Схема атомной (а) и молекулярной (б) кристаллических решеток
Ионными называют кристаллические решетки, в узлах которых находятся ионы (рис. 31. 9). Их образуют вещества с ионной связью (соли, оксиды и гидроксиды металлов). Ионные кристаллические решетки имеют соли, некоторые оксиды и гидроксиды металлов.
Рис. 31.9. Схема ионной кристаллическойрешетки
Вещества с ионной кристаллической решеткой обладают высокими температурами плавления и кипения (табл. 31.2).
|
Температура плавления и кипения |
|
Таблица 31.2 |
||||
|
|
|
|
||||
|
веществ с ионной кристаллической решеткой |
|
|
||||
|
|
|
|
|
|
|
|
Свойства |
|
|
Вещества |
|
|
|
|
NaCl |
NaOH |
KBr |
|
BaF2 |
|
BaCl2 |
|
|
|
|
|||||
t пл,°С |
801 |
321 |
734 |
|
1368 |
|
961 |
t кип, °С |
1465 |
1390 |
1380 |
|
2260 |
|
2050 |
Это объясняется сильным электростатическим взаимодействием положительных и отрицательных ионов. Силы же отталкивания одноименных ионов значительно меньше, так как одноименные ионы рас-
240
положены на больших расстояниях друг от друга. Для разрушения ионных кристаллов требуется значительная тепловая энергия, что и определяет высокие температуры плавления и кипения. Другим свойством ионных веществ является способность образовывать расплавы, хорошо проводящие электрический ток.
В узлах металлических кристаллических решеток находятся катионы металла (рис. 31.10). Для металлов характерны такие физические свойства, как пластичность, ковкость, металлический блеск, высокая электро- и теплопроводность.
Рис. 31.10. Схема металлической кристаллической решетки
Указанные свойства обусловлены обобществленными электронами, которые свободно перемещаются в пространстве между узлами кристаллической решетки.
241
