
- •ВВЕДЕНИЕ
- •Тема 2. ОСНОВНЫЕ ЗАКОНЫ ХИМИИ
- •Оксиды
- •Кислоты
- •Соли
- •Тема 4. ЭНЕРГЕТИКА ХИМИЧЕСКИХ РЕАКЦИЙ
- •Тема 5. ТЕРМОХИМИЧЕСКИЕ РАСЧЕТЫ
- •Тема 7. ПОНЯТИЕ ОБ ЭНТРОПИИ
- •Тема 9. СМЕЩЕНИЕ ХИМИЧЕСКОГО РАВНОВЕСИЯ
- •Тема 13. РАСТВОРЫ ЭЛЕКТРОЛИТОВ
- •Тема 15. ВОДОРОДНЫЙ ПОКАЗАТЕЛЬ
- •Тема 16. ГИДРОЛИЗ СОЛЕЙ
- •Тема 17. ПРОИЗВЕДЕНИЕ РАСТВОРИМОСТИ
- •Тема 20. ТЕОРИИ КИСЛОТ И ОСНОВАНИЙ
- •Гальванические элементы
- •Тема 23. ЭЛЕКТРОЛИЗ
- •Кислотно-основные свойства соединений
- •Тема 32. ТЕОРИЯ КРИСТАЛЛИЧЕСКОГО ПОЛЯ
- •ЛИТЕРАТУРА
Тема23. ЭЛЕКТРОЛИЗ
Электролизом называются окислительно-восстановительные реакции, протекающие на электродах при пропускании постоянного электрического тока от внешнего источника через раствор или расплав электролита.
При электролизе энергия электрического тока превращается в химическую, т. е. может наблюдаться процесс, обратный по характеру процессам в гальванических элементах.
Катодом в электролитической ячейке, как и в гальваническом элементе, будет электрод, на котором протекает процесс восстановления, а анодом – электрод, на котором происходит процесс окисления. Однако знаки электрических потенциалов электродов поменяются в сравнении с гальваническим элементом: катод будет иметь отрицательный потенциал «–», а анод – положительный «+».
Электроды, используемые в электролитической ячейке, могут быть нерастворимыми или растворимыми. Нерастворимые электроды изготавливают из благородных металлов или из неметаллов, например графита. Растворимыми в процессе электролиза могут быть электроды из более активных металлов, используемые в качестве анодов.
Ионы, образующиеся при диссоциации электролита, перемещаются к катоду (катионы) и аноду (анионы), где и происходят окисли- тельно-восстановительные процессы. При электролизе расплавов солей на катоде будет идти восстановление катионов металла, например при электролизе расплава хлорида цинка
катод Zn2+ + 2e– = Zn,
на аноде – окисление анионов кислотного остатка:
анод 2Сl– – 2e– = Cl2.
На аноде легко окисляются простые бескислородные анионы: Cl–, Br–, I–, S2–. Окислениекислородсодержащихионовпротекаетболеесложно.
При электролизе водных растворов солей на катоде может происходить восстановление катионов металла или молекул воды, могут также протекать оба процесса: восстановление и катионов металла, и молекул воды.
Молекулы воды восстанавливаются на катоде до водорода:
катод 2H2O + 2e– = H2 + 2OH–.
183
На аноде в растворе также может проходить окисление анионов кислотного остатка или молекул воды. Молекулы воды окисляются до кислорода:
анод 2H2O – 4е– = О2 + 4Н+.
Правила процесса восстановления на катоде и окисления на аноде
В общем случае на катоде будет протекать тот процесс, электродный потенциал которого больше. Для определения протекающего на катоде процесса восстановления при электролизе водных растворов солей следует руководствоваться правилами:
1)если металл, образующий соль, расположен в ряду напряжений до Al включительно, то восстанавливаются молекулы воды и выделяется водород;
2)если металл, образующий соль, расположен в ряду напряжений после Al, но до водорода, то восстанавливаются и катионы металла, и молекулы воды;
3)если металл, образующий соль, расположен в ряду напряжений после водорода, то восстанавливаются катионы металла.
Металлы в электрохимическом ряду напряжений располагаются в порядке возрастания стандартных электродных потенциалов полуреакций:
Mez+ + ze– = Me.
Ряд начинается с активных металлов (первым стоит Li) и заканчивается неактивными (благородными) металлами:
Li K Na Mg Al |
Zn Cr Fe Ni Sn Pb |
H |
|
Cu |
Hg Ag Au |
||
|
|
|
|
|
|
|
|
Катодные процессы в водных растворах солей |
|
||||||
|
|
|
|
|
|
|
|
Li – Al |
|
Zn – Pb |
|
H |
|
|
Cu – Au |
2H2O + 2e– = H2 + 2OH– |
|
Меz+ + ze– = Ме° |
|
|
|
Меz+ + ze– = Ме° |
|
|
|
2H2O + 2e– = H2 + 2OH– |
|
|
|
|
|
При электролизе растворов кислот на катоде восстанавливаются катионы водорода до молекулярного водорода:
2Н+ + 2e– = H2.
В общем случае на аноде будет протекать тот процесс, электродный потенциал которого меньше. Процессы, протекающие на аноде, зависят отегоматериала.
184

Правила для определения протекающего на аноде процесса окисленияприэлектролизе водныхрастворовсолей:
1)если анод растворимый, то окисляется металл, из которого состоит анод, до катионов металла;
2)если анод нерастворимый, а анион бескислородный (Cl–, Br–, I–, S2–, кроме F–), то окисляется анион до соответствующего простого вещества (Cl2, Br2, I2, S);
3)если анод нерастворимый, а анион кислородсодержащий, то окисляются молекулы воды:
2H2O – 4e– = O2 + 4H+.
При электролизе растворов щелочей на аноде окисляются гидро- ксид-ионы до молекулярного кислорода:
4OН– – 4e– = O2 + 2H2O.
|
Анодные процессы в водных растворах |
|
|
|
|
|
|
|
Нерастворимый анод |
|
Растворимый |
Кислотные остатки |
ОН– |
||
бескислородных |
кислородсодержащих |
анод |
|
кислот |
кислот, F– |
|
Ме° – ze– = Меz+ |
2Cl– – 2e– = Cl2 |
2H2O – 4e– = O2 + 4H+ |
4OH– – 4e– = O2 + |
|
S2– – 2e– = S |
|
+ 2H2O |
|
При составлении схемы электролиза следует записать уравнения реакций на катоде, на аноде и суммарное уравнение электролиза. В случае, если на катоде протекают оба процесса (восстановление и воды, и катионов металла), суммарное уравнение электролиза не записывают.
Пример 1. Составить схему электролиза расплава хлорида калия на графитовых электродах.
Решение. Графитовые электроды нерастворимы и не участвуют в электродных процессах. В расплаве хлорид калия распадается на ионы:
KCl → K+ + Cl− .
При электролизе расплава соли на катоде восстанавливаются катионы металла до свободного металла, а на аноде окисляются анионы бескислородной кислоты. Составляем схему электролиза:
катод |
K+ + e– = K |
1 |
2 |
анод |
2Cl– – 2e– = Cl2 |
2 |
1 |
2K+ + 2Cl− = 2K + Cl2
185
Суммарное уравнение электролиза в молекулярной форме имеет вид
2KCl |
электролиз |
→ 2K + Cl2. |
|
Пример 2. Составить |
схему электролиза водного раствора: |
1) хлорида натрия на нерастворимых электродах; 2) сульфата цинка на нерастворимых электродах.
Решение. При составлении схемы электролиза водных растворов солей будем руководствоваться приведенными выше правилами восстановления на катоде и окисления на аноде.
1) Хлорид натрия в растворе диссоциирует на ионы:
NaCl → Na+ + Cl− .
На катоде будут восстанавливаться молекулы воды, так как Na стоит в ряду напряжений до Al. На нерастворимом аноде будут окис-
ляться бескислородные анионы Cl–: |
|
|
|
катод |
2H2O + 2e– = H2 + OH– |
|
1 |
2 |
|||
анод |
2Cl– – 2e– = Cl2 |
2 |
1 |
2H2O + 2Cl− = H2 + 2OH− + Cl2
В молекулярном виде:
2NaCl + 2H O электролиз
2 → H2 + 2NaOH + Cl2. 2) Сульфат цинка диссоциирует на ионы в растворе:
ZnSO4 → Zn2+ + SO24− .
На катоде будут восстанавливаться и молекулы воды, и катионы цинка, поскольку Zn стоит в ряду напряжений между Al и H. На нерастворимом аноде будут окисляться молекулы воды, так как анион
SO24− кислородсодержащий:
катод |
2H2O + 2e– = H2 + OH–; |
Zn2+ + 2e– = Zn; |
|
анод |
2H2O – 4e– = O2 + 4H+. |
Поскольку на катоде протекают два процесса, суммарное уравнение электролиза не составляется.
Минимальное напряжение, которое необходимо приложить от внешнего источника тока для протекания процесса электролиза, называется напряжением разложения. Напряжение разложения не может быть меньше ЭДС соответствующего гальванического
186
элемента. Реальное напряжение, которое следует приложить к электродам, всегда оказывается больше расчетного из-за того, что на электродах по различным причинам возникает повышенное сопротивление прохождению электрического тока, которое необходимо преодолеть, прилагая более высокое напряжение. Его можно рассчитать как разность электродных потенциалов с учетом перенапряжений:
Eразл = Eа − Eк + ηа + ηк , |
(23.1) |
где Eразл – напряжение разложения, В; Eа, Eк – электродные потенциалы процессов, протекающих на аноде и катоде соответственно, В;
ηа, ηк – перенапряжения соответственно анодного и катодного процессов, В.
Перенапряжение – разность потенциала электрода под током и в отсутствие тока. Оно зависит от природы веществ, участвующих в электродном процессе, материала электрода, состава раствора или расплава, силы тока, температуры и многих других факторов.
Самые большие значения перенапряжения наблюдаются в случае образования на электродах водорода и кислорода. При этом величина перенапряжения в наибольшей степени зависит от материала электрода. Приближенные значения перенапряжений выделения водорода и кислорода в зависимости от материала электрода приведены в справочниках. При этом выделение водорода в нейтральной и щелочной среде идет в соответствии с полуреакцией
2H2O + 2e– = H2 + OH–,
а выделение кислорода в нейтральной и кислой среде – согласно полуреакции
2H2O – 4e– = O2 + 4H+.
Законы Фарадея
Количественные законы электролиза, открытые М. Фарадеем (1833– 1834), выражают связь между количеством прошедшего через электролит электричества, массой и химической природой (через химические эквиваленты) веществ, претерпевшихпревращениена электродах.
1. Количества веществ, выделившихся на электродах при электролизе, прямо пропорциональны количеству электричества, прошедшего через электролит. Количество вещества, выделяющегося при прохождении через электролит 1 Кл электричества, называют элек-
трохимическим эквивалентом.
187

2. Массы различных веществ, превращенных в результате прохождения через электролит одного и того же количества электричества, пропорциональны химическим эквивалентам этих веществ.
Для восстановления на катоде и окисления на аноде одного электрохимического эквивалента любого вещества необходимо затратить одно и то же количество электричества, а именно 96 484 Кл/моль. Эту величину называют постоянной Фарадея.
Математически законы Фарадея можно записать в виде одного уравнения:
m = |
M |
It , |
(23.2) |
|
zF |
||||
|
|
|
где m – масса выделяющегося вещества, г; M – молярная масса выделяющегося вещества, г/моль; z – количество молей эквивалентов электронов, переносимых в электродном процессе; F – число Фарадея
(F = 96 484 Кл/моль); I – сила тока, А; t – время, с. Величина zMF на-
зывается электрохимическим эквивалентом вещества.
На практике масса вещества, получаемого при электролизе, оказывается часто меньше теоретической, которая соответствует количеству прошедшего электричества. Отношение массы вещества, реально выделенного на электроде, к теоретической и умноженное на 100%, называют выходом по току.
В случае газообразного вещества X закон Фарадея можно также выразить следующим уравнением:
V |
( |
1 |
X )It |
|
Vm It |
|
|
|
V(Х) = |
m |
|
z |
|
= |
, |
(23.3) |
|
|
|
F |
||||||
|
|
|
|
zF |
|
|
||
где V(Х) – объем вещества Х, л; Vm (1z X ) – молярный объем эквивалента
вещества Х, л/моль; Vm – молярный объем газа, равный 22,4 л/моль при нормальныхусловиях.
Пример 3. Определить объем (н. у.) выделившегося на нерастворимом аноде кислорода при электролизе раствора гидроксида натрия, если через раствор пропускали ток силой 300 мА в течение 1 ч.
Решение. Составляем схему электролиза (чтобы найти n):
NaOH → Na+ + OH− .
На катоде восстанавливается вода (Na расположен до Al), на аноде окисляются гидроксид-ионы:
188
катод |
2H2O + 2e– = H2 + OH– |
2 |
2 |
анод |
4OH– – 4e– = O2 + 2H2O |
4 |
1 |
|
2H2O = 2H2 + O2 |
|
|
Электролиз сводится к разложению воды.
Переводим время из часов в секунды: t = 1 60 60 = 3600 c. Силу тока представляем в амперах: I = 0,3 А.
Число эквивалентности z можно определить по уравнению окисления на аноде: на получение одного моля кислорода расходуется 4 моля эквивалентов электронов, значит, z = 4.
Вычисляем объем выделившегося кислорода по формуле (23.3):
V(О2) = |
Vm It |
= |
22,4 0,3 3 600 |
= 0,063 л. |
|
zF |
4 96 484 |
||||
|
|
|
В процессе электролиза раствора гидроксида натрия при пропускании через раствор тока силой 300 мА в течение 1 ч выделится 0,063 л кислорода.
189
Тема24. ПРАКТИЧЕСКОЕ ПРИМЕНЕНИЕ
ЭЛЕКТРОХИМИЧЕСКИХ ПРОЦЕССОВ
Электролиз используется для получения энергоемких химических веществ, таких как H2, Cl2, металлов (Al, Zn, Ni, Cu, щелочных металлов), щелочей, многих окислителей (KMnO4, H2S2O8, H2O2, MnO2), а также чистых металлов, например при электролизе водного раствора сульфата меди на медных электродах:
CuSO4 → Cu2+ + SO24− (диссоциация сульфата меди в растворе).
На катоде будут восстанавливаться катионы меди, так как Cu стоит в ряду напряжений после водорода. На растворимом медном аноде будет идти окисление металла анода, т. е. меди до ее катионов:
катод |
Cu2+ + 2e– = Cu |
2 |
1 |
анод |
Cu – 2e– = Cu2+ |
2 |
1 |
Cu2+ + Cu = Cu + Cu2+
В данном случае при электролизе в системе никаких новых продуктов не образуется. Процесс электролиза сводится к растворению меди на аноде и осаждению ее на катоде. Такой процесс называется
электрохимическим рафинированием и используется для получе-
ния чистых металлов.
Процесс электролитического нанесения тонких металлических покрытий на другие металлы (гальваностегия) может реализовываться как из водных, так и из неводных растворов. При этом назначение гальванических покрытий весьма многообразно. Так, защитнодекоративные покрытия защищают основной металл от коррозионного и эрозионного воздействия окружающей среды и придают поверхности металла определенный внешний вид (блеск, окраску и т. п.).
Функциональное покрытие может служить отражающей поверхностью, токонесущим участком (в печатных платах), магнитным слоем, поверхностью с заданными фрикционными свойствами (в подшипнике скольжения) и т. д. Наиболее широко используют цинкование, никелирование, хромирование, оловянирование и меднение (из водных растворов) и алюминирование (из неводных).
С помощью электролиза водных растворов осуществляют также получение точных металлических копий с рельефных предметов (гальванопластика), очистку поверхности металла от окалины или
190
ржавчины (электрохимическое травление), выравнивание и сглаживание металлических поверхностей (электрополирование), придание металлическим изделиям нужных форм и размеров (электрохимическая размерная обработка), нанесение оксидной пленки на поверхность металла (анодирование) и другие широко используемые в различных отраслях промышленности технологические процессы.
Химические источники тока (ХИТ) – устройства, в которых энергия протекающих в них химических реакций непосредственно превращается в электрическую энергию.
По возможности или невозможности повторного использования химические источники тока делятся:
•на гальванические элементы (первичные ХИТ), которые из-за необратимостипротекающихвнихреакцийневозможновосстановить;
•электрические аккумуляторы (вторичные ХИТ) – перезаряжае-
мые гальванические элементы, которые с помощью внешнего источника тока (зарядного устройства) можно перезарядить;
•топливные элементы – устройства, подобные гальваническому элементу, но отличающиеся от него тем, что вещества для электрохимической реакции подаются извне, а продукты реакций удаляются, позволяя топливному элементу функционировать непрерывно.
Устройство аккумулятора. Элемент свинцово-кислотного аккумулятора состоит из положительных и отрицательных электродов, сепараторов (разделительных пористых пластин) и электролита. Положительные электроды представляют собой свинцовую решетку, а ак-
тивным веществом является диоксид свинца (PbO2). Отрицательные электроды также представляют собой свинцовую решетку, а активным веществом является губчатый свинец (Pb). На практике в свинец решеток добавляют сурьму в количестве 1–2% для повышения их прочности. Электроды погружены в электролит, состоящий из разбав-
ленной серной кислоты. Наибольшая проводимость этого раствора при комнатной температуре достигается при его плотности 1,26 г/см3
(массовая доля H2SO4 равна 35%). Однако на практике, часто в районах с холодным климатом, применяются и более высокие концентрации серной кислоты, с плотностью до 1,29−1,31 г/см3. Это делается потому, что при разряде свинцово-кислотного аккумулятора плотность электролита падает, т. е. уменьшается концентрация серной кислоты, и температура его замерзания становится выше, разряженный аккумулятор может не выдержать холода.
Принцип работы свинцово-кислотных аккумуляторов основан на электрохимических реакциях свинца и оксида свинца(IV) в сернокис-
191
лотной среде. Во время разряда происходит восстановление оксида свинца(IV) на катоде и окисление свинца на аноде:
катод PbO2 + SO 24− + 4Н+ + 2е– = PbSO4 + 2H2O; анод Pb + SO 24− – 2е– = PbSO4.
В свинцовом аккумуляторе, таким образом, самопроизвольно протекает термодинамически разрешенная реакция:
Pb + PbO2 + 2H2SO4 = 2PbSO4 + 2H2O,
в результате которой совершается работа.
При заряде протекают обратные реакции, к которым в конце заряда добавляется реакция электролиза воды, сопровождающаяся выделением кислорода на положительном электроде и водорода – на отрицательном (т. н. «кипение» аккумулятора).
Аккумуляторы дают примерно такое же напряжение, как и гальванические элементы. Так, самый распространенный кислотный свинцовый аккумулятор дает около 2 В. Такого напряжения вполне достаточно для работы кварцевых часов, но уже лампочка для карманного фонаря гореть от одного аккумулятора не будет. Поэтому, как и гальванические элементы, аккумуляторы для повышения напряжения соединяют в батареи. Для питания диктофона, плейера или фотоаппарата достаточно двух соединенных последовательно аккумуляторов. На автомобилях соединяют последовательно уже шесть свинцовых аккумуляторов; они способны кратковременно давать ток, необходимый для запуска двигателя. Аккумуляторы работают также на космических кораблях, в электромобилях и электрокарах, их используют для аварийного освещения.
О потенциальных возможностях аккумуляторов говорит такой факт. В Берлине, опасаясь отключения электроэнергии, соорудили огромную аккумуляторную батарею. Эта батарея массой 630 тонн при мощности 17 мегаватт могла в случае необходимости в течение часа, до запуска аварийных электростанций, снабжать многомиллионный город электроэнергией.
В топливном элементе происходит преобразование энергии окис- лительно-восстановительной реакции в электрическую, причем процессы окисления и восстановления пространственно разделены электролитом. Электроды и электролит в реакции не участвуют. Электрохимическое горение может идти при невысоких температурах и практически без потерь.
192
Топливный элемент состоит из анода, катода и электролита. На аноде окисляется, т. е. отдает электроны восстановитель (топливо CO или H2), свободные электроны с анода поступают во внешнюю цепь, а положительные ионы удерживаются на границе анод – электролит (CO+, H+). С другого конца цепи электроны подходят к катоду, на котором идет реакция восстановления (присоединение электронов кислородом с образованием O2–). Затем ионы окислителя соединяются с ионами восстановителя. Вода является единственным продуктом реакции (в виде пара или жидкости).
Водородная энергетика – направление выработки и потребления энергии человечеством, основанное на использовании водорода в качестве средства для аккумулирования, транспортировки и потребления энергии людьми, транспортной инфраструктурой и различными производственными направлениями. Водород выбран как наиболее распространенный элемент на поверхности Земли и в космосе, теплота сгорания водорода высока, а продуктом сгорания в кислороде является вода, которая вновь вводится в оборот водородной энергетики.
193

Тема25. КОРРОЗИЯ МЕТАЛЛОВИ МЕТОДЫ
ЗАЩИТЫ МЕТАЛЛОВ ОТ КОРРОЗИИ
Коррозия металлов – это самопроизвольно протекающий процесс разрушения металлов в результате химического и электрохимического взаимодействия с окружающей средой.
Химическая коррозия обусловливается взаимодействием металлов с сухими газами (O2, SO2, H2S и т. д.) и жидкими неэлектролитами (смазочные масла, нефть, керосин).
4Ag + 2H2S + O2 = 2Ag2S + 2H2O.
Этой реакцией объясняется потемнение серебряных изделий на воздухе.
Электрохимическая коррозия происходит при контакте металлов с электролитами под воздействием возникающих гальванических пар (коррозионных гальванических пар). При электрохимической коррозии протекают одновременно два процесса:
1) анодный процесс (окисление металла): Ме° – ze– = Меz+;
2) катодный процесс (восстановление окислителя):
O2 + 2H2O + 4e– = 4OH– (если окислитель – кислород); 2H+ + 2e– = H2 (если окислитель – кислота).
Кислородная коррозия протекает в нейтральных и основных растворах, а водородная – в кислых растворах.
Пример 1. Рассмотрим процесс электрохимической коррозии оцинкованного и никелированного железа во влажном воздухе (нейтральная среда) и в соляной кислоте, если покрытие нарушено.
Решение. Исходя из положения металлов в ряду стандартных электродных потенциалов находим, что цинк более активный металл
( E°(Zn2+ Zn) = –0,76 В), чем железо ( E°(Fe2+ Fe) = –0,44 B), и в об-
разующейся коррозионной гальванической паре цинк будет анодом, а железо – катодом. Цинковый анод растворяется.
Анодный процесс:
Zn – 2e– = Zn2+.
Электроны с цинка переходят на железо, и на границе железо – электролит происходит восстановление окислителя.
194

Катодный процесс:
2H+ + 2e– = H2 (кислая среда);
O2 + 2H2O + 4e– = 4OH– (нейтральная среда).
Продуктом коррозии в кислой среде является соль ZnCl2, в нейтральной среде – гидроксид Zn(OH)2:
Zn + 2НCl = ZnCl2 + H2 ;
2Zn + O2 + 2H2O = 2Zn(OH)2.
Tаким образом, цинковое (анодное) покрытие защищает железо от коррозии.
В паре Fe – Ni более активным металлом является железо ( E°(Ni2+ Ni) = –0,25 B) , оно выступает в роли анода и подвергается
разрушению. Анодный процесс:
Fe – 2e– = Fe2+.
Катодный процесс:
2H+ + 2e– = H2 (кислая среда);
O2 + 2H2O + 4e– = 4OH– (нейтральная среда).
Продуктом коррозии в кислой среде является соль FeCl2, а в нейтральной – Fe(OH)2, который в присутствии кислорода в электролите окисляется:
Fe + 2НCl = FeCl2 + H2;
2Fe + O2 + 2H2O = 2Fe(OH)2;
4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3.
При этом образуются рыхлые слои бурой ржавчины (FeOOH или
Fe2O3 · nH2O).
Покрытия железа менее активными металлами (катодные покрытия) эффективны до тех пор, пока не нарушены.
Химически чистые металлы более устойчивы к коррозии, чем сплавы металлов.
Пример 2. Чем вызывается коррозия чугуна?
Решение. Чугун имеет неоднородный состав. Чугун – это сплав железа с углеродом, он содержит зерна цементита Fe3С. Между свободным металлом и его соединением возникает коротко замкнутаягальваническая пара. Анодом в этом случае является металл, а като-
195
дом – зерна цементита, так как в нем часть электронов проводимости израсходована на образование химической связи. При наличии влаги железо (анод) начинает переходить в ионы Fe2+, которые дают с ионами OH–, образовавшимися на зернах цементита (катод), гидроксид железа(II), окисляющийся кислородом до ржавчины.
Анодный процесс:
Fe – 2e– = Fe2+.
Катодный процесс:
O2 + 2H2O + 4e– = 4OH–; 4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3.
Методы защиты металлов от коррозии
Основным способом защиты от коррозии является нанесение защитного покрытия. Защитные покрытия бывают неметаллические и металлические. Неметаллические покрытия – это лаки, краски, эмали, оксидные или фосфатные пленки.
Металлические покрытия разделяют на анодные и катодные. Если поверхность защищаемого металла покрыта другим металлом с большей реакционной способностью, то такое покрытие называется анодным. В случае нарушения анодного покрытия разрушается металл покрытия. Если поверхность защищаемого металла покрыта менее активным металлом, то такое покрытие называется катодным. В случае нарушения катодного покрытия разрушается металл основы.
Максимально замедлить процесс коррозии можно путем введения в окружающую среду специальных веществ – ингибиторов. Широкое распространение получили летучие и парофазные ингибиторы, которые защищают от атмосферной коррозии изделия из черных и цветных металлов при хранении и транспортировке. Механизм действия ингибиторов заключается в том, что их молекулы адсорбируются на поверхности металла, препятствуя протеканию электродных процессов.
Электрохимические методы защиты металлических изделий подразделяются на протекторную, катодную, электродренажную и анодную защиты. Протекторная защита заключается в присоединении к защищаемому сооружению более активного металла, который выполняет роль протектора и разрушается, а металлическая конструкция (катод) сохраняется. Например, для защиты подземных сооружений (трубопроводов) на некотором расстоянии от них закапывают металлолом (протектор), присоединив его к сооружению. Протектор периодически возобновляется в связи с его растворением.
196
При катодной защите защищаемая конструкция присоединяется к отрицательному полюсу источника электрического тока. В ту же среду помещают кусок металлолома, который соединяют с анодом внешнего источника тока. Металлический лом подвергается разрушению, предохраняя тем самым от разрушения защищаемую конструкцию.
При электродренажной защите блуждающие токи с защищаемого трубопровода отводятся с помощью электродренажной установки к рельсовой сети (источнику блуждающих токов).
Смысл анодной защиты заключается в создании на поверхности защищаемой конструкции пассивирующей пленки с помощью анодной поляризации от внешнего источника постоянного тока, т. е. переводом металла в устойчивое пассивное состояние.
197
Тема26. СТРОЕНИЕ АТОМА.
ИСТОРИЧЕСКИЕ СВЕДЕНИЯ
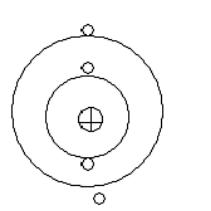
Слово атом происходит от древнегреческого «атомос» — неделимый. Понятие «атом» впервые сформулировал древнегреческий философ Демокрит (IV–III вв. до н. э.), который считал, что все предметы окружающего нас мира состоят из мельчайших неделимых частиц. Представление о неделимости атома просуществовало более двух тысяч лет, до начала ХХ в. Открытие явления радиоактивности (А. Беккерель, 1896) и опыты Э. Резерфорда (1911) по рассеянию α-частиц веществом говорили о сложном строении атома. Опыты Резерфорда показали, что основная доля α-частиц проходила через металлические пластинки беспрепятственно, т. е. подавляющая часть пространства атома является «пустой», а почти вся его масса занимает очень малую долю объема. Резерфордом была предложена планетарная модель атома. Согласно этой модели, атом состоит из положительно заряженного ядра, в котором сосредоточена преобладающая часть массы атома, и вращающихся вокруг него электронов.
Но теория Резерфорда не смогла объяснить, почему электрон, который движется вокруг ядра и непрерывно излучает энергию, не падает на ядро.
Н. Бор в 1913 г. дополнил планетарную модель атома следующими предположениями, названными постулатами Бора:
1)электрон может вращаться вокруг ядра не по любым орбитам, а лишь по некоторым определенным (стационарным) орбитам, на которых он не излучает энергии;
2)ближайшая к ядру орбита соответствует наиболее устойчивому состоянию атома. При сообщении энергии извне электрон может перейти наоднуизболееудаленныхорбит(возбужденноесостояниеатома);
3)поглощение и излучение энергии атомом может происходить только при переходе электрона с одной орбиты на другую (см. рис. на с. 199). При этом разность энергий начального и конечного состояний
воспринимается или отдается в виде кванта лучистой энергии. Этому излучению соответствует частота колебаний v (с–1 или Гц), выражаемая уравнениемПланка:
h v = Eнач – Eкон,
где h – постоянная Планка (h = 6,626 10–34 Дж с); Енач, Екон – соответственно энергии начального и конечного состояний атома.
198
Для того чтобы объяснить, почему имеет место квантование энергетических уровней (существование стационарных орбит), в 1924 г. де Бройлем была выдвинута гипотеза, что каждая движущаяся частица одновременно обладает и свойствами частицы, и свойствами волны, длина которой
|
λ = |
h |
, |
(26.1) |
|
|
|||
|
|
mυ |
|
|
|
где m – массачастицы, υ – скорость частицы, |
|||
|
mυ – импульсчастицы. |
|
||
|
Гипотеза де Бройля была эксперимен- |
|||
|
тально подтверждена дифракцией элек- |
|||
|
тронов в кристаллах и позволяла объяс- |
|||
|
нить существование стационарных орбит. |
|||
Планетарная модель Н. Бора |
Электрон может без потери энергии нахо- |
|||
|
диться на тех орбитах, в которых уклады- |
|||
вается целое число волн де Бройля. В этом случае соблюдается условие существования стоячей волны.
Возможность рассматривать каждую частицу одновременно и как частицу, и как волну называется корпускулярно-волновым дуализмом. В. Гейзенберг в 1927 г. постулировал принцип неопределенности: микрочастица не имеет одновременно точных значений координат и импульса.
Математическое выражение принципа неопределенности:
x p ≥ |
h |
, |
(26.2) |
|
2π |
||||
|
|
|
где x и p обозначают неопределенности в измерении координаты и
импульса частицы. Чем точнее определяются координаты частицы, тем неопределеннее ее импульс (или связанная с ним скорость), и наоборот. Поэтому для описания движения микрочастиц используется вероятностный подход, т. е. определяется не их точное положение, а вероятность нахождения в той или иной области околоядерного пространства.
В квантовой механике электрон представляют как «облако отрицательного заряда», имеющее определенные размеры и форму. Уравнение Шрёдингера (1926 г.) описывает волновые и корпускулярные свойства электрона в атоме водорода:
∂2ψ |
+ |
∂2ψ |
+ |
∂2ψ |
+ |
8π2m (E – U)ψ = 0 |
(26.3) |
∂х2 |
|
∂y2 |
|
∂z2 |
|
h2 |
|
199
где ψ − волновая функция, описывающая поведение электрона; x, y и z − координаты трехмерного пространства; m − масса электрона; h − постоянная Планка; Е и U − соответственно полная и потенциальная энергия электрона в данном состоянии.
Решениями уравнения Шрёдингера являются энергии электрона и волновая функция ψ (пси). Решения возможны только при определенных дискретных значениях энергии электрона: Е1, Е2, …., Еn. Волновая функция ψ зависит от координат (x, y, z) и энергии E электрона и не имеет определенного физического толкования. Квадрат волновой функции ψ2 определяет плотность вероятности нахождения электрона
в точке с координатами (x, y, z). Произведение ψ2 |
V – вероятность |
нахождения электрона в данном объеме атома |
V. Чем больше |
ψ2 V, тем плотнее электронное облако в данном объеме атома. Каждой волновой функции соответствует набор из трех целочисленных параметров – квантовых чисел – n, l, ml . Область пространства, в которой вероятность нахождения электрона составляет не менее 95%,
называют атомной орбиталью.
200
Тема27. КВАНТОВЫЕ ЧИСЛА. ФОРМЫ
И НАПРАВЛЕННОСТЬ ОРБИТАЛЕЙ. ЭЛЕКТРОННЫЕ ФОРМУЛЫ АТОМОВ
Атомные орбитали различаются по энергии, размерам, форме, ориентации в пространстве и могут быть охарактеризованы тремя квантовыми числами (n, l, ml).
n − главное квантовое число, определяет общую энергию электрона и степень его удаления от ядра (номер энергетического уровня). n может принимать целочисленные значения 1, 2, 3, ,∞ . Практически n имеет значения от 1 до 7. В многоэлектронных атомах электроны с одинаковыми значениями n образуют уровень, обозначаемый буквами
K (n = 1), L (n = 2), M (n = 3), N (n = 4), O (n = 5), P (n = 6) и Q (n = 7).
Чем больше значение n, тем слабее электрон связан с ядром. Под значением n, равным ∞, подразумевают, что электрону сообщена энергия, достаточная для его полного удаления от ядра (ионизация атома).
l − орбитальное (побочное, или азимутальное) квантовое число,
определяется орбитальным моментом количества движения электрона, дает информацию об области пространства, в которой может двигаться электрон, т. е. характеризует форму орбитали. l принимает значения 0, 1, 2, …, (n – 1). Число значений l определяет число возможных для данного электронного уровня подуровней. Электроны могут занимать орбитали разных типов в зависимости от значения l, которые называют s-, p-, d-, f-, g-, h-орбиталями. Буквенные обозначения соотносятся с численными следующим образом:
орбитальное квантовое число |
0, 1, 2, 3, 4, 5… |
подуровень |
s p d f g h… |
Подуровни s, р, d, f, g, h различаются по энергии. В пределах данного уровня энергия подуровня увеличивается с ростом l. Чем больше значение l, тем большим запасом энергии обладает электрон. Для энергетической характеристики подуровня служат квантовые числа n и l. Состояние электрона, соответствующее определенным значениям n и l, записывается в виде сочетания цифрового значения n и буквенного l, например 4р (n = 4, l = 1).
ml − магнитное квантовое число, определяет значение проекции орбитального момента количества движения электрона на произвольно выделенную ось z, характеризует пространственную ориентацию электронного облака. ml принимает целые значения от –l до +l,
201

включая нуль, т. е. любому значению l соответствует (2l + 1) значений магнитного квантового числа или (2l + 1) возможных расположений электронного облака данного типа в пространстве. Следовательно, число значений ml указывает на число орбиталей с данным значением l (табл. 27.1).
|
|
Таблица 27.1 |
Число орбиталей на энергетических подуровнях |
||
|
|
|
Орбитальное квантовое |
Магнитное квантовое |
Число орбиталей с данным |
число |
число |
значением l |
l |
ml |
2l + 1 |
0 (s) |
0 |
1 |
|
|
|
1 (p) |
–1, 0, +1 |
3 |
|
|
|
2 (d) |
–2, –1, 0, +1, +2 |
5 |
|
|
|
3 (f) |
–3, –2, –1, 0, +1, +2, +3 |
7 |
Орбитали одного подуровня (l) имеют одинаковую энергию. Такое состояние называют вырожденным по энергии. Так p-орбиталь – трехкратно, d – пятикратно, а f – семикратно вырождены.
s-Электронное облако обладает сферической симметрией (имеет форму шара). p-Электронное облако имеет форму, напоминающую гантель. Еще более сложную форму имеют d-электронные облака
d |
2 |
− y |
2 , d |
xy |
, d |
xz |
, d |
yz |
, d |
2 , |
их ориентация изображена на (рис. 27.1). |
|
||||||||
|
x |
|
|
|
z |
|
|
|
|
|
|
|
z |
|
z |
|
||||
|
|
|
|
z |
|
|
|
|
|
|
|
|
|
|
y |
|
|
|
||
|
|
|
|
|
y |
|
|
|
z |
|
|
z |
+ |
|
+ |
|
+ |
y |
||
|
|
|
|
|
|
|
|
|
y |
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
x |
|
|
|
|
|
x |
|
|
|
|
y |
|
|
|
|
|
|
|
|
|
|
– |
|
+ |
|
|
x |
|
x |
|
– – x |
|
|||
|
|
|
|
|
|
|
|
|
px |
|
|
– |
|
|
|
– |
|
+ |
|
|
|
|
|
|
s |
|
|
|
|
|
|
py |
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
pz |
|
dz2 |
|
|
|
|
|
|
z |
|
|
|
|
|
|
z |
|
|
z |
|
|
|
z |
|
|
|
|
|
|
|
|
y |
|
|
|
y |
|
– |
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
– |
+ |
+ |
y |
|
– |
y |
|
||||
|
|
|
|
|
|
|
|
|
|
|
x |
|||||||||
|
|
|
+ |
|
– |
|
+ |
|
x |
|
|
|
x |
|
x |
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
+ |
|
– + |
|||||||
|
|
|
|
|
|
|
+ |
– |
|
– |
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
dx2 – y2 |
|
|
|
|
|
dxz |
|
|
dyz |
|
|
|
dxy |
|
||
Рис. 27.1. Формы и ориентация s-, p- и d-орбиталей
202

ms – спиновое квантовое число. Изучение тонких эффектов в атомных спектрах показало, что для полного описания состояний электрона в атоме недостаточно трех квантовых чисел. Электрон, обладая электрическим зарядом, проявляет собственное движение, которое приводит к возникновению собственного магнитного момента. Для характеристики этого свойства электрона было введено спиновое квантовое число – ms, принимающее два значения +1/2 и –1/2. Для обозначения электронов с различными спинами (спиновыми квантовыми числами) используются символы ↑(+1/2) и ↓(–1/2).
Все возможные значения четырех квантовых чисел для электронов первых четырех энергетических уровней приведены в табл. 27.2. Каждый электрон характеризуется своим набором квантовых чисел.
|
Значения квантовых чисел для электронов |
Таблица 27.2 |
|||
|
|
||||
|
первых четырех энергетических уровней |
|
|||
|
|
|
|
|
|
Энергетический |
Подуровень |
Орбиталь |
Спин |
Максималь- |
|
уровень |
|
l |
ml |
ms |
ное число |
n |
|
электронов |
|||
|
|
|
|
||
1 |
s |
0 |
0 |
+1/2, –1/2 |
2 |
2 |
s |
0 |
0 |
+1/2, –1/2 |
2 |
2 |
p |
1 |
–1, 0, +1 |
+1/2, –1/2 |
6 |
3 |
s |
0 |
0 |
+1/2, –1/2 |
2 |
3 |
p |
1 |
–1, 0, +1 |
+1/2, –1/2 |
6 |
3 |
d |
2 |
–2, –1, 0, +1, +2 |
+1/2, –1/2 |
10 |
4 |
s |
0 |
0 |
+1/2, –1/2 |
2 |
4 |
p |
1 |
–1, 0, +1 |
+1/2, –1/2 |
6 |
4 |
d |
2 |
–2, –1, 0, +1, +2 |
+1/2, –1/2 |
10 |
4 |
f |
3 |
–3, –2, –1, 0, +1, +2, +3 |
+1/2, –1/2 |
14 |
Электронные конфигурации атомов
Электронная конфигурация элемента − это запись распределения электронов в его атомах по уровням, подуровням и орбиталям. При записи электронной конфигурации элемента следует руководствоваться следующими принципами и правилами.
Принцип Паули: в атоме не может быть двух электронов с одинаковыми значениями всех четырех квантовых чисел. В соответствии с принципом Паули каждая орбиталь не может содержать более двух электронов. Разрешенное расположение спинов:
203

Неразрешенные расположения спинов:
Следствие из принципа Паули: максимальное число электронов на энергетическом уровне равно удвоенному квадрату главного квантового числа 2n2. Следствие из принципа Паули позволяет определить емкость энергетических уровней:
первый 2 12 = 2 электрона; второй 2 22 = 8 электронов; третий 2 32 = 18 электронов; четвертый 2 42 = 32 электрона.
Принцип наименьшей энергии, или принцип заполнения: в
невозбужденном атоме электроны расположены таким образом, чтобы энергия атома была минимальной. Электроны в основном состоянии атома заполняют орбитали в последовательности повышения орбитальных энергетических уровней (рис. 27.2).
Энергия
4d __ __ __ __ __
5s __
4p __ __ __
3d __ __ __ __ __
4s __
3p __ __ __
3s __
2p __ __ __
2s __
1s __
Рис. 27.2. Иллюстрация принципа наименьшей энергии
Низшие по энергии орбитали заполняются первыми. В соответствии с принципом наименьшей энергии порядок заполнения энергетических уровней и подуровней без учета возможных «проскоков» электронов должен быть следующим:
1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10 6p6 7s2 5f14…
Такой порядок заполнения вытекает из правил Клечковского. Первое правило Клечковского: при увеличении заряда ядра атомов запол-
204

нение энергетических уровней происходит от орбиталей с меньшим значением суммы главного и орбитального квантовых чисел (n + l) к орбиталям с большим значением этой суммы. Следовательно, 4s-подуровень (n + l = 4) должен заполняться раньше, чем 3d (n + l = 5). Для атома скандия, например, возникает вопрос: какой из подуровней должен заполняться – 3d или 4p, так как сумма n + l для них одинакова и равна 5. В подобных случаях порядок заполнения определяется вторым правилом Клечковского, согласно которому при одинаковых значениях суммы (n + l) орбитали заполняются в порядке возрастания главного квантового числа n. «Проскоки» электронов наблюдаются у тех атомов, которые имеют на d-орбиталях по 4 и 9 электронов (d4 и d9). Это обусловлено более низкой энергией конфигураций d5 и d10 по сравнению с энергиями конфигураций d4 и d9. Поэтому в тех случаях, когда до образования конфигураций d 5 и d10 не хватает одного электрона, иногда наблюдается «проскок» электрона с внешнего s-подуровня на предвнешнюю d-орбиталь. Принцип наименьшей энергии справедлив только для основных состояний атомов. Если атом находится в возбужденном состоянии, электроны могут находиться на любых орбиталях атомов.
Орбитали с одинаковыми энергиями (вырожденные) заполняются в соответствии с правилом Хунда: заполнение вырожденных орбиталей электронами происходит таким образом, чтобы в атоме в данном подуровне было максимальное число электронов с параллельными спинами (т. е., чтобы Σms электронов была максимальной для данного значения l). Это значит, что сначала на каждой орбитали данного подуровня располагается по одному электрону, а затем по второму с противоположно направленным спином. Например, если на p-орбитали три электрона, то они располагаются так: 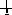
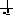
 , и сум-
, и сум-
марный спин Σms = 3/2, а не так: 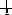
 с Σms = 1/2.
с Σms = 1/2.
Для изображения распределения электронов по орбиталям обычно используют электронные формулы (конфигурации) атомов или энергетические диаграммы, на которых орбитали изображают в виде клеток  . Клетка является символом отдельной орбитали. Электроны изображают в виде стрелок, имеющих различное направление. Клетки располагают в порядке увеличения энергии. Такие схемы распределения электронов в атомах называют электронно-графическими.
. Клетка является символом отдельной орбитали. Электроны изображают в виде стрелок, имеющих различное направление. Клетки располагают в порядке увеличения энергии. Такие схемы распределения электронов в атомах называют электронно-графическими.
Например, нужно записать электронную конфигурацию атома, в котором общее количество электронов равно 11. По принципу наименьшей энергии в первую очередь полностью заполняются наиболее низкие по энергии уровни и подуровни в соответствии с их емкостью, поэтому электронную конфигурацию атома нужно записать 1s22s22p63s1. Первый
205

энергетический уровень заполнен полностью, второй тоже, на третьем уровнеs-орбитальзаполненанаполовину.
Атом азота имеет семь электронов, электронная конфигурация атома: 1s22s22p3. Электронно-графическая схема для атома, находящегося в основном состоянии, представлена на рис. 27.3 (распределение электронов наp-подуровнепроизведенов соответствиисправиломХунда).
Энергия
2p ↑ ↑ ↑
2s ↓↑
1s ↓↑
Рис. 27.3. Электронно-графическая схема атома азота
Для упрощения записи электронно-графические схемы можно изображать без учета различия энергетических уровней, т. е. в строку.
1s |
2s |
|
2p |
|
↓↑ |
↓↑ |
↑ |
↑ |
↑ |
В случае записи полной электронной конфигурации указывают распределение по уровням и подуровням всех электронов, имеющихся в атоме. В случае записи сокращенной электронной конфигурации указывают распределение только валентных электронов (для s- и p- элементов электронов внешнего уровня). Например, полная электрон-
ная конфигурация атома мышьяка с порядковым номером 33 записывается: 1s22s22p63s23p64s23d104p3, сокращенная электронная конфигу-
рация включает информацию только о внешнем электронном уровне: …4s24p3. Из этой записи следует, что элемент находится в 4-м периоде (арабская цифра 4), 5-й группе (5 электронов на внешнем четвертом энергетическом уровне) и главной подгруппе, так как внешний электронный слой содержит только s- и p-электроны.
206
Тема28.ПЕРИОДИЧЕСКАЯ СИСТЕМА
ЭЛЕМЕНТОВД. И. МЕНДЕЛЕЕВА
Периодическая система состоит из периодов и групп. Порядковый номер элемента в периодической системе равен заряду ядра, или количеству протонов в нем, а также количеству электронов в оболочке нейтрального атома.
Период – последовательный ряд элементов, атомы которых различаются числом электронов в наружном слое. Каждый период, кроме первого, начинается типичным металлом (щелочным) и завершается благородным газом. Номер периода совпадает со значением главного квантового числа n внешнего электронного уровня.
Принадлежность элементов к группам и деление их на подгруппы зависит от структуры двух внешних слоев. В соответствии с количеством электронов в этих слоях элементы периодической системы разделены на 8 групп. Номер группы совпадает с числом валентных электронов элемента. Валентными являются в первую очередь ns- и np-электроны (n – номер внешнего электронного слоя), а затем (n–1)d- электроны. Для примера рассмотрим электронные формулы хлора и марганца.
Cl 1s22s22p63s23p5 |
Mn 1s22s22p63s23p63d54s2 |
Подчеркнуты валентные электроны, количество которых в обоих случаях равно 7. В соответствии с этим Cl и Mn находятся в VII группе периодической системы (Cl в главной подгруппе, Mn – в побочной).
Периодичностьсвойствхимическихэлементов
Атомные радиусы
В связи с волновой природой электрона атом не имеет строгих размеров, поэтому радиус атома – условное понятие. Различают кова-
лентные, металлические, ван-дер-ваальсовы и ионные радиусы. Их оп-
ределяют как полусумму соответствующих расстояний между ядрами соседних атомов в молекулах или кристаллах. Существуют также орбитальные радиусы, рассчитанные на основе атомных волновых функций. Радиусы различных типов значительно отличаются друг от друга, поэтому можно сравнивать радиусы атомов в однотипных структурах. Радиус – наиболее важное свойство атома. Чем больше атомный радиус, тем слабее удерживаются внешние электроны.
207
В периоде радиусы атомов уменьшаются слева направо. Это можно объяснить увеличением силы притяжения электронов к ядру с ростом его заряда, что приводит к сжатию электронной оболочки, а значит, к уменьшению радиуса. К концу периодов радиусы атомов возрастают, так как заметную роль играет взаимное отталкивание электронов:
III период |
Na |
Mg |
Al |
Si |
P |
Ar |
Атомный радиус |
1,89 |
1,60 |
1,43 |
1,34 |
1,30 |
1,92 |
В больших периодах (IV–VII) у d- и f-элементов атомный радиус. изменяется более плавно вследствие заполнения электронами второй и третьей снаружи электронной оболочки:
IV период |
Sc |
Ti |
V |
Cr |
Mn |
Fe |
Co |
Ni |
Атомный радиус |
1,61 |
1,45 |
1,32 |
1,25 |
1,24 |
1,26 |
1,25 |
1,24 |
В группах при движении сверху вниз атомный радиус возрастает, так как увеличивается число слоев в электронной оболочке атомов. У элементов главных подгрупп увеличение радиуса выражено сильнее, чем в побочных подгруппах. При переходе от V к VI периоду радиусы атомов элементов побочных подгрупп практически не изменяются. Это является следствием сжатия электронной оболочки при заполнении d- и f-орбиталей (d- и f-сжатие):
V период |
Zr |
Nb |
Mo |
Атомный радиус |
1,57 |
1,43 |
1,36 |
VI период |
Hf |
Ta |
W |
Атомный радиус |
1,57 |
1,43 |
1,37 |
Энергия ионизации. Сродство к электрону
В химических реакциях ядра атомов не подвергаются изменению, электронная же оболочка перестраивается, причем атомы способны превращаться в положительно и отрицательно заряженные ионы. Химическая активность элементов определяется способностью их атомов терять или приобретать электроны. Количественно это характеризуется энерги-
ей ионизации (Еи) или потенциалом ионизации (I) и сродством к электрону (Ее_).
Энергия ионизации (Еи) – это минимальная энергия, которую необходимо затратить для отрыва наиболее слабо связанного электрона от невозбужденного атома (Эг), эта величина определена для процесса, происходящего в газовой фазе:
Эг + Еи → Эг+ + е–.
208
Еи обычно выражается в кДж/моль или в электроновольтах (эВ). 1 эВ = 96,5 кДж/моль. Энергия ионизации, выраженная в электроновольтах, численно равна потенциалу ионизации в вольтах (I), т. е. наименьшему напряжению электрического поля, при котором происходит ионизация атомов. Первый потенциал ионизации (I1) соответствует ионизации нейтрального атома. Второй, третий и последующие потенциалы ионизации соответствуют ионизации катионов. Следова-
тельно, I1 < I2 < I3 <…< In.
В периодах энергия ионизации атомов возрастает слева направо. Это вызвано сжатием электронной оболочки с ростом заряда ядра, которое приводит к более прочной связи внешних электронов с ядром. В пределах декад переходных элементов, а также f-элементов значения Еи также увеличиваются, но незначительно, так как мало изменяются радиусы атомов. Наименьшая энергия ионизации у s-элементов I группы – щелочных металлов, имеющих наибольший радиус и один валентный электрон (ns1), наибольшая – у р-элементов VIII группы (благородные газы). Изменение энергии ионизации по периоду носит немонотонный характер. Нарушение тенденции возрастания I наблюдается в результате повышенной энергетической устойчивости электронных конфигураций с полностью или ровно наполовину занятыми подуровнями. Например, I уменьшается при начале заполнения p-орбиталей (B) и при появлении
спаренных электронов на внешних p-орбиталях (О): |
|
|
||||||
I1, эВ |
Li |
Be |
B |
C |
N |
O |
F |
Ne |
5,39 |
9,32 |
8,30 |
11,26 |
14,53 |
13,61 |
17,42 |
21,56 |
|
В подгруппах сверху вниз энергия ионизации уменьшается. Это объясняется увеличением числа электронных слоев в оболочке атомов, а значит – возрастанием атомного радиуса, что, в свою очередь, ослабляет притяжение внешних электронов к ядру.
Сродство к электрону (Ее_) – способность атома в газообразном состоянии (Эг) присоединять электрон с образованием отрицательно заряженного иона (Эг− ), количественно характеризуется изменением
энтальпии (энергии) процесса:
Эг + е– → Эг− ± Ее_.
Такой процесс может быть как эндо-, так и экзотермическим. Сродство к электрону выражается в кДж/моль или эВ. По сравнению с энергией ионизации сродство к электрону невелико, поскольку присоединение избыточного электрона приводит к усилению межэлектронного отталкиванияиповышению энергииатомнойорбитали.
209
Минимальное сродство к электрону наблюдается у атомов, имеющих завершенные s2- и s2p6-орбитали, мало оно и у атомов с конфигурацией валентных электронов …s2p3 (N, P, As). Наибольшим сродством к электрону обладают атомы р-элементов VIIА группы, имеющие конфигурацию валентных электронов …s2p5. Как правило, у элементов III периода сродство к электрону больше, чем у элементов
IIпериода.
Вбольшинстве случаев сродство к электрону в ряду атомов элементов изменяется в той же последовательности, что и их энергия ионизации: по периоду увеличивается слева направо, по группе уменьшается сверху вниз.
Энергия ионизации и сродство к электрону связаны также с химиче-
скими свойствами элементов. Так, элементы, имеющие небольшие значенияЕи иЕе_ обладаютярковыраженными металлическимисвойствами.
Электроотрицательность
Электроотрицательность (χ) характеризует относительную способность атомов перетягивать к себе электроны, связывающие их с другими атомами в гетероатомной молекуле. Существует несколько способов количественной оценки электроотрицательности.
Наиболее часто используется шкала относительной электроотрицательности Полинга, который впервые ввел это понятие. По шкале Полинга относительная электроотрицательность Li равна 1, а наиболее электроотрицательного элемента F – 4,0.
Электроотрицательность элементов уменьшается сверху вниз по группе и увеличивается слева направо по периоду. Ниже приведены относительные электроотрицательности некоторых элементов.
|
Li |
Be |
B |
C |
N |
O |
F |
ЭО |
1,0 |
1,5 |
2,0 |
2,5 |
3,1 |
3,5 |
4,0 |
|
Na |
K |
Rb |
Cs |
Cl |
Br |
I |
ЭО |
0,9 |
0,8 |
0,8 |
0,7 |
3,0 |
2,8 |
2,6 |
Наибольшее значение электроотрицательности имеет фтор, наименьшее – цезий. Водород занимает промежуточное положение, т. е. при взаимодействии с одними элементами (например, F) он отдает электрон, а при взаимодействиисдругими(например, Rb) – приобретаетэлектрон.
Строго говоря, элементу нельзя приписать постоянное значение электроотрицательности. Она зависит от валентного состояния элемента, типа соединения, в которое он входит и др.
210
