
- •ВВЕДЕНИЕ
- •Тема 2. ОСНОВНЫЕ ЗАКОНЫ ХИМИИ
- •Оксиды
- •Кислоты
- •Соли
- •Тема 4. ЭНЕРГЕТИКА ХИМИЧЕСКИХ РЕАКЦИЙ
- •Тема 5. ТЕРМОХИМИЧЕСКИЕ РАСЧЕТЫ
- •Тема 7. ПОНЯТИЕ ОБ ЭНТРОПИИ
- •Тема 9. СМЕЩЕНИЕ ХИМИЧЕСКОГО РАВНОВЕСИЯ
- •Тема 13. РАСТВОРЫ ЭЛЕКТРОЛИТОВ
- •Тема 15. ВОДОРОДНЫЙ ПОКАЗАТЕЛЬ
- •Тема 16. ГИДРОЛИЗ СОЛЕЙ
- •Тема 17. ПРОИЗВЕДЕНИЕ РАСТВОРИМОСТИ
- •Тема 20. ТЕОРИИ КИСЛОТ И ОСНОВАНИЙ
- •Гальванические элементы
- •Тема 23. ЭЛЕКТРОЛИЗ
- •Кислотно-основные свойства соединений
- •Тема 32. ТЕОРИЯ КРИСТАЛЛИЧЕСКОГО ПОЛЯ
- •ЛИТЕРАТУРА
Записываем выражение для произведения растворимости AgCl:
ПР = C(Ag+ ) C(Cl− ) =1,77 10−10 .
Концентрация ионов серебра в насыщенном растворе равна концентрации ионов хлора:
C(Ag+ ) = C(Cl− ).
Тогда из выражения для ПР находим концентрацию ионов серебра: (C(Ag+ ))2 = 1,77 10–10,
C(Ag+ ) = 1,77 10−10 =1,33 10−5 моль/л.
Значение стандартного электродного потенциала берем из справочника и вычисляем значение потенциала серебряного электрода:
E(Ag+ |Ag) = 0,8 + 0,059 lg(1,33 10–5) = 0,8 + 0,059 (–4,87) = 0,512 В.
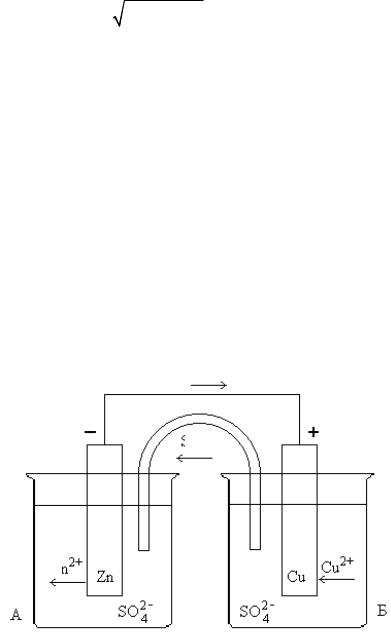
Гальванические элементы
Устройства, которые обеспечивают превращение энергии химической реакции в электрическую работу, называются гальваническими элементами. Они должны иметь в своем составе два электрода – металлы, погруженные в растворы электролитов, которые содержат соответственно окислитель и восстановитель. Растворы должны сообщаться друг с другом солевым мостиком (на рис. 22.3 – В) или пористой перегородкой, которая обеспечивает прохождение через электролиты электрического тока и препятствует непосредственному взаимодействию окислителя и восстановителя.
e–
В
 SO24−
SO24−
|
|
Zn2+ |
|
|
|
|
|
|
|
|
|
Cu2+ |
|
||
|
Zn |
|
|
|
Cu |
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
SO42− |
|
SO42− |
|
|
|
|
|
|
|
|
|
|
|
|
|
Б |
|||||||||
A |
|
||||||||||||||
|
|
|
|
|
|
||||||||||
Рис. 22.3. Конструкция гальванического элемента Даниэля – Якоби
176
Электрод, на котором происходит процесс восстановления, называется катодом, а электрод, на котором происходит процесс окисления, анодом. Электроны во внешней цепи будут перемещаться от анода к катоду. Поэтому в гальваническом элементе анод имеет отрицательный потенциал «–», а катод – положительный потенциал «+». Разность потенциалов катода Eк и анода Eа называется электродвижущей силой (ЭДС) гальванического элемента:
ЭДС = E = Eк − Eа .
Например, в гальваническом элементе, состоящем из цинкового и медного электродов (элемент Даниэля – Якоби), цинковый электрод является анодом, медный электрод – катодом (рис. 22.3).
Поскольку самопроизвольно электроны могут переходить только от электрода с большей концентрацией электронов к электроду с их меньшей концентрацией, то в процессе действия рассматриваемого гальванического элемента электроны во внешней цепи движутся от цинка к меди. На цинковом электроде происходит процесс окисления. Медный электрод в данном случае играет роль инертного электрода, который передает электроны, поступившие от цинка, ионам меди, находящимся в растворе сульфата меди. Таким образом, на медном электроде происходит восстановление катионов меди.
Во внутренней цепи сульфат-ионы, оказавшиеся в избытке в катодном пространстве, переходят через солевой мостик (или пористую перегородку) в анодное пространство, где компенсируют заряды образовавшихся при окислении ионов цинка.
Восновеработыданногогальваническогоэлементалежитреакция
Zn + CuSO4 = Cu + ZnSO4.
Элемент будет работать до тех пор, пока цинковый анод полностью нерастворитсяили невосстановитсявся медьизрастворасульфатамеди.
Zn – 2e– = Zn2+ – процесс окисления на аноде
Cu2+ + 2e– = Cu – процесс восстановления на катоде
Zn + Cu2+ = Zn2+ + Cu – суммарная реакция в ионном виде
При схематическом изображении гальванического элемента граница раздела между металлом и раствором электролита изображается вертикальной чертой, а граница между растворами электролитов – двойной вертикальной чертой. Например, схема гальванического элемента, в основе работы которого лежит реакция
Zn + CuSO4 = ZnSO4 + Cu,
изображается следующим образом:
177
анод Zn|ZnSO4||CuSO4|Cu катод.
Эта же схема может быть изображена в ионной форме:
анод Zn|Zn2+||Cu2+|Cu катод.
Знаки «–» и «+» электродов и соответственно анод и катод находим из сравнения стандартных электродных потенциалов:
E°(Zn2+|Zn) = –0,76 B меньше E°(Cu2+|Cu) = 0,34 B.
∆E° = E°(Cu2+|Cu) – E°(Zn2+|Zn) = 0,34 – (–0,76) = 1,1 В.
Иногданасхемеуказываютконцентрациюэлектролитовврастворе:
анод Zn|0,1 н. ZnSO4||0,1 М CuSO4|Cu катод.
Для реакции
Zn + 2HCl = ZnCl2 + H2
схема гальванического элемента будет иметь следующий вид:
анод Zn|ZnCl2||HCl|H2(Pt) катод,
где H2(Pt) обозначает водородный электрод, состоящий из инертного металла Pt, выполняющего здесь роль катода, на котором идет восстановление катионов водорода:
{Н+}aq + e– = 12 (Н2).
На аноде происходит окисление цинка
Zn – 2e– = Zn2+.
Этажесхемаэлементавионнойформебудетиметьследующийвид:
анод Zn|Zn2+|| H+|H2(Pt) катод.
Пример 5. Гальванический элемент состоит из металлического цинка, погруженного в 0,1 н. раствор нитрата цинка, и металлического свинца, погруженного в 0,02 М раствор нитрата свинца. Вычислить ЭДС гальванического элемента, написать уравнения электродных процессов, составить схему гальванического элемента.
Решение. Чтобы определить, какой из электродов будет катодом, а какой – анодом, рассчитаем и сравним электродные потенциалы цинкового и свинцового электродов. Расчет проведем по уравнению Нернста. Вычисляем электродный потенциал цинкового электрода, на котором устанавливается электродное равновесие:
178
Zn2+ + 2e– = Zn.
Уравнение Нернста для цинкового электрода будет иметь вид
E(Zn2+ |Zn) = E°(Zn2+ |Zn) + |
0,059 |
lgC(Zn2+ ) . |
|
2 |
|
Находим концентрацию ионов цинка в растворе:
Zn(NO3 )2 → Zn2+ + 2NO3− (α = 1, сильный электролит), C(Zn2+ ) = α n С0 = 1 1 С0 = С0 =
= С(Zn(NO3)2) = 1 С( 1 Zn(NO3)2) = |
1 |
0,1 = 0,05 моль/л. |
|
z |
z |
2 |
|
Рассчитываем потенциал цинкового электрода: |
|||
E(Zn2+ |Zn) = –0,76 + 0,059 |
lg0,05 = –0,76 + |
0,059 (–1,301) = –0,80 В. |
|
2 |
|
|
2 |
Вычисляем электродный потенциал свинцового электрода: Pb2+ + 2e– = Pb.
E(Pb2+ |Pb) = E°(Pb2+ |Pb) + 0,059 lgC(Pb2+ ). 2
Pb(NO3 )2 → Pb2+ + 2NO3− (α = 1, сильный электролит),
C(Pb2+ ) = α n С0 = 1 1 С0 = С0 = С(Pb(NO3)2) = 0,02 моль/л.
Находим потенциал свинцового электрода:
E(Pb2+ |Pb) = –0,13 + |
0,059 |
lg0,02 = –0,13 + |
0,059 |
(–1,699) = –0,18 В. |
|
2 |
|
2 |
|
Сравнение электродных потенциалов цинкового и свинцового электродов показывает, что электродный потенциал цинкового электрода меньше (–0,80 В), чем свинцового (–0,18 В).
Значит, цинковый электрод будет иметь знак «–» и будет анодом, на котором происходит окисление металлического цинка:
анод Zn – 2e– = Zn2+,
а свинцовый электрод будет иметь знак «+» и будет катодом, на котором идет процесс восстановления ионов свинца:
катод Pb2+ + 2e– = Pb.
Схема гальванического элемента будет иметь следующий вид:
179
анод Zn|0,1 н. Zn(NO3)2||0,02 М Pb(NO3)2|Pb катод.
ЭДС элемента равна:
Е = Ек – Еа = E(Pb2+ |Pb) – E(Zn2+ |Zn) = –0,18 – (–0,80) = 0,62 В.
Направление протекания окислительно-восстановительных реакций
Понятие электродного потенциала применимо к любой сопряженной системе окисленная форма|восстановленная форма. Количественной ха-
рактеристикой окислительно-восстановительных систем, в которых и окислитель, и восстановитель находятся в растворенном состоянии, является окислительно-восстановительный потенциал. Окислительно-вос- становительный потенциал, измеренный с использованием электрода из инертного металла (переносчика электронов) при стандартных условиях, называется стандартным окислительно-восстановительным потенциалом. В электрохимии принято все электродные равновесия записывать в направлении процессавосстановления, тоестьприсоединенияэлектронов:
MnO −4 + 8H+ + 5e– = Mn2+ + 4Н2О, Е° = 1,51 В.
Значения стандартных окислительно-восстановительных потенциалов сведены в справочные таблицы и используются для термодинамическогоанализавозможностипротеканияОВРв водныхрастворах.
Используя значения стандартных электродных потенциалов, можно определить возможность и глубину протекания окислительновосстановительных реакций. Чем более отрицательным является значение Е°, тем лучшим восстановителем является вещество, и, наоборот, чем более положительное значение Е°, тем лучшим окислителем является вещество. Например, из двух веществ – цинка и H2SO3 – более сильным восстановителем является Zn:
Zn2+ + 2e–= Zn; Е° = –0,76 B;
SO 24− + 4H+ + 2e–= H2SO3 + H2O; Е° = 0,17 B.
Сопоставляя окислительные способности оксида марганца(IV) и пер- манганат-иона в кислой среде, можно сделать вывод, что ион MnO−4 является более сильным окислителем, так как для соответствующего окисли- тельно-восстановительногопроцессазначениеЕ° болееположительно:
MnO2 + 4H+ + 2e–= Mn2+ + 2H2O; Е° = 1,23 B;
MnO −4 + 8H+ + 5e– = Mn2+ + 4H2O; Е° = 1,51 B.
180

Энергия Гиббса окислительно-восстановительной реакции ( G° )
298
может быть выражена как работа электрического тока, совершаемая в гальваническом элементе, и может быть связана с ЭДС элемента. Эта связь для стандартных условий определяется соотношением
G298° = –zF∆E°,
где z – число молей электронов, участвующих в данной реакции, моль (определяется как наименьшее общее кратное от принятых и отданных электронов); F – постоянная Фарадея, равная 96 484 Кл/моль; E° – стандартная ЭДС гальванического элемента, в основе которого лежит данная реакция, В.
Значения E° вычисляют через стандартные окислительно-восста- новительные потенциалы, причем от потенциала окислителя нужно вычитать потенциал восстановителя:
E° = E°(ок-ля) – E°(вос-ля).
Значения стандартных окислительно-восстановительных потенциалов могут быть использованы для вычисления констант равновесия реакций исходя из следующего соотношения:
G° = –RTlnKC = – zF E°.
298
После подстановки в последнее выражение постоянных F и R, а также стандартной температуры 298 К (так как значения стандартных потенциалов приводятся при стандартной температуре) и после перехода от натурального логарифма к десятичному выражение для константы равновесия примет следующий вид:
z E°
lgKC = 0,059z E° или KC = 100,059 .
Энергия Гиббса реакции служит критерием для определения термодинамической возможности протекания реакций и для установления направления протекания обратимых реакций. Реакция термоди-
намически возможна, или протекает слева направо, если
∆G° < 0, ∆E° > 0, KC > 1, |
E°(ок-ля) > E°(вос-ля). |
Реакция термодинамически невозможна, или протекает справа |
|
налево, если |
|
∆G° > 0, ∆E° < 0, KC < 1, |
E°(ок-ля) < E°(вос-ля). |
Чембольше значение∆E°298 , темболееглубокопротекаетпроцесс.
181
Пример 6. Определить G° |
и направление окислительно-вос- |
298 |
|
cтановительной реакции
K2Cr2O7 + 6KI + 7H2SO4 = Cr2(SO4)3 + 3I2 + 4K2SO4 + 7H2O.
Решение. Для определения возможности осуществления ОВР необходимо сравнить окислительно-восстановительные потенциалы E° соответствующих процессов окисления и восстановления:
Сr2O 72− + 14H+ + 6e– = 2Cr3+ + 7H2O; Е° = 1,33 B; I2 + 2e– = 2I–; E° = 0,54 B.
Значения E° показывают, что ион Сr2O 72− является более сильным
окислителем, |
чем I2. Следовательно, реакция будет протекать в пря- |
||||
мом направлении. |
|
|
|
||
|
E° |
= E°(ок-ля) − |
E°(вос-ля) = 1,33 − 0,54 = 0,79 В. |
||
|
298 |
|
|
|
|
G° |
= – zF |
E° |
= –6 · 96 500 · 0,79 = –457 410 Дж = –457,41 кДж. |
||
298 |
298 |
|
|
||
|
|
|
|
z E° |
6 0,79 |
|
|
|
КC = 100,059 |
= 10 0,059 = 2,18 1080. |
|
КC >> 1. Протекает прямая реакция практически необратимо. Пример 7. Для окислительно-восстановительной реакции
|
KMnO4 + Al + H2SO4 →… |
определить G° |
и значение константы KC при 298 К. |
298 |
|
Решение. Запишем уравнение реакции:
6KMnO4 + 10Al + 24H2SO4 = 5Al2(SO4)3 + 6MnSO4 + 3K2SO4 + 24H2O.
Полуреакции окисления, восстановления и их значения E°:
MnO −4 + 8H+ + 5e– = Mn2+ + 4H2O; Е° = 1,51 B;
|
Al – 3e– = Al3+; Е° = –1,66 B. |
|||
|
E° |
|
= 1,51 – (–1,66) = 3,17 B. |
|
|
298 |
|
|
|
G° |
= –zF E° |
= –15 · 96 500 · 3,17 = –4 588 575 Дж = |
||
298 |
298 |
|
= –4588,6 кДж. |
|
|
|
|
||
|
|
z E° |
15 3,17 |
|
|
KC = 10 |
0,059 |
= 10 0,059 = 8,55 · 10805. |
|
Значение KC очень велико, что свидетельствует о практической необратимости прямой реакции.
182
