
Курс лекций Ашуйко
.pdfКурс лекций
«ТЕОРЕТИЧЕСКИЕ ОСНОВЫ ХИМИИ»
Ашуйко Валерий Аркадьевич
Кафедра «ОНХ»
ХИМИЯ КАК РАЗДЕЛ ЕСТЕСТВОЗНАНИЯ.
СВЯЗЬ ХИМИИ С ДРУГИМИ НАУКАМИ. ОСНОВНЫЕ ЗАКОНЫ И ПОНЯТИЯ ХИМИИ
Химия как один из важнейших разделов естествознания опирается на совокупность законов природы, получивших названия фундаментальных за-
конов. К ним относятся: закон сохранения массы-энергии, закон периодично-
сти развития. Химия – изучает материальный мир во всем многообразии форм его существования и происходящих явлений. При протекании химических реакций вещества превращаются одно в другое. Под веществом понимают совокупность атомов химических элементов и их соединений во всех пяти состояниях: твердом, жидком, газообразном, плазменном (при сверхвысоких температурах) и сверхметаллическом (при гигантских давлениях). Вещество характеризуется массой (мера инерции), гравитацией, зарядом, движением.
Среди основных задач химии можно назвать следующие:
1.Получение разных веществ с заданными, порой уникальными свойствами.
2.Переработка природного сырья с целью получения металлов
идругих материалов.
3.Создание безотходных технологий.
4.Ядерная энергетика.
5.Генная инженерия.
По каждой из областей использования химии можно привести много примеров. Так современная техника оперирует большими мощностями за счет реакций окисления топлива или за счет энергии ядерных превращений. Высокая энергонасыщенность техники ставит задачи перед конструкторами и технологами снижения массы машин, что требует новых конструкционных материалов: негорючих полимеров, керамических, стекло- и композиционных материалов.
Создание новой техники идет не только по пути замены металлов на неметаллы, но и по пути получения сплавов или по пути новых способов обработки металлов. Порошковая металлургия – целая отрасль производства металлических изделий. При создании техники происходит замена клепки пайкой, сваркой или клеением, широко используется вакуумное напыление, литье, прессование взрывом.
Постепенное обеднение природного сырья полезных ископаемых по со-
держанию того или иного элемента приводит к развитию не традиционных способов их извлечения (гидрометаллургия).
Однако, в последние годы в связи с проблемами загрязнения окружающей среды перед химией все шире и шире ставятся задачи создания безотходных производств и разработки способов снижения или полного уничтожения последствий загрязнения окружающей среды.
Запасы нефти, каменного угля на земле ограничены, поэтому энергетические проблемы человечества не могут быть решены в ближайшем будущем безатомной энергетики.
Генная инженерия занимается решением задач связанных с обеспечением человечества продуктами питания, созданием новых по способу воздействия на человеческий организм лекарственных препаратов и др.
Химия как один из важнейших разделов естествознания опирается на совокупность законов природы, получивших названия фундаментальных за-
конов. К ним относятся: закон сохранения массы-энергии, закон периодичности развития.
Закон сохранения массы-энергии выражают соотношением
E=mc2
где E и m – эквивалентные значения энергии и массы; c – скорость света в вакууме, равная 2,9979·105 м/с
Это означает, что никакой химический процесс не осуществляется без изменения массы вещества. Энергия, сообщаемая массе вещества, расходуется как на увеличение скорости, так и на приращение массы.
Закон периодичности развития. Примерами периодичности развития служат системы элементарных частиц, ядер атомов, электронных оболочек атомов, химических соединений. Эта периодичность была обобщена Д.И.Менделеевым в периодическом законе.
Помимо фундаментальных законов химии, химическая форма движения материи подчиняется большому числу частных законов, так называемых сте-
хиометрических законов:
Закон сохранения массы: масса веществ, вступивших в химическую реакцию, равна массе веществ, образовавшихся в результате реакции. Так как в химических реакциях атомы не исчезают и не появляются вновь.
2H2 + |
O2 |
= 2H2O |
4 г |
32 г |
2 18 г |
36 г |
= |
36 г |
Закон постоянства состава: всякое чистое вещество, независимо от способа его получения, имеет постоянный качественный и количественный состав.
CaCO3 t→CaO + CO2;
2CO + O2 →2CO2;
CH4 + 2O2 →CO2 + 2H2O.
Этот закон применим только к соединениям с молекулярной структу-
рой.
Как вытекает из закона постоянства состава, элементы взаимодейству-

ют между собой в строго определенных количественных соотношениях. Поэтому мы можем говорить об их эквивалентности (равноценности) при образовании химических соединений. Эквивалентность присуща и взаимодействию сложных веществ. Она отражается в законе эквивалентов.
Закон эквивалентов: массы взаимодействующих без остатка веществ пропорциональны молярным массам эквивалентов этих веществ:
M (1 X)
(z ).
M 1z Y
Эквивалент – реальная или условная частица вещества, которая в данной кислотно-основной реакции равноценна (эквивалентна) одному иону водорода или в данной окислительно-восстановительной реакции – одному электрону.
Фактор эквивалентности – это число, обозначающее, какая доля реальной частицы вещества эквивалентна одному иону водорода в данной ки- слотно-основной реакции или одному электрону в данной окислительно-
восстановительной реакции. Фактор эквивалентности (fэкв = 1z ) может равняться единице или быть меньше ее.
Молярная масса эквивалента вещества ( M (1z X)) равна произведению
фактора эквивалентности fэкв(Х) на молярную массу вещества Х. Молярную массу эквивалента различных веществ можно рассчитать по следующим формулам:
M (1z оксида) |
= |
|
М(оксида) |
|
|
; |
|
|
степень окисления элемента число его атомов |
|
|||||||
M (1z кислоты)= |
|
|
М(кислоты) |
|
|
|
; |
|
число ионов Н+, способных замещаться на металл |
||||||||
M (1 |
основания)= |
М(основания) |
|
; |
|
|
||
число гидроксогрупп ОН |
− |
|
|
|||||
z |
|
|
|
|
|
|
|
|
M (1z соли)= степень окисления металла число его атомов . Например:
M (1z H3PO4 )= 13 M (H3PO4 ); M (1z Ca (OH)2 )= 12 M (Ca (OH)2 );
M (1z Fe2 (SO4 )3 )= 16 M (Fe2 (SO4 )3 ).
Молярную массу эквивалента элемента в соединении можно рассчитать по формуле

M (1z элемента)= степень окисления элемента . Например, в оксиде серы (VI) молярная масса эквивалента серы равна
M (1z S)= М6(S) = 326 =5,33 г/моль.
Закон Авогадро: в равных объемах (V) различных газов при одинаковых условиях (температуре Т и давлении Р) содержится одинаковое число молекул.
Состояние газа определяют: Р – давление, V – объем, Т – температура. Нормальные условия (н. у.) для газов: давление 1,013 105 Па (1 атм =
760 мм рт. ст.), температура 273 К (0°С).
Следствия из закона Авогадро.
Следствие 1. Одинаковое число молекул различных газов при одинаковых условиях (Р, Т) занимает одинаковый объем.
Так как 1 моль любого вещества содержит одинаковое число структурных единиц (NA = 6,02 1023моль–1), то 1 моль любого газа при нормальных условиях занимает одинаковый объем, равный 22,4 л/моль. Эта величина на-
зывается молярным объемом Vm.
V |
= |
V (X) |
, отсюда n(X)= |
V (X) |
, |
|
n(X) |
V |
|||||
m |
|
|
|
|||
|
|
|
|
m |
|
где n(X) – химическое количество вещества X, моль; V(X) – объем газа X (н. у.), л; Vm – молярный объем газа X, л/моль.
Количество вещества n(X) можно рассчитать также:
n(X)= m((X)) и n(X)= N ,
M X NA
где m(X) – масса вещества X, г; М(X) – его молярная масса, г/моль; N – число структурных единиц в порции вещества X; NA – постоянная Авогадро
(6,02 1023моль–1).
Следствие 2. Относительная плотность одного газа (X) по другому (Y) равна отношению их молярных масс (М) при заданных давлении и температуре:
DY (X)= MM ((XY)),
где DY – относительная плотность газа X по газу Y; М(X) и М(Y) – их молярные массы.
Объединенный газовый закон: для данной массы газа произведение давления на объем, деленное на абсолютную температуру, есть величина постоянная:

PV |
= const или |
P0V0 |
= |
PV |
, |
|
T |
T |
T |
||||
|
|
|
||||
|
|
0 |
|
|
|
где P, V,T – давление, объем, температура при условиях, отличных от нормальных; P0, V0, T0 – давление, объем, температура данной массы газа при нормальных условиях.
Уравнение Менделеева – Клапейрона: для одного моля любого газа ве-
PV
личина T00 0 одинакова и называется универсальной газовой постоянной (R).
Для n молей газа:
PV = nRT = Mm RT .
Числовые значения универсальной газовой постоянной R зависят от выбора единиц измерения параметров P, T, V. В Международной системе единиц
R = 8,314 Дж/(моль К).
Пример:
Определите молярную массу эквивалента Fe(OH)3 в реакциях:
1)Fe(OH)3 + 3HCl = FeCl3 + 3H2O; 2)Fe(OH)3 + HCl=Fe(OH)2Cl + H2O.
Решение. В первой реакции 1 моль Fe(OH)3 соответствует 3 моль ионов водорода, следовательно, фактор эквивалентности равен 13 :
M (13 Fe(OH)3 )= 13 M (Fe(OH)3 )= 13 107 =35,7 г/моль.
Во второй реакции 1 моль Fe(OH)3 соответствует 1 моль ионов водорода, следовательно, фактор эквивалентности равен 1, поэтому молярная масса эквивалента Fe(OH)3 совпадает с его молярной массой:
M (11Fe(OH)3 )=11 M (Fe(OH)3 )=1 107 =107 г/моль.
ОСНОВНЫЕ КЛАССЫ НЕОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
Неорганические соединения по составу делятся на гомо- и гетеросоединения. Гомосоединения – это вещества, состоящие из атомов одного элемента. Они подразделяются на металлы и неметаллы. Гетеросоединения, или сложные вещества, состоят из атомов двух или более элементов.
Основными классами неорганических соединений являются оксиды,
основания, кислоты и соли: |
K2O, CuO, BaO |
|
Оксиды |
а) основные |
|
б) амфотерные |
ZnO, Al2O3, Cr2O3 |
|
Основания |
в) кислотные |
SO2, CrO3, N2O5 |
|
NaOH, Fe(OH)2, Fe(OH)3 |
|
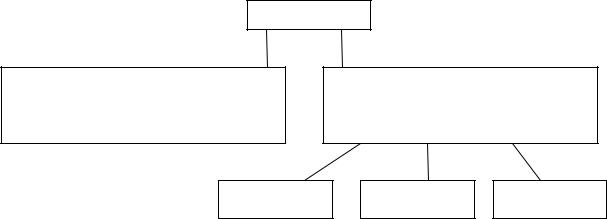
Кислоты |
|
HCl, HNO3, H3PO4 |
|
а) средние |
Na2SO4, KCl, Al(NO3)3 |
Соли |
б) кислые |
NaHCO3, CaHPO4, KH2PO4 |
в) основные |
Fe(OH)2Cl,(MgOH)2SO4,(CuOH)2CO3 |
|
|
г) двойные |
NaKCO3, KAl(SO4)2 |
|
д) смешанные |
Ca(ClO)Cl, MgPO3F |
Основания и кислородсодержащие кислоты часто рассматриваются как гидраты оксидов и объединяются в единый класс гидроксидов, имеющих основной, амфотерный или кислотный характер.
ОКСИДЫ
Оксидами называются бинарные соединения, в которых один из элементов кислород, причем атомы кислорода не связаны межу собой и находятся в степени окисления -2.
Название оксида состоит из слова оксид и названия элемента в родительном падеже. Переменная степень окисления указывается в скобках:
FeO – оксид железа (II) Fe2O3 – оксид железа (III)
КЛАССИФИКАЦИЯ ОКСИДОВ
ОКСИДЫ
Несолеобразующие (безразличные или индифферентные) Солеобразующие
N2O, NO, СО, SiO
основные |
амфотерные |
кислотные |
Основные оксиды – это оксиды металлов в невысокой степени окис-
ления +1, +2. Исключение составляют оксиды BeO, ZnO, SnO, PbO, являющиеся амфотерными.
Основными называются оксиды, которые взаимодействуют с кислотами, образуя соли. Основным оксидам отвечают гидроксиды – основания. Например:
Основной оксид |
Основание |
Са+2О |
Ca+2(OH)2 |
Na 2+1 O |
Na+1OH |
+2 |
Fe+2(OH)2 |
Fe O |
|
Амфотерные оксиды – оксиды металлов в степенях окисления +3, +4 и вышеперечисленные в степени окисления +2.
Амфотерными называются оксиды, которые взаимодействуют как с кислотами, так и с основаниями (щелочами, растворимыми в воде основаниями), образуя соли. Амфотерным оксидам отвечают гидроксиды проявляющие как свойства кислот, так и свойства оснований. Например:
Амфотерный ок- |
Основание |
Кислота |
|
сид |
|
Zn+2(OH)2 |
H2Zn+2O2 |
Zn+2O |
Al+3(OH)3 |
HAl+3O2 H2O |
|
Al 2+3 |
2O3 |
|
(H3Al+3O3) |
Кислотные оксиды – оксиды неметаллов (кроме несолеобразующих оксидов) в любой степени окисления и оксиды металлов в высоких степенях окисления (+5 и выше).
Кислотными называют оксиды, которые взаимодействуют со щелочами, образуя соли. Кислотным оксидам отвечают гидроксиды – кислоты. Например:
Кислотный оксид |
Кислота |
S+4O2 |
H2S+4O3 |
P 2+5 O5 |
HP+5O3, H3P+5O4, H4P 2+5 O7 |
Cr+6O3 |
H2Cr+6O4, H2Cr 2+6 O7 |
Если металл проявляет разные степени окисления и образует несколько оксидов, то чем выше степень окисления металла, тем более кислотный характер будет носить этот оксид. Так, Mn+2O – основный оксид, Mn+4O2 – ам-
фотерный, Mn +27 O7 – кислотный оксид.
Физические свойства оксидов: Основные оксиды – твердые тугоплав-
кие вещества. Химическая связь в таких оксидах близка к ионной – они образуют кристаллическую решетку ионного типа.
Кислотные оксиды могут быть при обычных условиях газообразными веществами (СО2, SO2), жидкостями (Cl2O7, Mn2O7) и твердыми веществами (N2O5, P2O5). Твердые кислотные оксиды являются относительно легкоплавкими и летучими веществами. Это связано с тем, что типичные кислотные оксиды в твердом состоянии имеют молекулярную структуру. Кислотные оксиды, имеющие атомную кристаллическую решетку (SiO2, B2O3), относительно тугоплавки и нелетучи.
Амфотерные оксиды – твердые тугоплавкие вещества. Как правило, в них сочетается ионная и ковалентная связь.
ХИМИЧЕСКИЕ СВОЙСТВА ОКИДОВ
1. Взаимодействие с водой.
Основные оксиды с водой образуют основания, но при обычных условиях с водой взаимодействуют лишь оксиды щелочных (Li2O, Na2O, K2O, Rb2O, Cs2O, Fr2O) и щелочноземельных металлов (CaO, SrO, BaO, RaO):
Na2O + H2O → 2NaOH
BaO + H2O → Ba(OH)2
Оксид магния реагирует с водой лишь при нагревании:
MgO + H2O t o →Mg(OH)2
Оксиды, которым соответствуют нерастворимые основания, с водой непосредственно не взаимодействуют.
Кислотные оксиды (агидриды) с водой образуют кислоты:
SO3 + H2O → H2SO4
Cl2O7 + H2O → 2HClO4
Большинство кислотных оксидов реагирует с водой; оксиды, которым соответствуют нерастворимые кислоты, например оксид кремния (IV), с водой непосредственно не взаимодействуют.
Существуют кислотные оксиды способные при взаимодействии с водой давать две кислоты, например NO2:
2NO2 + H2O → НNO3 + НNO2
2. Взаимодействие с кислотами.
Все основные оксиды и амфотерные реагируют с кислотами, образуя соль и воду
3Na2O + 2H3PO4 → Na3PO4 + 3H2O
ZnO + H2SO4 → ZnSO4 + H2O
3. Взаимодействие со щелочами.
Кислотные оксиды реагируют со щелочами, образуя соль и воду: SO2 + 2NaOH → Na3SO3 + H2O
Иногда такие реакции протекают при комнатной температуре очень медленно, например, в случае оксида кремния (IV). Медленно идут реакции кислотных оксидов с малорастворимыми основаниями
Cu(OH)2 + SO3 → CuSO4 + H2O
Реакции с амфотерными оксидами, как правило, осуществляют либо при сплавлении, либо в концентрированных растворах щелочей
Fe2O3 + 2NaOH t o → 2NaFeO2 + H2O ZnO + 2NaOH + H2O → Na2[Zn(OH)4]
4. Взаимодействие основныхи амфотерных оксидов с кислотными.
Основные оксиды взаимодействуют с кислотными оксидами, образуя
соли:
MgO + CO2 → MgCO3
Na2O + Cl2O7 → 2NaClO4 Al2O3+SiO2 t o → Al2(SiO3)3
5. Взаимодействие оксидов с восстановителями.
Оксиды некоторых элементов легко восстанавливаются при слабом нагревании различными восстановителями
CuO + H2 t o →Cu + H2O FeO + CO t o → Fe + CO2
SiO2 + Mg t o → Si + MgO
ПОЛУЧЕНИЕ ОКСИДОВ
1. Оксиды можно получать реакцией соединения простого вещества с кислородом, протекающей, как правило, при нагревании:
С + О2 → СО2 (кислотный оксид) 2Mg + О2 → 2MgO (основной оксид)
2. Многие оксиды можно получить термическим разложением соответствующих кислот, оснований, а также неустойчивых при нагревании солей, например:
t o |
|
t o |
Cu(OH)2 → CuO + H2O |
CaCO3 → CaO + CO2 |
|
t o |
+ H2O |
t o |
H2SiO3 → SiO2 |
2Pb(NO3)2 → 2PbO + 4NO2↑ + O2↑ |
|
3. В некоторых случаях оксиды образуются при окислении кислородом сложных веществ:
СН4 + 2O2 → CO2 + 2H2O 4FeS2 + 11O2 → 2Fe2O3 + 8SO2
ОСНОВАНИЯ
Основаниями называются соединения, состоящие из атомов металла, связанных с одной или несколькими гидроксогруппами – ОН, например
NaOH, Ba(OH)2, Fe(OH)3.
Особым является неорганическое соединение NH4OH или NH3 Н2О (более точно его состав передается формулой NH3 хН2О). В составе этого соединения группа атомов NH +4 (катион аммония) играет такую же роль, как однозарядный катион металла.
Название основания образуется из слова гидроксид и названия металла в родительном падеже, причем для металла с переменной степенью окисления указывается степень окисления. Например, NaOH – гидроксид натрия, но Fe+3(OH)3 – гидроксид железа (III).
Все основания делятся на две группы: хорошо растворимые в воде и мало растворимые в воде (их условно называют нерастворимыми). Растворимые в воде сильные основания называются щелочами. Это гидроксиды щелочных и щелочноземельных металлов.
КЛАССИФИКАЦИЯ ОСНОВАНИЙ
Основания делятся на: однокислотные (NaOH, CuOH), двухкислотные
(Ca(OH)2, Fe(OH)2) трехкислотные (Al(OH)3, Fe(OH)3)
Кислотность оснований определяют по числу гидроксогрупп, связанных с металлом.
Физические свойства оснований: При комнатной температуре все основания – твердые вещества. Исключение составляет только одно основание – гидроксид аммония NH4OH, который представляет собой водный раствор аммиака и в свободном виде не существует.
ХИМИЧЕСКИЕ СВОЙСТВА ОСНОВАНИЙ
1. Отношение к индикаторам.
Растворимые основания – щелочи – изменяют цвет индикаторов: лакмуса – в синий; фенолфталеина – в малиновый; метилоранжа – в желтый цвет.
2. Взаимодействие с кислотами.
Все основания взаимодействуют с кислотами, образуя соль и воду. Эта реакция является реакцией нейтрализации:
Cu(OH)2 + H2SO4 → CuSO4 + 2H2O
3. Взаимодействие с кислотными оксидами (ангидридами кислот).
Основания взаимодействуют с кислотными оксидами с образованием соли и воды:
2NaOH + SO2 → Na2SO3 + H2O
4. Взаимодействие с солями.
Растворимые основания реагируют с растворимыми солями, образуя новое основание и новую соль, при этом один из продуктов реакции обязательно должен выделяться в виде осадка:
2КОН + FeSO4 → Fe(OH)2↓ + K2SO4
Ba(OH)2 + Na2SO4 → 2NaOH + BaSO4↓
5. Разложение оснований при нагревании.
Большинство оснований при нагревании разлагаются на оксид (основный) и воду:
Cu(OH)2 t o → CuO + H2O
Щелочи, кроме LiOH, разлагаются лишь при очень высоких температу-
рах.
ПОЛУЧЕНИЕ ОСНОВАНИЙ
1. Взаимодействие наиболее активных (щелочных и щелочноземельных) металлов с водой с образованием щелочи и выделением водорода:
2Na + 2H2O → 2NaOH + H2↑
Ca + 2H2O → Ca(OH)2 + H2↑
2. Взаимодействие оксидов щелочных и щелочноземельных металлов с водой; в результате взаимодействия образуется щелочь:
Na2O + H2O → 2NaOH
CaO + H2O → Ca(OH)2
3. Взаимодействие гидридов активных металлов с водой с образованием щелочи и выделением водорода:
NaH + + H2O → 2NaOH + H2
CaH2 + 2H2O → Ca(OH)2 + 2H2
4. Электролиз водных растворов хлоридов щелочных металлов с образованием щелочи
2NaCl + 2H2O → 2NaOH + Сl2 + H2
5.Нерастворимые основания получают действием растворимого осно-
