Кривые кислотно-основного титрования
.doc
Титрование сильной кислоты
сильным основанием
HCl + NaOH = NaCl + H2O
До начала титрования: в растворе – сильная кислота
pH = –lg[H+] = –lgCo(HCl)
До т. э.: в растворе – недотитрованная сильная кислота (и ее соль, не влияющая на рН)
pH = –lg[H+]ост. = –lgCост(HCl)
В т. э.: в растворе – соль сильной кислоты и сильного основания
рН = 7
После т. э.: в растворе избыток титранта – сильного основания (и соль, не влияющая на рН)
pH = 14 + lg[ОH–]изб. = 14 + lgСизб(NaOH)
О
рН
Титрование сильного основания сильной кислотой NaOH + HCl = NaCl + H2O
До начала титрования: в растворе – сильное основание
pH = 14 + lg[OH–]исх = 14 + lgС0(NaOH)
До т. э.: в растворе – недотитрованное сильное основание (и соль, не влияющая на рН)
pH = 14 + lg[OH–]ост. = 14 + lgСост(NaOH)
В т. э.: в растворе – соль сильного основания и сильной кислоты , рН = 7
После т. э.: в растворе избыток титранта – сильной кислоты (и соль, не влияющая на рН)
pH = –lg[H+]изб. = –lgCизб(HCl)
Титрование слабой киcлоты сильным основанием
CH3COOH + NaOH = CH3COONa + H2O
До начала титрования (в исходной точке): в растворе – слабая кислота CH3COOH
![]()
До т. э.: в растворе смесь CH3COOH и CH3COONa (буферная)
![]()
В т. э.: в растворе соль CH3COONa
![]() ! pH
> 7
! pH
> 7
После т. э.: в растворе соль CH3COONa и избыток NaOH (который подавляет гидролиз соли и определяет значение рН):
pH = 14 + lg[ОH–]изб = 14 + lgСизб(NaOH)
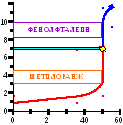
Прогнозирование возможности титрования
Условие наличия скачка на кривой титрования:
Кд > 10-7 – 10-8 (pK < 7-8)
Общий вид кривой титрования слабой кислоты сильным основанием
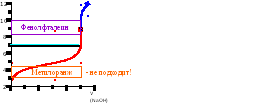
Титрование слабого основания сильной киcлотой
NH4OH + HCl = NH4Cl + H2O
До начала титрования: в растворе слабое основание NH4OH
![]()
До т. э.: в растворе смесь NH4OH и NH4Cl (буферная)
![]()
В т. э.: в растворе соль NH4Cl
![]() ! рН < 7
! рН < 7
После т. э.: в растворе соль NH4Cl и избыток HCl (который подавляет гидролиз соли и определяет значение рН):
pH = –lg[H+]изб = –lgCизб(HCl)
Общий вид кривой титрования слабого основания сильной кислотой

Титрование соли, образованной слабой кислотой и сильным основанием
KCN + HCl = HCN + KCl
из щелочной среды в кислую
До начала титрования: в растворе – соль слабой кислоты KCN
![]()
До т. э.: в растворе смесь KCN и HCN (буферная)
![]()
В т. э.: в растворе слабая кислота HCN
![]() ! рН < 7
! рН < 7
После т. э.: в растворе HCN и избыток HCl (подавляющий диссоциацию слабой кислоты и определяющий значение рН):
pH = –lg[H+]изб = –lgCизб(HCl)
Прогнозирование возможности титрования соли слабой кислоты:
(анион соли – основание, сопряженное слабой кислоте)
рКосн = 14 – рКк-ты
Косн > 10-7 – 10-8 (pKосн < 7-8)
Титрование многоосновных кислот
Варианты:
1. Кислота титруется ступенчато (H3PO4, H2SO3 и др.)
2. Кислота титруется сразу по всем ступеням (H2С2O4, H2SO4 и др.)
1) Условие наличия скачка на кривой титрования:
Кд > 10-7 – 10-8 (pK < 7-8)
Количество скачков:
-
Если К > 10-7 – 10-8 Þ скачок есть
-
Если К < 10-7 – 10-8 Þ скачка нет
2) Условие разделения скачков:
![]() ( DрК ³
4 )
( DрК ³
4 )
-
Если
 Þ I и
II т. э. располагаются
на кривой раздельно, кислота титруется
ступенчато
Þ I и
II т. э. располагаются
на кривой раздельно, кислота титруется
ступенчато
-
Если
 Þ кислота титруется
сразу по двум ступеням
Þ кислота титруется
сразу по двум ступеням
Например, H3РO4: К1 = 7,1·10-3 ; К2 = 6,2·10-8 ; К3 = 5,0·10-13