
Курило_ТОХ
.pdf1
ТЕОРЕТИЧЕСКИЕ ОСНОВЫ ХИМИИ
Курс лекций
Автор КУРИЛО ИРИНА ИОСИФОВНА
Кафедра общей и неорганической химии
1. ОСНОВНЫЕ ПОНЯТИЯ И ЗАКОНЫ ХИМИИ
Введение
Химия относится к числу естественных наук и изучает окружающий нас мир, многообразие его форм и происходящих в нем явлений.
Вся природа существует независимо от сознания человека. Все окружающее нас и существующее в природе представляет различные виды материи, которая находится в постоянном движении и развитии. Материя – философская категория для обозначения объективной реальности, существующей независимо от сознания человека и данной ему в ощущениях. Материя вечна во времени и постоянна в пространстве.
Известны две физические формы существования материи – вещество и поле. Вещество – материальное образование, состоящее из частиц, имеющих собственную массу (массу покоя), и обладающая при определенных условиях постоянными химическими и физическими свойствами, т.е. это материя на разных стадиях ее организации: элементарные частицы – ядра атомов – атомы – молекулы – атомные, ионные или молекулярные агрегации (твердые тела, жидкости, газы) и т.д.
Поле – материальная среда, посредством которой осуществляется взаимодействие между частицами вещества или отдельными телами. Материальные носители поля массы покоя не имеют. Основной характеристикой этой формы материи является энергия. Примеры различных видов полей: гравитационное, электромагнитное, поле ядерных сил и др.
Основным свойством и способом существования материи является движение. Формы движения материи очень разнообразны и взаимосвязаны друг с другом. Формы движения материи изучаются разными естественными науками: физикой, химией, биологией и др.
Количественной мерой движения материи служит энергия. Между массой и энергией существует взаимосвязь, количественно выражаемая уравнением Эйнштейна
(1905г.):
Е= mc2, |
(1) |
где Е – энергия; m – масса; с – |
скорость света в вакууме (3.108м/с). |
Уравнение (1) является количественной формой выражения фундаментального закона сохранения массы и энергии. Так как химические реакции сопровождаются энергетическими эффектами, то в результате их протекания происходит изменение массы. Однако, так как энергетические эффекты реакций находятся в пределах 10 - 1000 кДж на единицу количества вещества, то, согласно (1), изменение массы находится на уровне 10-8 – 10 -10 г. Такое небольшое изменение массы можно не учитывать.
2
Следует отметить, что уравнение Эйнштейна указывает на взаимосвязь, а не на эквивалентность массы и энергии и не на их превращения друг в друга.
Химия изучает химическую форму движения материи. Химия – наука о веществах и законах их превращений. Современная химия – это разветвленная система многих наук: общей, неорганической, органической, физической, аналитической химии, электрохимии, биохимии и т.д.
ОСНОВНЫЕ ПОНЯТИЯ ХИМИИ
Все наблюдаемые в природе явления делятся на физические и химические. Явления, сопровождаемые изменением агрегатного состояния и не приводящие
к превращению одних веществ в другие – физические (плавление льда, дробление мела). Явления, при которых из одних веществ образуются новые вещества – химические (химические реакции).
В настоящее время известно более 100 тыс. неорганических и более 4 млн. органических соединений. Свойства вещества делятся на физические и химические. Для установления свойств вещества необходимо иметь чистое вещество. Вещества в чистом виде не встречаются – смеси. Смеси отличаются от химического соединения тем, что их составные части сохраняют свои индивидуальные свойства и могут быть выделены физическими методами. В химических соединениях составные части не сохраняют своих свойств и не могут быть выделены. Вещества, выпускаемые химической промышленностью, препараты также содержат примеси. Поэтому для указания степени их чистоты существуют различные марки: ТЕХН. – технический, Ч – чистый, ЧДА
– чистый для анализа; ХЧ – химически чистый; ОЧ – особенно чистый, СЧ – спектрально чистый. Допустимое количество примесей регламентируется ГОСТом.
Атомно - молекулярное учение.
Объектом изучения в химии являются химические элементы и их соединения.
1.Все вещества состоят из молекул. Молекула - наименьшая частица индивидуального вещества, способная к самостоятельному существованию, обладающая его основными химическими свойствами.
2.Молекулы состоят из атомов. Атом - наименьшая частица химического элемента, сохраняющая все его химические свойства. Различным элементам соответствуют различные атомы.
3.Молекулы и атомы находятся в непрерывном движении; между ними существуют силы притяжения и отталкивания.
Химическим элементом называют вид атомов с одинаковым зарядом ядер и строением электронной оболочки. Каждому химическому элементу соответствует определенный вид атомов. В настоящее время известно 117 элементов, из которых 92 встречаются в природе, остальные получены искусственным путем.
Атомы существуют в свободном состоянии, в соединениях с атомами того же или других элементов, образуя молекулы. Способность атомов вступать во взаимодействие с другими атомами и образовывать химические соединения определяется его строением. Атомы состоят из положительно заряженного ядра и отрицательно заря-
3
женных электронов, движущихся вокруг него, образуя электронейтральную систему, которая подчиняется законам, характерным для микросистем.
Атомное ядро - центральная часть атома, состоящая из Z протонов и N нейтронов, в которой сосредоточена основная масса атомов.
Заряд ядра - положительный, по величине равен количеству протонов в ядре или электронов в нейтральном атоме и совпадает с порядковым номером элемента в периодической системе. Сумма протонов и нейтронов атомного ядра называется массовым числом: A = Z + N.
Изотопы - химические элементы с одинаковыми зарядами ядер, но различными
массовыми числами за счет разного числа нейтронов в ядре.
В зависимости от природы частиц, из которых построено вещество, различают вещества с молекулярной и немолекулярной структурой. Практически все органические вещества и около 5% неорганических соединений имеют молекулярное строение.
Если молекулы состоят из одинаковых атомов, то вещество называют простым или элементарным, например, О2 , S8, Ne. Простое вещество является формой существования химического элемента в свободном состоянии. Аллотропия - явление образования химическим элементом нескольких простых веществ, различающихся по строению и свойствам.
Если молекула состоит из разных атомов, то вещество называют сложным или химическим соединением, например, CO2, NH3.
Любое вещество характеризуется определенным качественным и количественным составом, который выражается формулой.
Химическая формула - это условная запись состава вещества с помощью химических знаков. Химическая формула показывает, атомы каких элементов, и в каком отношении соединены между собой в молекуле.
Массы атомов химических элементов чрезвычайно малы – от 1,674.10-27 до 4,27.10-25 кг. В химии пользуются не их абсолютными значениями (m0), а относительными: Аr, (relative – относительный).
Относительной атомной массой (Ar) химического элемента называется величина, равная отношению средней массы атомов данного элемента (с учетом процентного содержания его изотопов в природе) к 1/12 массы изотопа углерода -12 (12С).
1/12 массы атома изотопа 12С принята за атомную единицу массы (а.е.м.), международное обозначение – u.
1 а.е.м = 1/12 m (12C) = 1,66057 10-27 кг
Относительная атомная масса является величиной безразмерной.
В таблице Менделеева приведены относительные атомные массы элементов, которые представляют собой средние относительные атомные массы для природных смесей изотопов соответствующих химических элементов с учетом их распространенности в земной коре. Например, в природе встречаются два изотопа хлора: 35Cl – 75,5%, 37Cl – 24,5%, поэтому
Аr(Cl) = |
35 × 75,5 + 37 × 24,5 |
= 35,5 |
|
|
|||
100 |
|||
|
|
Очевидно, что относительная атомная масса элемента должна быть больше, чем у самого легкого и меньше, чем у самого тяжелого изотопа. Однако, вожможны исключения. Например, в природе имеются три изотопа кислорода 16О, 17О, 18О, но
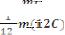
4
при этом относительная атомная масса кислорода, приведенная в таблице, 15,9994 < 16. Это объясняется тем, что при образовании ядра из нуклонов выделяется огромная энергия (термоядерный синтез!). Согласно соотношению Эйнштейна (Е = mc2), происходит уменьшение массы. В случае кислорода в расчете на 1 моль атомов кислорода должно было бы выделиться 12,3 × 109 кДж/моль, что соответсвует уменьшение массы
|
Е = mc2 |
m = |
Е |
m → ∆m |
||
|
|
|
||||
с2 |
||||||
|
|
|
|
|||
12,3 ×1012 Дж/моль |
= 1,37 × 10–4 |
кг/моль = 0,137 г/моль |
||||
∆m = |
|
|||||
(3 ×108 м / с) 2 |
||||||
|
|
|
|
|
||
И масса изотопа кислорода 16О равна не 16,128 (сумма масс протонов и нейтронов), а 16,128 – 0,137 = 15,991, т.е. меньше 16. Так что приведенная в периодической таблице атомная масса кислорода 15,9994 больше массы самого легкого изотопа, как и должно быть.
Средняя абсолютная масса атома (m) равна относительной атомной массе, умноженной на а.е.м.
Ar(Mg) = 24,312
m (Mg) = 24,312·1,66057 10-24 = 4,037 10-23 г.
Относительной молекулярной массой Мr вещества называется отношение массы его молекулы к 1/12 массы изотопа углерода -12 (12С).
Mr = 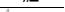 ,
,
где mr - масса молекулы данного вещества.
Относительная молекулярная масса вещества равна сумме относительных атомных масс всех элементов с учетом индексов.
ПРИМЕР 1.1
Найти Mг(B2O3) и Mг(KAl(SO4)2).
Решение. Mг(B2O3) = 2 Ar(B) + 3 Ar(O) = 2 11 + 3 16 = 70
Mг(KAl(SO4)2) = 1 Ar(K) + 1 Ar(Al) + 2 Ar(S) + 8 Ar(O) = 39 + 27 +64 + 8·16 =
258.
Абсолютная масса молекулы равна относительной молекулярной массе, умноженной на а.е.м.
Масса одной молекулы: m0 = Мr · а.е.м. = Мr × |
1 |
, (г) |
|
N |
|||
|
|
||
|
A |
|
Число атомов и молекул в обычных образцах веществ очень велико, поэтому при характеристике количества вещества используют специальную единицу измерения - моль. Количество вещества, моль, означает определенное число структурных элементов (молекул, атомов, ионов). Единицей измерения количества вещества в Международной системе единиц (СИ) является моль.
5
Моль – количество вещества, содержащее столько структурых элементарных единиц (атомов, молекул, ионов и т.д.), сколько содержится атомов в 0,012 кг изотопа углерода 12С.
Число атомов NА в 0,012 кг изотопа углерода 12С составляет 6,022.1023 моль-1 (постоянная Авогадро).
Масса 1 моль вещества называется молярной массой. Молярная масса вещества равна отношению массы вещества к соответствующему количеству вещества n:
М = m/n (г/моль).
Численное значение молярной массы совпадает с относительной молекулярной, атомной или формульной массой данного веществ,. однако первая величина имеет размерность г/моль, а остальные – безразмерные. Это означает, что если масса некоторой молекулы равна, например, 80 а.е.м. (SO3), то масса одного моля молекул равна 80 г. Постоянная Авогадро является коэффициентом пропорциональности, обеспечивающим переход от молекулярных соотношений к молярным. Все утверждения относительно молекул остаются справедливыми для молей (при замене, в случае необходимости, а.е.м. на г). Например, уравнение реакции: 2Na + Cl2 2NaCl, означает, что два атома натрия реагируют с одной молекулой хлора или, что одно и то же, два моль натрия реагируют с одним молем хлора.
2NaCl, означает, что два атома натрия реагируют с одной молекулой хлора или, что одно и то же, два моль натрия реагируют с одним молем хлора.
ПРИМЕР 1.2
Сколько молекул содержится в 6,4 г серы?
Решение. Молекулярная масса серы равна 32 г /моль. Определяем количество г/моль вещества в 6,4 г серы:
n(S) = m(S) / M(S) = 6,4г / 32 г/моль = 0,2 моль
Определим число структурных единиц (молекул), используя постоянную Авогадро NA:
N(S) = n(S) NA = 0,2 6,02·1023 = 1,2·1023
Валентность. Понятие сложное, существуют несколько определений валентности, отражающие различные стороны этого понятия. Наиболее общее: Валентность – число химических связей, образованных атомами данного элемента или числом атомов непосредственно окружающих данный атом (координационное число).
Степень окисления – формальный заряд, рассчитанный из предположения, что связи носят ионный характер.
ОСНОВНЫЕ СТЕХИОМЕТРИЧЕСКИЕ ЗАКОНЫ
Стехиометрия – раздел химии, рассматривающий количественные (массовые, объемные) соотношения между реагирующими веществами. Расчеты таких количественных соотношений между элементами в соединении или между веществами в уравнениях химических реакций называют стехиометрическими расчетами. Их теоретической основой являются фундаментальные законы химии, часто называемые стехиометрическими законами.
Закон сохранения массы (Ломоносов 1748г., А.Лавуазье, 1789 г).
6
· Масса веществ, вступивших в химическую реакцию, равна массе ве-
ществ, образующихся в результате реакции.
Сточки зрения атомно-молекулярного учения закон сохранения массы объясняется так: в результате химических реакций атомы не исчезают и не возникают, а происходит их перегруппировка. Так как число атомов до реакции и после остается неизменным, но их общая масса также не изменяется.
Как уже говорили, закон верен лишь в практическом смысле, так как химическое взаимодействие сопровождается изменением энергии системы, а масса и энергия эквивалентны, то изменяется и масса системы. Например, при протекании реакции
С+ О2 = СО2; ∆Н0298 = –393,5 кДж
изменение массы составляет ∆m = 4,4 10–12 кг = 4,4 × 10–9 г. Такое изменение массы находится вне пределов современных методов её определения.
Закон сохранения массы выполняется строго, если не дать возможности выделяющейся энергии рассеиваться в окружающем пространстве или поступить из неё.
Значение закона сохранения массы для химии лишь историческое. Он утверждает материальность химических элементов и веществ. Широко используется в технологических расчетах при составлении баланса масс реагентов и продуктов промышленных производств.
Составление химических уравнений Включает три этапа:
1. Запись формул веществ, вступивших в реакцию (слева) и продуктов реакции (справа), соединив их по смыслу знаками "+" и "=" :
HgO = Hg + O2
2. Подбор коэффициентов для каждого вещества так, чтобы количество атомов каждого элемента в левой и правой части уравнения было одинаково:
2HgO = 2Hg + O2
3. Проверка числа атомов каждого элемента в левой и правой частях уравне-
ния.
Расчеты по химическим уравнениям
Расчеты по химическим уравнениям (стехиометрические расчеты) основаны на законе сохранения массы веществ. В реальных химических процессах из-за неполного протекания реакций и потерь масса продуктов обычно меньше теоретически рассчитаной. Выходом реакции (ŋ) называют отношение реальной массы продукта
(mпрактическая) к теоретически возможной (mтеоретическая), выраженное в долях единицы или в процентах:
ŋ= (mпрактическая / mтеоретическая) • 100%.
Если в условиях задач выход продуктов реакции не указан, его в расчетах принимают за 100% (количественный выход).
ПРИМЕР 1.3
Сколько г меди образуется при восстановлении 8 г оксида меди водородом, если выход реакции составил 82% от теоретического?
Решение. 1. Рассчитаем теоретический выход меди по уравнению реакции: CuO + H2 = Cu + H2O
7
80 г (1 моль) CuO при восстановлении может образовать 64 г (1 моль) Cu; 8 г CuO при восстановлении может образовать Х г Cu
2. Определим, сколько граммов меди образуется при 82% выходе продук-
та:
6,4 г –– 100% выход (теоретический)
Х г –– 82%
X = (8 • 82) / 100 = 5,25 г
ПРИМЕР 1.4
Определите выход реакции получения вольфрама методом алюминотермии, если из 33,14 г концентрата руды, содержащей WO3 и невосстанавливающиеся примеси (массовая доля примесей 0,3) было получено 12,72 г металла.
Решение. 1) Определим массу (г) WO3 в 33,14 г концентрата руды:
ω(WO3)= 1,0 - 0,3 = 0,7
m(WO3) = ω(WO3) • mруды = 0,7 • 33,14 = 23,2 г
2) Определим теоретический выход вольфрама в результате восстановления 23,2 г WO3 порошком алюминия:
WO3 + 2Al = Al2O3 + W.
При восстановлении 232 г (1 г-моль) WO3 образуется 187 г (1 г-моль) W, а
из 23,2 г WO3 –– Х г W
X = (23,2 • 187) / 232 = 18,7 г W
3)Рассчитаем практический выход вольфрама: 18,7 г W –– 100%
12,72 г W –– Y%
Y = (12,72 • 100) / 18,7 = 68%.
ПРИМЕР 1.5
Сколько граммов осадка сульфата бария образуется при сливании растворов, содержащих 20,8 г хлорида бария и 8,0 г сульфата натрия?
Решение. Уравнение реакции:
BaCl2 + Na2SO4 = BaSO4 + 2NaCl.
Расчет количества продукта реакции ведут по исходному веществу, взятому в недостатке.
1). Предварительно определяют, какое из двух исходных веществ находится в недостатке.
Обозначим количество г Na2SO4 –– X.
208 г (1моль) BaCl2 реагирует с 132 г (1 моль) Na2SO4; 20,8 г –– с Х г
X = (20,8 • 132) / 208 = 13,2 г Na2SO4.
Мы установили, что на реакцию с 20,8 г BaCl2 затратится 13,2 г Na2SO4, а дано 18,0 г Таким образом, сульфат натрия взят в реакцию в избытке, и дальнейшие вычисления следует вести по BaCl2, взятому в недостатке.
2). Определяем количество граммов выпавшего осадка BaSO4. 208 г (1 моль) BaCl2 образует 233 г (1 моль) BaSO4; 20,8 г –– Y г
Y = (233 • 20,8) / 208 = 23,3 г.
Закон постоянства состава (Ж.Пруст 1808 г.)
8
·Всякое химически чистое вещество, независимо от места нахождения
испособа его получения, имеет постоянный качественный и количественный состав.
Под химически чистым веществом подразумевается вещество, в котором химическим путем нельзя обнаружить примеси. Но веществ вообще без примесей не бывает. В зависимости от необходимости и имеющихся возможностей вещества очищают до разной степени чистоты.
Закон постоянства состава можно сформулировать иначе.
Химические элементы соединяются в определенных количественных соотношениях.
Количественные соотношения элементов в соединении и есть его химический состав, который, таким образом, оказывается определенным.
Например, углерод с кислородом образует соединения с различным массовым соотношением элементов углерода и кислорода.
СО |
С : О = 3 : 4 |
СО2 |
С : О = 3 : 8 |
Ни в каких других отношениях углерод с кислородом не соединяются. Это значит, что соединения СО и СО2 имеют постоянный состав, который определяется степенями окисления валентности углерода в соединениях. Валентность каждого элемента имеет определенные значения (их может быть несколько, переменная валентность), поэтому и состав соединений является определенным.
Закон применим только к соединениям с молекулярной структурой. Так как молекулы имеют определенную химическую формулу (состав), то образуемое ими вещество имеет постоянный состав, совпадающий, с составом каждой молекулы. Исключением являются полимеры, состоящие из молекул разной длины.
Соединения с немолекулярной структурой часто имеют переменный состав, не отвечающий целочисленным стехиометрическим соотношениям, что во многом объясняется условиями получения таких веществ (TiO0,6, TiO1,33). Речь идет о веществах в конденсированном (твердом и жидком состояниях). Т.к. NaCl – ионное соединение в твердом состоянии (чередование Na+ и Cl– ) в газообразном – представляет собой отдельные молекулы NaCl. В капле жидкости или в кристаллике нельзя выделить отдельные молекулы.
Например FeO
Fe2+ O2– Fe2+ O2– и т.д. идеальный кристалл
Закон постоянства состава требует, чтобы число ионов Fe2+ точно равнялось числу ионов O2– . А эти числа даже для очень маленьких кристалликов огромны (кубик, ребро 0,001 мм это – 5 × 1011). Для реального кристалла это невозможно. В реальном кристалле неизбежны нарушения регулярности. Оксид железа (II) может содержать измененное количество кислорода в зависимости от условий получения. Реальный состав оксида выражается формулой Fe1 – хO, где 0,16 ³ х ³ 0,04. Соединения переменного состава (Курнаков 1912-1913гг.) предложено называть бертоллидами. Соединения постоянного состава называют дальтонидами. Дальтониды отличаются от бертоллидов тем, что их состав лежит внутри области составов существования соединения, а бертоллиды имеют состав, лежащий вне области составов существования соединения.
9
В атомном (не ионном) веществе, некоторые атомы могут отсутствовать, а некоторые замещать друг друга. Формула интерметаллического соединения меди с цинком, которое является составной частью латуни, существующего в интервале составов
40 – 55 ат % Zn можно записать так: (Cu0,.9 – 1,0 Zn0,1 – 0 )(Cu0 –,0,2 Zn0 – 0,8 ) атомы меди могут замещаться атомами цинка и наоборот. Стехиометрический состав этого соедине-
ния (в отличие от FeО) CuZn лежит внутри его области существования (дальтониды). При нестехиометрическом составе ионного соединения обеспечивается электро-
нейтральность.
Закон постоянства состава, таким образом, строго выполняется для веществ молекулярного строения (исключения – высокомолекулярные) и имеет ограниченное применение для немолекулярных веществ.
Зная количественный элементный состав соединения, можно установить его простейшую молекулярную формулу. Для установления простейшей молекулярной формулы:
1)Обозначают формулу соединения Ax By Cz
2)Рассчитывают отношение X : Y : Z через массовые доли элементов.
Массовая доля элемента ω(Э)– это доля одного элемента в общей массе вещества. Вычисляется в процентах или в долях. Обозначают греческой буквой ω (омега). ω показывает, какую часть составляет масса данного элемента от всей массы вещества:
ω(Э) = (n • Ar( Э)) / Mr
где n - число атомов; Ar(Э) - относительная атомная масса элемента; Mr - относительная молекулярная масса вещества.
ω(A) = (х • Ar( А)) / Mr(AxByCz)
ω(B) = (y • Ar(B)) / Mr(A xByCz)
ω(C) = (z • Ar(C)) / Mr(A xByCz) X = (ω (A) • Mr) / Ar( А)
Y = (ω (B) • Mr) / Ar(B) Z = (ω (C) • Mr) / Ar(C)
x : y : z = (ω (A) / Ar(А)) : (ω (B) / Ar(B)) : (ω (C) / Ar(C))
3)Полученные цифры делят на наименьшее для получения целых чисел X, Y, Z.
4)Записывают формулу соединения.
Закон кратных отношений (Дальтон 1803 г.)
∙ Если два элемента образуют между собой несколько различных соеди-
нений, то на одну и ту же массу одного из них приходятся такие массы другого, которые относятся между собой как простые целые числа.
Например, массовые отношения С:О в оксидах СО2 и СО равны 12:32 и 12:16. Следовательно, массовое отношение углерода, связанное с одной и той же массой кислорода равно 2:1.
Закон эквивалентов (Рихтер 1800г.).
∙ все вещества реагируют в эквивалентных соотношениях
или

10
∙ массы реагирующих друг с другом веществ, а также массы продуктов
этой реакции пропорциональны молярным массам эквивалентов этих веществ.
m(A)/m(B) = М[ 1 (A)] / М[ 1 (B)] z z
Эквивалент - реальная или условная частица, которая в данной кислотноосновной реакции, в реакции ионного обмена равноценна одному атому (одному иону) водорода или в окислительно-восстановительной реакции – одному электрону.
Фактор эквивалентности fэкв(Х) – число, обозначающее длю реальной частицы, которая в реакции ионного обмена равноценна одному атому (одному иону) водорода или в окислительно-восстановительной реакции – одному электрону. Фактор эк-
вивалентности (fэкв = 1 ) может равняться единице или быть меньше ее. z
Фактор эквивалентности fэкв.(х) удобнее обозначать 1/z, где z (число квивалентности) – сумма зарядов функциональных групп (частиц), замещенных в данном соединении в реакции без изменения степени окисления, или z – число электронов, отданных восстановителем или присоединенных окислителем в окислительновосстановительной реакции.
Эквивалент соединения и фактор эквивалентности зависят от реакции, в которой участвует соединение.
Фактор эквивалентности и эквивалент в реакциях.
Реакция |
|
|
fэкв = |
1 |
|
Эквивалент |
|
z |
|
|
|||
|
|
|
|
|
|
|
Н3РО4 + 2NaOH = Na2HPO4 + 2H2O |
|
|
1/2 |
|
|
1/2Н3РО4 |
Al(OH)3 + HCl = Al(OH)2Cl + H2O |
|
|
1 |
|
|
Al(OH)3 |
Al(OH)3 + 2HCl = AlOHCl2 + 2H2O |
|
|
1/2 |
|
|
1/2Al(OH)3 |
Н3РО4 + NaOH = NaH2PO4 + H2O |
|
|
1 |
|
|
Н3РО4 |
Ca(OH)2 + 2HNO3 = Ca(NO3)2 + 2H2O |
|
|
1/2 |
|
|
1/2Ca(OH)2 |
Ba(H2PO4)2 + 2Ba(OH)2 = Ba3(PO4)2 + 2H2O |
|
|
1/4 |
|
|
1/4 Ba(H2PO4)2 |
Zn + 2HCl = ZnCl2 + H2 |
|
|
1/2 |
|
|
1/2Zn |
S + O2 = SO2 |
|
|
1/4 |
|
|
1/4S |
S0 - 4e = S +4 |
|
|
1/4 |
|
|
1/4S |
O20 + 4e = 2О-2 |
|
|
|
|
|
1/4O2 |
KMnO4 + 8HCl = MnCl2 + KCl + 5/2Cl2 + +4 H2O |
|
|
1/5 |
|
|
1/5 KMnO4 |
Mn+7 + 5e = Mn+2 |
|
|
1 |
|
|
1НС1 |
2Cl- - 2e = Cl2 |
|
|
|
|
|
|
Молярная масса эквивалента вещества М[ |
1 |
(Х)] равна произведению фактора |
||||
|
||||||
|
z |
|
|
|||
эквивалентности fэкв(Х) на молярную массу вещества Х. Молярную массу эквивалента различных веществ можно рассчитать по формулам:
1 |
оксида) = |
М (ооксида |
; |
|
М( |
|
|
||
z |
степень оисления элемента × число его атомов |
|||
