
Курило_ТОХ
.pdf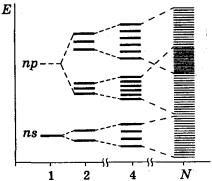
171
Вещества с ионной кристаллической решеткой при обычных условиях находятся в твердом состоянии, они имеют высокие температуры плавления и кипения.
Металлическая связь
Металлы и их сплавы кристаллизуются в форме металлических решеток. Узлы в металлической решетке заняты положительными ионами металлов. Валентные электроны, отделившиеся от атомов металлов, более или менее свободно перемещаются в пространстве между катионами и обусловливают электрическую проводимость металлов.
Между катионами и свободными электронами существуют электростатические взаимодействия, которые и являются причиной возникновения металлической связи.
Металлическая связь имеет сходство как с ионной, так и с ковалентной. Сходство с ионной связью в том, что обе они образуются за счет взаимодействия между заряженными частицами: электронами и ионами. Сходство с ковалентной в том, что происходит обобществление электронов. Однако, в отличие от ковалентной связи, где электроны локализованы около определенных атомов, электроны в металлах обобществляются всем кристаллом. Совокупность электронов иногда называют электронным газом. Катионы в металлических решетках совершают колебания вокруг узлов решетки. Амплитуда этих колебаний возрастает при повышении температуры, а при достижении температуры плавления металла решетка разрушается. Температура плавления металлов, как правило, возрастает с увеличением числа валентных электронов в их атомах. Наибольшую температуру плавления из металлов имеют d-элементы, что объясняется наличием в кристаллах этих элементов ковалентной связи, образованной неспаренными d-электронами, помимо металлической, образованнной s-электронами.
При повышении температуры происходит падение электропроводности металлов. Для объяснения существования проводников, полупроводников и изоляторов раз-
работана «зонная теория» – теория молекулярных орбиталей для системы с очень большим числом частиц (N ≈ 1023). При одновременном взаимодействии N атомов в кристалле число возникающих молекулярных орбиталей равно сумме орбиталей отдельных атомов. Даже если учитывать только внешние s- и р-орбитали, то при содержании в кристалле N атомов образуется 4N молекулярных орбиталей (рис. 31.1). Как видно из рисунка, взаимодействие в кристалле большого числа атомов приводит к появлению практически сплошного спектра энергий молекулярных орбиталей, т. е. к образованию энергетической зоны.
Рис. 1. Расщепление энергетических уровней электронов при последовательном присоединении атомов
172
Подобно тому как в изолированном атоме электроны могут находиться только на строго определенных энергетических уровнях, в кристалле существуют зоны разрешенных и запрещенных энергий. Энергетические уровни, на которых находятся валентные электроны, образуют валентную зону. Совокупность свободных, не занятых электронами уровней, расположенных энергетически выше валентной зоны, в некоторых случаях
впределах ее, называется зоной проводимости.
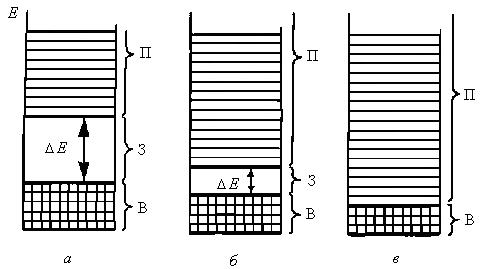
Взависимости от природы взаимодействующих атомов и типа кристаллической решетки валентная зона и зона проводимости могут перекрываться и не перекрываться друг с другом. В последнем случае между валентной зоной и зоной проводимости возникает энергетический разрыв, называемый запрещенной зоной. В зависимости от ширины запрещенной зоны Е все кристаллические вещества подразделяют на проводники (металлы), полупроводники и диэлектрики (изоляторы) (рис. 31.2).
Рис. 2. Возникновение энергетических зон (В – валентной, З – запрещенной, П – проводимости) для кристаллов:
а– диэлектриков, б – полупроводников, в – металлов
Вметалаллах валентная зона и зона проводимости перекрываются между собой, т. е.
Е= 0. Это обусловливает способность валентных электронов в металле свободно перемещаться по всему объему кристалла или двигаться направленно под влиянием внешнего электрического поля. Отсутствие запрещенной зоны у металлов объясняется тем, что
вих кристаллах s- и p-зоны перекрываются, а число валентных электронов мало по сравнению с числом вакантных орбиталей в валентной зоне. Например, в кристалле натрия 3s-зона занята лишь наполовину и полностью свободна перекрывающаяся с ней 3p- зона. В кристалле магния 3s-зона занята полностью, но с ней перекрывается свободная 3p-зона. У алюминия 3s-зона занята полностью, а 3p-зона – только на 1/6.
Благодаря наличию вакантных орбиталей в валентной зоне, а также перекрыванию s- и p-зон электроны в кристаллической решетке беспрепятственно переходят из валентной зоны в зону проводимости. При повышении температуры все большее число электронов переходит на вакантные молекулярные орбитали в зоне проводимости, что приводит к уменьшению числа вакантных МО и, соответственно, снижению электрической проводимости. У d-элементов происходит перекрывание ns-, np- и (n – 1) d-зон. Однако d-зона относительно неширокая, поэтому часть d-электронов в металлах локализованы, т. е. образуются ковалентные связи между соседними атомами, что обусловливает по-
173
вышение температуры плавления и механической прочности кристаллических решеток d-элементов.
В отличие от металлов кремний образует ковалентный кристалл, в котором связи образованы четырьмя эквивалентными sp3-гибридными орбиталями третьего электронного слоя, образующими единую sp3-гибридную валентную зону. Все связывающие орбитали в кристалле кремния заселены электронными парами, т. е. валентная зона полностью занята. Если валентная зона полностью занята электронами, вещества не обладают металлической проводимостью. Электроны этой зоны локализованы на своих энергетических уровнях и перемещаются внутри нее, участвовать в электрической проводимости не могут. Ближайшей по энергии зоной проводимости к sp3-гибридной валентной зоне в кристалле кремния является зона, образованная перекрыванием вакантных 3d- орбиталей того же слоя и близких к нему по энергии 4s-орбиталей. Эта зона не перекрывается с валентной, т. е. разделена запрещенной зоной. Электрофизические свойства кристаллов зависят от ширины запрещенной зоны. Для перехода электронов в зону проводимости необходимо их возбуждение. Так как атомы Si обладают свободными 3d- орбиталями, близкими по энергии к 3р-орбиталям, зона проводимости, образуемая 3d- АО, располагается близко к валентной зоне, в результате кристалл кремния при сообщении ему небольшой энергии (нагревание, облучение и др.) способен проводить электрический ток. Подобные материалы, которые в нормальном состоянии являются диэлектриками, а в возбужденном – проводниками электричества, называют полупроводниками.
Если ширина запрещенной зоны существенна (рис. 31.2, а), то возбудить электрическую проводимость в веществе путем нагревания невозможно, поскольку кристалл расплавится раньше, чем возникнет проводимость. К диэлектрикам относятся, например, алмаз, кварц.
Следует отметить, что при некоторых внешних условиях, например при сверхвысоком давлении, атомы кристаллов настолько сближаются друг с другом, что валентная зона и зона проводимости перекрываются, и полупроводники и даже диэлектрики могут превращаться в металлы.
Водородная связь
Атомы азота, кислорода и фтора являются самыми электроотрицательными. Они сильно смещают на себя электронную плотность в молекулах водородных соединений. Связи в HF, H2O и NH3 сильно полярны. Вследствие кулоновского взаимодействия происходит притяжение противоположно заряженных концов разных молекул и возникает
межмолекулярная водородная связь (рис. 31.3).
- O - |
- |
|
- |
Как видно из представ- |
|||
O |
ленных данных (рис. 31.4 и |
||||||
H |
H |
H |
|
H |
|||
|
|
табл. 31.1), температуры ки- |
|||||
+ |
+ |
+ |
|
|
+ |
||
|
|
-O- |
|
|
|
пения H2O и HF выпадают из |
|
|
H |
H |
|
|
|
общей закономерности в при- |
|
|
+ |
+ |
|
|
|
веденных рядах соединений, |
|
- |
- |
-O- |
|
что свидетельствуют о нали- |
|||
|
O |
H |
|
|
H |
чии специфического взаимо- |
|
H |
H |
|
|
||||
+ |
|
|
+ |
действия между молекулами |
|||
+ |
+ |
|
|
|
|
||
– водородных связей.

Рис. 3. Образование водородных связей |
|||
между молекулами воды |
|
||
t, oC |
|
|
|
20 |
|
|
|
-20 |
2 |
|
|
|
|
|
|
-60 |
|
|
|
-100 |
1 |
|
|
|
|
|
|
-140 |
|
|
|
HF |
HCl |
HBr |
HI |
|
Рис. 4. Температуры |
|
|
плавления (1) и кипения (2) НГ |
|||
H2F2).
|
|
174 |
|
|
Таблица 1 |
Энергия |
|
Температуры кипения |
водородной |
||
некоторых соединений |
связи значи- |
||
|
|
тельно меньше |
|
Соединение |
tкип, оС |
||
энергии кова- |
|||
H2O |
+100 |
||
лентной связи. |
|||
H2S |
–60 |
||
Тем не менее, |
|||
H2Se |
–41 |
||
водородная |
|||
H2Te |
–2 |
||
HF |
+19 |
связь обуслов- |
|
HCl |
–84 |
ливает суще- |
|
HBr |
–67 |
ствование в |
|
HI |
–35 |
||
газовой фазе |
|||
|
|
||
|
|
димерных мо- |
|
|
|
лекул воды и |
|
|
|
фтороводоро- |
|
|
|
да (например, |
|
Типы кристаллических решеток
Вещества могут существовать в трех агрегатных состояниях: твердом, жидком, газообразном. В твердом состоянии вещества образуют кристаллические решетки.
Кристаллические решетки веществ – это упорядоченное расположение частиц (атомов, молекул, ионов) в определенных точках пространства. Кристаллическое состояние характеризуется дальним порядком, т. е. трехмерной периодичностью структуры по всему объему твердого тела.
Точки размещения частиц называют узлами кристаллической решетки.
В зависимости от вида частиц, расположенных в узлах кристаллической решетки, и характера связи между ними различают 4 типа кристаллических решеток: атомные, молекулярные, ионные, металлические.
Вещества, молекулы которых характеризуются ковалентной неполярной связью, могут в твердом состоянии образовывать молекулярные и атомные кристаллические решетки.
Атомными называют кристаллические решетки, в узлах которых находятся отдельные атомы, соединенные очень прочными ковалентными связями.
Примерами веществ с атомной кристаллической решеткой могут служить алмаз, SiO2.
Вещества с молекулярной кристаллической решеткой имеют малую твердость, пла-
вятся при низкой температуре, летучие, при обычных условиях
находятся в газообразном или жидком состоянии. В узлах кри-
сталлической решетки молекулы удерживаются за счет слабого
межмолекулярного взаимодействия. Силы, связывающие молеку-
лы, называют ван-дер-ваальсовыми. Среди межмолекулярных
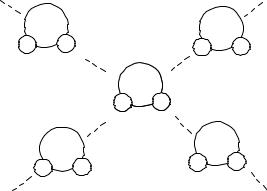
взаимодействий можно выделить диполь-дипольное. Очевидно, что два диполя будут стремиться ориентироваться относительно друг друга противоположными полюсами (рис. 31.5).
175
Рис. 5. Схема диполь-дипольного взаимодействия
Другой тип межмолекулярного взаимодействия – индукционное. Любой диполь, безусловно, оказывает электростатическое воздействие на рядом находящиеся неполярные молекулы, вызывая их поляризацию (рис. 31.6).
Рис. 6. Схема индукционного взаимодействия
Например, неполярная молекула брома, подходя к π-облаку молекулы этилена, поляризуется так, что атакующим центром оказывается атом брома с частично положительным зарядом на нем. Об этом свидетельствует образование промежуточного бромониевого катиона. Индукционный эффект возрастает с увеличением поляризуемости молекулы.
Возможно межмолекулярное взаимодействие и между совершенно неполярными молекулами. Электронная плотность подвержена колебаниям (флуктуациям). Смещение электронной плотности у одного атома (образование мгновенного диполя) вызовет соответствующее смещение и у другого (рис. 31.7).
Рис. 7. Схема дисперсионного взаимодействия
Следствием подобных сдвигов электронной плотности является взаимное притяжение атомов. Данное взаимодействие называется дисперсионным и позволяет объяснить возможность существования конденсированных фаз (жидкой и твердой) для совершенно неполярных атомов и молекул, например для гелия, иода.
Силы межмолекулярного взаимодействия по сравнению с обычными валентными силами ненасыщаемы, имеют низкую энергию, действуют на небольших расстояниях. Например, энергия связи Cl–Cl составляет 245 кДж/моль, а энергия
связи между молекулами Cl2 в кристалле хлора на порядок ниже и составляет 25 кДж/моль. Сила межмолекулярного взаимодействия возрастает с увеличением размеров молекул.
Ионными называют кристаллические решетки, в узлах которых находятся ионы. Их образуют вещества с ионной связью (соли, ок-
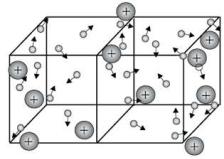
176
сиды и гидроксиды металлов). Ионные кристаллические решетки имеют соли, некоторые оксиды и гидроксиды металлов.
Вещества с ионной кристаллической решеткой обладают высокими температурами плавления и кипения (табл. 2).
Таблица 2
Температура плавления и кипения веществ с ионной кристаллической решеткой
Свойства |
|
|
Вещества |
|
|
|
NaCl |
NaOH |
KBr |
BaF2 |
BaCl2 |
||
|
||||||
t пл оС |
801 |
321 |
734 |
1368 |
961 |
|
t кип оС |
1465 |
1390 |
1380 |
2260 |
2050 |
Это объясняется сильным электростатическим взаимодействием положительных и отрицательных ионов. Силы же отталкивания одноименных ионов значительно меньше, так как одноименные ионы расположены на больших расстояниях друг от друга.
Для разрушения ионных кристаллов требуется значительная тепловая энергия, что и определяет высокие температуры плавления и кипения. Другим свойством ионных веществ является способность образовывать расплавы, хорошо проводящие электрический ток.
В узлах металлических кристаллических решеток находятся катионы металла. Для металлов характерны такие физические свойства, как пластичность, ковкость, металлический блеск, высокая электро- и теплопроводность. Указанные свойства обусловлены обобществленными электронами, которые свободно перемещаются в пространстве между узлами кристаллической решетки.
177
24. ТЕОРИЯ КРИСТАЛЛИЧЕСКОГО ПОЛЯ
Для объяснения строения комплексных соединений d-элементов, у которых имеется незавершенный (n – 1) d-подуровень, используют метод ВС, дополненный теорией кристаллического поля. Теория кристаллического поля рассматривает взаимодействие комплексообразователя и лигандов как электростатическое. При этом учитывается влияние лигандов на энергетическое состояние электронов d-подуровня комплексообразователя.
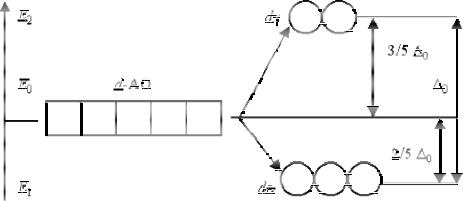
В свободном атоме или ионе энергия всех пяти d-орбиталей одинакова, т. е. d- подуровень пятикратно вырожден. Лиганды как точечные отрицательные заряды взаимодействуют с центральным ионом, притягиваясь к его ядру и отталкиваясь от его электронных орбиталей. Такой эффект отталкивания возбуждающе действует на d-ор- битали комплексообразователя, изменяя их энергию. Ближайшие к лигандам орбитали испытывают большее отталкивание и, соответственно, более сильное возбуждение, их энергия повышается. Удаленные орбитали испытывают меньшее отталкивание и поэтому им соответствует меньшее значение энергии. Таким образом, под действием электростатического или кристаллического поля лигандов ранее единый, пятикратно вырожденный энергетический уровень d-орбиталей расщепляется на два различных энергетических уровня.
Рассмотрим расщепление d-подуровня комплексообразователя в октаэдрическом и тетраэдрическом расположении (поле) лигандов.
В октаэдрических комплексах (КЧ = 6) большее отталкивающее действие со стороны лигандов испытывают d х2 − y2 - и d 2z -орбитали, расположенные по осям координат и не-
посредственно направленные на лиганды в углах октаэдра (рис. 27.1).
Электроны, занимающие эти орбитали (их обозначают dγ), имеют большую энергию. Орбитали dxy, dxz, dyz, наоборот, направлены в пространстве между лигандами, что снижает отталкивающее воздействие лигандов. Электроны, находящиеся на этих орбиталях (их обозначают dε), обладают меньшей энергией. В результате расщепления энергия d х2 − y2 - и d 2z -орбиталей становится выше, а dxy-, dxz-, dyz-орбиталей – ниже по
сравнению с тем вырожденным состоянием, которое они имели бы в сферическом поле лигандов.
Расщепление d-подуровня в октаэдрическом поле лигандов отражено на следующем рисунке:
Расщепление d-подуровня в октаэдрическом поле лигандов
178
Энергетическая разность dγ- и dε-уровней называется энергией расщепления и
обозначается |
0 (или окт – указывает на характер поля лигандов). |
Значение |
0 тем больше, чем сильнее поле, создаваемое лигандами. Лиганды по |
силе создаваемого ими поля располагаются в так называемый спектрохимический ряд лигандов:
CO>CN− >NH2CH2CH2NH2>NH3>H2O>C2O 24− >OH− >F− >SCN− >Cl>Br− >I−
сильное поле слабое поле
Как известно, электроны располагаются на орбиталях в соответствии с правилом Хунда. При распределении электронов по d-орби-талям комплексообразователя в соответствующем поле лигандов необходимо учитывать соотношение величин энергии расщепления ( 0) и энергии расталкивания электронов, находящихся на одной орбитали.
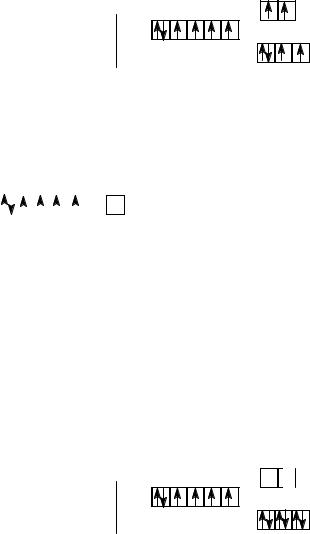
В комплексе [CoF6]3− (F− – лиганд слабого поля) энергия межэлектронного отталкивания оказывается больше, чем энергия расщепления d-орбиталей Co3+
(…3 d64s04p0), поэтому d-электроны располагаются на пяти d-орбиталях (на одной – пара электронов, на остальных – по одному).
Е
В комплексе [CoF6]3− лиганды F− будут образовывать шесть σ-связей с вакантными орбиталями иона Co3+. Связи с неподеленными парами ионов F− будут образовывать одну 4s-, три 4p- и две 4d-орбитали (внешнего слоя):
Co3+… |
|
|
3 d 6 |
4s 4p |
|
|
4d |
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Тип гибридизации – sp3d 2. Комплекс [CoF6]3− будет высокоспиновым и внешне-
орбитальным, что определяется наличием четырех неспаренных электронов на d- орбиталях и размещением лигандов на внешней 4d-орбитали.
При больших значениях окт (лиганды сильного поля) энергия расщепления превышает энергию межэлектронного расталкивания, поэтому сначала полностью заполняются более низкие по энергии
dε-орбитали, образуя низкоспиновые комплексы. В комплексе [Co(NH3)6]3+ для иона Co3+ (…3 d 6 4s0 4p0) энергия расщепления в октаэдрическом поле молекул NH3 (лиганд сильного поля) больше энергии расталкивания электронов. Поэтому d-электроны иона Co3+ располагаются на трех более низких по энергии dε-орбиталях.
Е
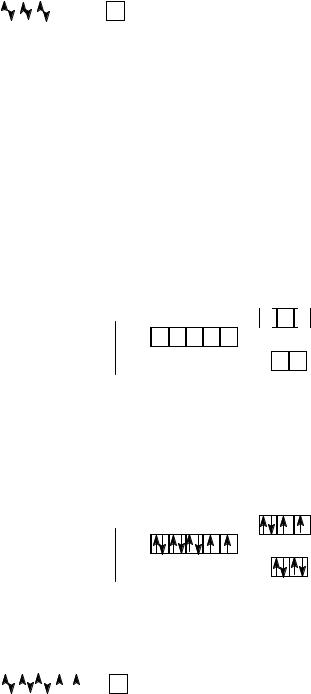
179
В комплексе [Co(NH3)6]3+ лиганды молекулы NH3 образуют шесть σ-связей с ионом Co3+. Связи с неподеленными парами молекул NH3 будут образовывать две 3d- (внутреннего слоя), одну 4s- и три 4p-орбитали:
Co3+… |
3 d 6 |
4s 4p |
|
|
4d |
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Тип гибридизации – d 2sp3. Комплекс [Co(NH3)6]3+ будет низкоспиновым и внут-
риорбитальным, что объясняется отсутствием неспаренных электронов на 3d- подуровне и расположением неподеленных пар электронов на внутреннем 3d- подуровне.
Таким образом, один и тот же комплексообразователь с лигандами сильного и слабого поля может образовывать как низко-, так и высокоспиновые комплексы.
В тетраэдрических комплексах (КЧ = 4) картина расщепления будет обратной по отношению к октаэдрическим комплексам. Орбитали комплексообразователя dxy, dxz, dyz расположены ближе к лигандам и имеют более высокую энергию, а орбитали d х2 − y2
и d 2z расположены дальше от лигандов (рис. 27.1) и имеют более низкую энергию. Расщепление d-подуровня в тетраэдрическом поле лигандов:
Е
В тетраэдре четыре лиганда создают более слабое силовое поле, чем шесть лигандов в октаэдре, поэтому энергия расщепления тетраэдрическим полем тетр всегда меньше, чем октаэдрическим. Расчеты показывают, что тетр = 4/9 окт.
Рассмотрим строение комплексного иона [NiCl4]2− . В этом ионе лиганды создают тетраэдрическое поле.
Е
Ион Ni2+ имеет следующее электронное строение …3 d 84s04p0:
Ni2+… |
|
3 d 8 |
4s |
4p |
|
|
|
4d |
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Ион Cl− – лиганд слабого поля – вызывает незначительное расщепление d- подуровня, значение тетр мало. Лиганды образуют четыре
σ-связи, их неподеленные пары электронов занимают одну 4s- и три 4p-орбитали иона Ni2+. Тип гибридизации – sp 3. Высокоспиновый комплекс.
Теория кристаллического поля позволяет объяснять магнитные свойства. По характеру взаимодействия с магнитным полем различают парамагнитные и диамагнит- ные вещества. Парамагнитные вещества втягиваются в магнитное поле, диамагнитные выталкиваются им. Различия в магнитных свойствах связаны с электронным строени-
180
ем вещества. Если в молекуле, ионе все электроны спарены (их магнитные моменты взаимно компенсируются и суммарный магнитный момент равен нулю), то такая частица диамагнитна. Парамагнетизм проявляют частицы, имеющие неспаренные электроны, так как суммарный магнитный момент такой частицы не равен нулю, и с увеличением числа неспаренных электронов он возрастает.
Цветность комплексных соединений
Многие комплексные соединения в кристаллическом состоянии и водном растворе отличаются яркой окраской. Так, водный раствор, содержащий катионы [Cu(NH3)4]2+, окрашен в интенсивно синий цвет, катионы [Ti(H2O)6]3+ придают раствору фиолетовую окраску, а катионы [Co(NH3)5H2O]2+ – красную. Теория кристаллического поля позволяет объяснить появление той или иной окраски у комплексных соединений.
Если через раствор или кристаллический образец вещества пропускать свет види- мой части спектра, то возможны три варианта физического поведения образца:
–отсутствие поглощения света любой длины волны (образец вещества бесцветен, хотя может иметь полосы поглощения в ультрафиолетовой области спектра);
–полное поглощение света во всем интервале длин волн (образец будет казаться черным);
–поглощение света только определенной длины волны (тогда образец будет иметь цвет, дополнительный к поглощенному узкому участку спектра).
Таким образом, цвет раствора или кристаллов определяется частотой полос погло- щения видимого света. Поглощение квантов света комплексами (например, имеющими октаэдрическое строение) объясняется взаимодействием света с электронами, находящимися
на dε-подуровне, и их переходом на вакантные орбитали dγ-подуровня.
Например, при пропускании света через водный раствор, содержащий катионы гексаакватитана(III) [Ti(H2O)6]3+, обнаруживается полоса поглощения света в желтозеленой области спектра (20 300 см–1 , λ ≈ 500 нм). Это связано с переходом единственного электрона комплексообразователя с dε-АО на dγ-подуровень. Поэтому раствор, содержащий [Ti(H2O)6]3+, приобретает фиолетовый цвет (дополнительный к поглощенному желто-зеленому):
желто-зеленая |
желтая |
оранжевая |
красная |
пурпурная |
фиолетовая |
синяя |
голубая |
сине-зеленая |
зеленая |
Если комплексообразователь имеет электронную конфигурацию d0 или d10, то переходы электронов с dε-АО на dγ-подуровень или наоборот невозможны либо из-за отсутствия электронов, либо из-за отсутствия вакантных орбиталей. Поэтому растворы комплексов с такими комплексообразователями, как Sc(III), Cu(I), Zn(II), Cd(II), не поглощают энергии в видимой части спектра и являются бесцветными.
