
Курс лекций Ашуйко
.pdf∆S2980 =(4 S2980 (HCl)+ S2980 (O2 ))−(2 S2980 (H2O)+ 2 S2980 (Cl2 ))=
=(4 186,8 + 205,0)−(2 188,7 + 2 222,9)=129,0 Дж/К.
Находим энергию Гиббса реакции при 1000 К по уравнению:
∆G10000 ≈114 400 −1000 129,0 = −14 600 Дж.
Так как ∆G10000 < 0, значит при температуре 1000 К реакция термодинамически возможна.
Для определения температуры, при которой реакция становится термодинамически возможной, используем условие:
|
|
|
|
∆G0 |
< 0 , |
|
||
|
|
|
|
|
T |
|
|
|
или |
|
∆H2980 |
−T ∆S2980 < 0 , |
|||||
|
T > |
∆H 0 |
|
|
114 400 |
|
||
откуда |
298 |
= |
|
|
=886,8K . |
|||
∆S2980 |
129,0 |
|||||||
|
|
|
|
|
||||
Пример 2. Рассчитайте давление разложения PbO2 по реакции
[PbO2] → [PbO] + 0,5(O2)
при температуре 200°С.
Решение. Давление разложения для данной реакции будет равно давлению кислорода
Pразл = PO2 .
Для определения давления разложения будем использовать уравнение и выражение константы равновесия для данной реакции
KP = PO0,52 .
Из последнего выражения находим давление кислорода:
PO2 = KP2 .
Константу равновесия KP можно выразить из уравнения
Ошибка! Источник ссылки не найден., зная энергию Гиббса реакции при данной температуре. Переведем температуру в градусы Кельвина:
T = 273 + 200 = 473 К.
Вычисляем энергию Гиббса реакции при 473 K:
[PbO2] → [PbO] + 0,5(O2)
∆H 0f ,298,кДж/моль |
–276,6 |
–219,3 |
0 |
S2980 , Дж/(моль K) |
74,9 |
66,1 |
205,0 |
∆H2980 =(−219,3 + 0,5 0)−(−276,6)= 57,3 кДж =57 300 Дж;
∆S2980 =(66,1+0,5 205,0)−74,9 =93,7 Дж/К;
∆G4730 ≈57 300 −473 93,7 =12 979,9 Дж.
Выражаем из уравнения константу равновесия реакции:
ln KP = − |
∆G0 |
= − |
12 979,9 |
= −3,3022; |
T |
8,31 473 |
|||
|
R T |
|
|
KP = e−3,3022 = 4,98 10−2 .
Тогда давление разложения будет равно:
Pразл = PO2 = KP2 =(4,98 10−2 )2 = 2,48 10−3 атм.
ХИМИЧЕСКОЕ РАВНОВЕСИЕ. КОНСТАНТА ХИМИЧЕСКОГО РАВНОВЕСИЯ
Химические реакции подразделяются на обратимые и необратимые. Необратимые реакции при данных условиях идут практически до конца в одном направлении, при изменении внешних условий (Т, Р, С) обратный
процесс провести невозможно.
Химически обратимые реакции начинают протекать в одном направлении, при этом реагируют друг с другом исходные вещества, а затем идут в обоих направлениях, так как продукты реакции взаимодействуют между собой с образованием исходных веществ.
Если проводить обратимую реакцию в закрытой системе, то через некоторое время система придет в состояние химического равновесия – концентрации всех реагирующих веществ перестанут изменяться во времени. При достижении системой состояния равновесия процесс не прекращается; химическое равновесие является динамическим, т.е. соответствует одновременному протеканию процесса в противоположных направлениях с одинаковой скоростью. Химическое равновесие является подвижным – всякое бесконечно малое внешнее воздействие на равновесную систему вызывает бесконечно малое изменение состояния системы; по прекращении внешнего воздействия система возвращается в исходное состояние. Важным свойством химического равновесия является то, что система может самопроизвольно прийти в состояние равновесия с двух противоположных сторон.
Признаки истинного химического равновесия:
1.состояние системы остается неизменным во времени при отсутствии внешних воздействий;
2.состояние системы изменяется под влиянием внешних воздействий, сколь малы бы они ни были;
3.состояние системы не зависит от того, с какой стороны она подходит к равновесию.
Положение химического равновесия – это достигнутое при равновесии соотношение концентраций реагирующих веществ, которое неизменно для данного состояния. Количественной характеристикой химического равновесия является константа равновесия, которая может быть выражена через рав-
новесные концентрации С, парциальные давления P.
Состояние химического равновесия описывается законом действую-
щих масс.
При достижении равновесия отношение произведения концентраций (парциальных давлений) продуктов реакции в степенях, соответствующих стехиометрическим коэффициентам, к произведению концентраций исходных веществ также в степенях, соответствующих стехиометрическим коэффициентам, представляет собой константу.
Она зависит только от природы реагирующих веществ и температу-
ры. Константа, выраженная через равновесные концентрации Ci обозначается Kс, а выраженная через парциальные давления Pi – Kр.
Для гомогенного процесса
а(А) + b(В) = d(D) + k(K)
Kс = |
Cd |
Ck |
или Kр = |
Pd |
Pk |
|
|||||
|
D |
|
K |
|
|
D |
K |
. |
|||
Ca |
Cb |
Pa |
|
||||||||
|
|
Pb |
|
||||||||
|
|
A |
|
B |
|
|
A |
B |
|
||
Для гетерогенного процесса |
|
|
|
|
|
|
|
|
|
||
а(А) + b(В) = с[C] + d(D) |
|
||||||||||
Kс = |
|
|
Cd |
или Kр = |
|
Pd |
. |
||||
|
|
|
D |
|
|
D |
|||||
|
Ca |
Cb |
|
Pa Pb |
|||||||
|
|
|
|
|
|||||||
|
|
A |
B |
|
|
A |
B |
|
|||
Концентрация вещества С в процессе взаимодействия не изменяется, поэтому не включается в выражение константы равновесия (С не является действующей массой).
Выражение для Кс и Кр представляет собой математическое выражение закона действующих масс применительно к обратимым процессам.
Используя уравнение Менделеева-Клапейрона РV= (m/M) RT, преобразование которого
РV= nRT Р= CRT
дает связь между Кс и Кр:
Кр = Кс (RT)∆n,
∆n разность между количеством образовавшихся газообразных продуктов и количеством исходных газообразных веществ.
Для равновесий возможна запись константы равновесия через концентрации реагентов (Кс) или парциальные давления (Кр).
Примеры записи выражения констант химического равновесия:
Равновесия в гомогенных системах:
(СО) + (Сl2) (COCl2) |
Kc = |
|
СCOCl2 |
|
; Kp = |
|
PCOCl2 |
||||
С |
|
C |
|
|
P |
P |
|||||
|
|
СO |
Cl2 |
|
|
|
CO |
Cl2 |
|||
|
|
С2 |
|
|
|
|
Р2 |
|
|
||
(N2) + 3(H2) 2(NH3) |
Kc = |
|
NH 3 |
|
Кр = |
|
|
NH 3 |
|||
|
|
|
; |
|
|
|
. |
||||
C |
N 2 |
С3 |
P |
|
P3 |
||||||
|
|
|
H 2 |
|
|
N 2 |
H2 |
||||
Равновесие в гетерогенных системах:
[C] + (CO2) 2(CO) |
|
С2 |
Kc = |
СО |
|
С |
||
|
|
СО2 |
[Fe2O3] + 3(CO) 3 (CO2) + 2[Fe]
{H2O} (H2O)
|
|
Р2 |
|
|
|
|
; Кр = |
|
СО |
|
|
|
|
|
Р |
|
|
|
||
|
|
СО2 |
|
|
|
|
|
С3 |
|
Р3 |
|
||
Kc = |
|
СО |
; Кр = |
СО |
2 |
|
|
2 |
|
|
|||
|
С3 |
Р3 |
|
|||
|
|
СО |
|
СО |
||
Kp = PH 2 О; Кс = СH 2 О.
По значению константы химического равновесия можно судить о глубине протекания процесса к моменту достижения равновесия.
В расчетах, связанных с использованием констант равновесия Kс, в предлагаемых задачах используются понятия равновесные и исходные концентрации, изменения концентраций.
Равновесными называют концентрации реагирующих веществ в состоянии химического равновесия (С).
Исходными считают заданные до начала реакции концентрации веществ (С0). Равновесные концентрации реагентов (С) связаны с их исходной концентрацией (С0) уравнением С = С0 – ∆С, где ∆С – количество исходного вещества которое прореагировало до наступления состояния равновесия.
Пример 1: Найти равновесные концентрации CH4, H2O и H2 в системе
(CH4) + (H2O) → (CO) + 3(H2)
если известно, что начальные концентрации CH4 и H2O равны 0,1 и 0,2 моль/л, соответственно, а равновесная концентрация CO составляет 0,08 моль/л. Найти константу равновесия KC.
Дано: |
Решение: |
C0(CH4) = 0,1 моль/л |
По условию задачи к моменту наступ- |
C0(H2O) = 0,2 моль/л |
ления равновесия образовалось 0,08 моль |
C(CO) = 0,08 моль/л |
CO. Составим пропорцию согласно коэф- |
KC – ? |
фициентам в уравнении реакции: |
при образовании 1 моль CO |
образуется 3 моль Н2 |
при образовании 0,08 моль CO |
образуется x моль Н2 |
x = 0,08 3 = 0,24 моль, |
С(H2) = 0,24 моль/л. |
1 |
|
Аналогично находим ∆С для СН4 и H2O:
на образование 1 моль CO расходуется 1 моль СН4 на образование 0,08 моль CO расходуется x моль СН4
x = |
0,08 1 |
= 0,08моль, |
∆С(CH4) = 0,08 моль/л; |
|
1 |
|
|
на образование 1 моль CO расходуется 1 моль Н2O на образование 0,08 моль CO расходуется x моль Н2O

x = 0,08 1 |
= 0,08моль, |
|
|
|
|
|
∆С(H2O) = 0,08 моль/л; |
||||||||
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Тогда равновесные концентрации исходных веществ (С = С0 - ∆С): |
|||||||||||||||
|
C(CH4) = 0,1-0,08 = 0,02 моль/л, |
|
C(H2O) = 0,2-0,08 = 0,12 моль/л. |
||||||||||||
Если коэффициенты в уравнении реакции невелики, то вычисления С и |
|||||||||||||||
∆С часто проводят в уме и представляют их в форме таблицы: |
|||||||||||||||
|
|
|
(CH4) + |
(H2O) |
' |
(CO) + |
3(H2) |
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
С0 |
0,1 |
|
0,2 |
|
|
|
- |
|
- |
|
||||
|
∆С |
0,08 |
|
0,08 |
|
|
|
- |
|
- |
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
С |
0,02 |
|
0,12 |
|
|
0,08 |
|
0,24 |
|
|||||
|
|
|
|
|
|
|
|
|
|
||||||
Константа равновесия рассматриваемой реакции будет равна |
|||||||||||||||
|
KC = |
|
C (CO) C3 (H2 ) |
|
|
0,08 (0,24)3 |
|
|
|||||||
|
|
|
= |
|
|
|
= 0,4608 . |
|
|
||||||
|
|
C (CH4 ) C (H2O) |
|
0,02 0,12 |
|
|
|
||||||||
Пример 2: При некоторой температуре константа равновесия реакции
[C] + (CO2)→2(CO)
равна 0,1. Найти равновесные концентрации CO2 и CO в системе, если исходная концентрация CO2 равна 0,01 моль/л.
Решение. Поскольку коэффициенты реакции невелики представим значения С и ∆С в табличной форме. Примем, что к моменту наступления равновесия прореагировало x моль CO2, т.е. ∆С(CO2) = x моль/л.
|
[C] + |
(CO2) ' 2(CO) |
||
С0 |
- |
|
0,01 |
- |
∆С |
- |
|
x |
- |
|
|
|
|
|
С |
- |
|
0,01-x |
2x |
|
|
|
|
|
Поскольку содержание твердых веществ в системе не оказывает влияния на химическое равновесие и концентрации веществ в твердом состоянии не входят в выражение константы равновесия, то для углерода ([C]) в таблице не приведено значений. Запишем выражение константы равновесия для рассматриваемой реакции:
C2 (CO)
KC = C (CO2 ).
Из этого выражения найдем x:
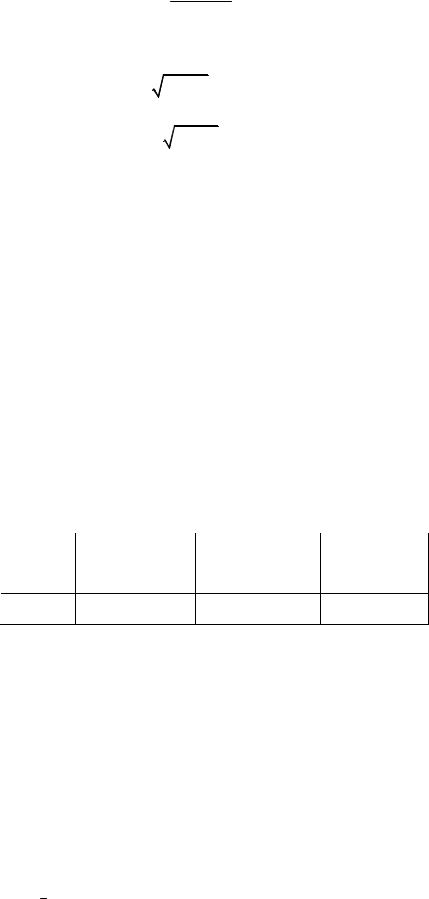
0,1 = (2x)2 ;
0,01− x
4x2 + 0,1x – 0,01 = 0;
D = 0,01 + 4 4 0,001=0,026;
x1 = −0,1− 0,026 = −0,0327 , не подходит
2 4
x2 = −0,1+ 0,026 = 0,00766 , подходит. 2 4
Значит равновесные концентрации веществ будут равны:
C(CO) = 0,01-0,00766 = 0,00234 моль/л; C(CO2) = 2 0,00766 = 0,01532 моль/л.
Пример 3: Исходные концентрации N2 и O2 в системе
(N2) + (O2) → 2(NO)
равны 0,03 и 0,01 моль/л соответственно. К моменту наступления равновесия
вреакцию вступило 5 % N2. Определить равновесные концентрации веществ
всистеме и константу равновесия.
Решение. Определим количество N2, вступившего в реакцию:
0,03 моль N2 |
— |
100 % |
|
|
|||
x моль N2 |
|
— |
5 % |
|
|
|
|
x = 0,03 5 |
= 0,0015 моль, |
|
∆С(N2) = 0,0015 моль/л. |
||||
100 |
|
|
|
|
|
|
|
Представим значения С и ∆С в табличном виде: |
|
||||||
|
|
|
(N2) |
+ |
(O2) |
' |
2(NO) |
|
|
|
|
|
|
|
|
|
|
С0 |
0,03 |
|
0,01 |
|
- |
|
|
|
|
|
|
|
|
|
|
∆С |
0,0015 |
|
0,0015 |
|
- |
С0,03-0,0015 0,01-0,0015 2 0,0015
Равновесные концентрации веществ будут равны:
C(N2) = 0,0285 моль/л; C(O2) = 0,0085 моль/л; C(NO) = 0,003 моль/л.
Константа равновесия данной реакции:
KC = |
C2 (NO) |
= |
(0,003)2 |
= 0,0372 . |
C (N2 ) C (O2 ) |
0,0285 0,0085 |
Пример 4. Определите давление разложения
3[Fe2O3] 2[Fe3O4] + ½(O2) при 627оС.
При какой температуре давление кислорода достигнет 1атм (101 325 Па)? Решение. Для определения давления разложения, т. е. давления кислорода, который образуется в данном процессе термического разложения, надо
1
вычислить Кр = р(2O2 ) при Т = 627оС = = 900 К.
Запишем процесс и для всех веществ, участвующих в реакции, выписы-
ваем из справочника значения ∆H 0f,298 |
и S 0298 : |
|
|
3[Fe2O3] 2[Fe3O4] + ½(O2) |
|
||
∆H 0f,298 ,кДж/моль |
–821,22 |
–1117,71 |
0 |
S 0298 , Дж/(моль К) |
89,96 |
151,46 |
205,03. |
В соответствии со следствием из закона Гесса:
∆Н0298 = 2∆H 0f,298 [Fe3O4] + ½ ∆H 0f,298 (O2) – 3∆H 0f,298 [Fe2O3] =
= 2 (–1117,71) + ½ 0 – 3(–821,22) = 228,54 кДж = 228 540 Дж;
∆S 0298 = 2 S 0298 [Fe3O4] + ½ S 0298 (O2) – 3S 0298 [Fe2O3] = 2 151,46 + + ½ 205,03 – 3 89,96 = 135,555 Дж/К.
Изменение стандартной энергии Гиббса при 900К находим из соотноше-
ния:
|
|
|
|
∆Н0298 |
– Т∆S 0298 , (∆Н0298 ∆Н9000 , ∆S 0298 ∆S 9000 ). |
|
|
||||||||
∆G 9000 |
= ∆Н0298 – 900 ∆S 0298 = 228 540 – 900 135,555 = 106 540,5 Дж. |
||||||||||||||
|
|
|
|
|
∆G0 |
106 540,5 |
|
|
|
|
–7 |
. |
|||
|
lgKp = −19,15 T = |
−19,15 900 = –6,1816; Kp = 6,583 10 |
|
||||||||||||
|
|
|
|
|
|
|
900 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
Для данного гетерогенного процесса Кр = р |
|
|
|
|
|||||||||||
(2O2 ) , отсюда |
|
|
|||||||||||||
Р(О 2 ) = (Kp)2 = 4,334 10–13 атм. |
|
|
|
|
|
||||||||||
Если давление кислорода равно 1 атм то |
|
|
|||||||||||||
lgKp = lg1 |
1 |
= lg1 = 0 и ∆GT |
= –19,15 Т |
lgКp = 0. |
|
|
|||||||||
|
|
2 |
|
|
|
|
0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Найдем температуру, при которой ∆GT0 |
= 0: |
|
|
|
|||||||||||
∆GT0 |
= ∆Н0298 – Т∆S 0298 = 0, отсюда |
|
|
|
|
|
|||||||||
Т = |
∆Н2980 |
= |
|
228 540 |
|
= 1686 К. |
|
|
|
|
|
||||
135,555 |
|
|
|
|
|
|
|||||||||
|
∆S2980 |
|
|
|
|
|
|
|
|
|
|
|
|||
Следовательно, при температуре 1686 К, когда давление кислорода равно внешнему (1 атм), начнется разложение Fe2O3.
Пример 5. Определить термодинамические характеристики ∆H 0298 и ∆S 0298
процесса испарения бромида олова (II). Давление насыщенного пара SnBr2 при температуре 516оС составляет 0,13 атм, а при 636оС – 1 атм.
Решение. Для процесса {SnBr2} (SnBr2) Kр = РSnBr 2 . Константы равно-
весия связаны с термодинамическими характеристиками при разных температурах соотношениями:
|
|
|
0 |
0 |
- RT1 ln K p1 |
= ∆H290 |
−T1∆S298 ; |
||
|
|
|
= ∆H2980 |
−T2∆S2980 ; |
− RT2lnK p |
2 |
|||
|
|
|
|
|
Kp 1 |
= Р1 SnBr 2 = 0,13 атм, Kp 2 = Р2 SnBr 2 = 1 атм. |
|||
T1 = 516 + 273 = 789 К, T2 = 909 К. Так как ln1 = 0, то из второго уравне-
ния можно выразить ∆H 0298 через ∆S 0298 (∆H 0298 = 909∆S 0298 ) и подставить в первое уравнение:

–8,314 789 ln0,13 = 909∆S 0298 – 789∆S 0298 = 120∆S 0298 ;
∆S 0298 = |
−8,314 789 ln0,13 |
= 111,55 Дж/К. |
|
120 |
|
Тогда ∆H 0298 = 909∆S 0298 = 909 111,55 = 101 400 Дж = 101,4 кДж.
Полученные значения ∆H 0298 и ∆S 0298 характеризуют процесс испарения
SnBr2. Процесс эндотермический, испарение требует нагревания. При испарении энтропия увеличивается.
Пример 6. Диссоциация нитрозилхлорида происходит по схеме
2(NOCl) = 2(NO) + (Cl2).
Определить, при какой температуре Kр этой реакции равна 1. Чему равно парциальное давление Cl2, если общее давление в системе при равновесии составляет 2 атм?
Решение. Запишем уравнение реакции. Для каждого вещества, участвующего в ней, выпишем из справочника значения ∆H 0f,298 и S 0298
|
2(NOCl) = 2(NO) + (Cl2) |
|
|||||
∆H 0f,298 , кДж/моль |
|
52,5 |
|
90,25 |
0 |
||
S 0298 , |
Дж/(моль К) 261,5 |
|
210,62 |
222,9. |
|||
Рассчитаем ∆Н0298 |
и ∆S 0298 : |
|
|
|
|
||
∆Н0298 |
= 2 90,25 + 0 – 2 52,25 = 75,5 кДж = 75 500 Дж; |
||||||
∆S 0298 |
= 2 210,62 + 222,9 – 2 261,5 = 121,14 Дж/К. |
||||||
Из равенства ∆Н0 |
|
– 298 ∆S 0 |
|
= –R 298 lnK = 0 с учетом допущения |
|||
|
298 |
|
298 |
|
p |
||
о независимости значений ∆НТ0 и ∆SТ0 от температуры рассчитаем искомую температуру, при которой Kp = 1 (ln1 = 0):
Т = ∆Н2980 = 75 500 = 623,2 К.
∆S2980 121,14
Для расчета парциального давления хлора (pCl 2 ) нужно использовать константу равновесия указанного процесса Кр и закон Дальтона.
Кр процесса имеет вид: Кр = |
р2 |
p |
|
NO |
Cl2 |
. |
|
|
|
||
|
pNOCl2 |
||
На основании закона Дальтона Робщ = рNOCl + pNO + pCl 2 .
Если парциальное давление хлора принять за х, то парциальное давление NO составит 2х, так как из уравнения реакции следует, что в состоянии равновесия на 1 моль хлора образуется 2 моля NO, поэтому парциальные давления компонентов Cl2 и NO тоже будут относиться как 1:2 (pNO = 2pCl 2 = 2х).
Парциальное давление рNOCl можно выразить через парциальные давления
pCl 2 и pNO:
рNOCl = Робщ – (pNO + pCl 2 ) = 2 – 3х.
Выражение константы равновесия запишется:
Kр = |
х(2х)2 |
= 1; 1 = |
4х3 |
. |
|
(2 - 3x)2 |
(2 - 3x)2 |
||||
|
|
|

Решая уравнение относительно х, получим х = 0,4595. pCl 2 = 0,4595 атм.
СКОРОСТЬ И МЕХАНИЗМ ХИМИЧЕСКИХ РЕАКЦИЙ
Скорость и механизмы реакций, а также факторы, влияющие на скорость реакции, изучает химическая кинетика.
Если термодинамика отвечает на вопрос, возможна ли реакция, то изучение кинетических параметров процесса помогает определить, при каких условиях скорость реакции будет достаточной, чтобы процесс можно было использовать на практике.
Химические реакции, в которых взаимодействующие вещества находятся в одной фазе, называются гомогенными, если же реагенты находятся в разных фазах, реакции гетерогенны.
(CO2) + (H2) = (CO) + (H2O) – гомогенная реакция; (CO2) + [C] = 2(CO) – гетерогенная реакция.
Гомогенные и гетерогенные реакции по механизму взаимодействия веществ существенно различаются между собой.
Скорость реакции определяется числом ее актов в единице объема в единицу времени для гомогенных реакций (объем системы постоянен) и в
единицу времени на единице площади поверхности раздела для гетероген-
ных реакций.
Она определяется количеством вещества, вступившего в реакцию или образовавшегося в результате реакции за определенный отрезок времени.
Различают среднюю и истинную (мгновенную) скорость реакции.
Среднюю скорость реакции характеризуют изменением концентрации одного из реагентов в единицу времени. Пусть в момент времени t1 реакции концентрация вещества А равняется С1, а в момент времени t2 равняется С2 Тогда средняя скорость реакции определяется отношением:
V = |
С2 |
−С1 |
или (1) |
|
t |
−t |
|||
2 |
1 |
|
|
|
V = |
∆С , |
(2) |
||
|
|
∆t |
|
|
где ∆С − изменение концентрации, |
∆t |
− изменение времени. |
||
Поскольку концентрация исходного вещества в реакции убывает, а концентрация продуктов реакции возрастает, то в общем случае для определения скорости реакции используется уравнение
V = ± ∆∆Сt . (3)
Истинная (мгновенная) скорость реакции определяется как производная от концентрации по времени (рис. 1)
V = ±ddСt . (4)
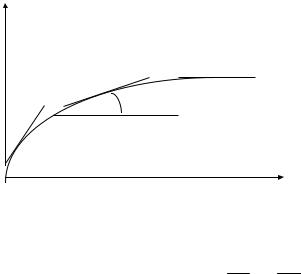
Истинную скорость реакции можно установить только в данный момент времени, в следующий она уже меняется. В определенный момент времени скорость реакции определяется тангенсом угла наклона касательной к кинетической кривой в какой-нибудь точке, полученной экспериментально:
V = tga . (5)
Как видно из рис. 1, угол наклона касательной к кривой скорости реакции в первый момент времени максимален и уменьшается по мере протекания реакции.
С
V =tgα
α2
α1
t
Знаки перед выражениями (3; 4) означают следующее. Скорость реак-
ции всегда положительна. Отношение ∆∆Сt и ddСt могут быть как положитель-
ными, так и отрицательными, в зависимости от того, какую концентрацию обозначает С (исходных веществ или продуктов реакции). Если С обозначает концентрацию одного из исходных веществ, то она убывает со временем, поэтому, чтобы значение скорости было положительным, при расчете надо правую часть равенств (3; 4) брать со знаком "-". Если С обозначает концентрацию одного из продуктов реакции, то она возрастает с течением времени, поэтому, чтобы значение скорости было положительным, надо правую часть указанных равенств брать со знаком "+".
Единицы измерения скорости реакции − моль/л с. Время может измеряться в секундах, минутах, часах, в зависимости от того, с какой скоростью протекает реакция.
Скорость реакции зависит от:
-природы реагирующих веществ;
-концентрации;
-давления, если в реакции участвуют газообразные вещества;
-температуры, при которой происходит реакция;
-степени измельчения реагирующих веществ, если в реакции уча-
ствуют твердые реагенты;
-присутствия катализатора.
Скорость реакции пропорциональна концентрации реагирующих ве-
ществ в степени стехиометрического коэффициента. Так для реакции
ν1A1 + ν2A2 + + νnAn → (5)
