
Курс лекций Ашуйко
.pdf
N(Х) = |
n(Х) |
, |
|
n(Х) +n(S) |
|||
|
|
где N(Х) – молярная доля растворенного вещества Х; n( Х) – количест-
во растворенного вещества Х, моль; n(S) – количество вещества растворителя S, моль. Молярная доля растворенного вещества – безразмерная величина. Сумма молярных долей растворителя и растворенного вещества составляет единицу.
Моляльная концентрация (m1). Моляльная концентрация – отношение количества растворенного вещества к массе растворителя. Моляльная кон-
центрация определяется количеством растворенного вещества в 1 кг растворителя.
m1(Х) = n( Х ) ,
mB
где m1(Х) – моляльная концентрация раствора, моль/кг; n( Х) – число молей растворенного вещества, моль; mB– масса растворителя, кг.
Разбавление растворов. При использовании растворов для препаративных целей иногда возникает необходимость их разбавления. В таких случаях перед экспериментатором стоит задача − получить из более концентрированного раствора раствор меньшей концентрации.
В процессе разбавления меняется только соотношение между компонентами раствора, растворенным веществом и растворителем. Количество вещества, находящееся в растворе, остается неизменным, меняются только количество растворителя и концентрация раствора.
nвещества до pазбавления = nвещества после разбавления .
Количество вещества в определенном объеме определяется произведением n V , где n – количество растворенного вещества, V – объем раствора.
Для того чтобы осуществить разбавление, нужно произвести расчет по следующему уравнению:
С(Х)исх Vисх = С(Х)после разб Vпосле разб
где С(Х)исх и С(Х) после разб. − молярная концентрация исходного и конечного растворов, соответственно V исх и V после разбавления − объем исходного и
конечного (после разбавления) растворов. В расчетах нужно использовать одни и те же единицы измерения, литры или миллилитры. Объем растворителя, необходимый для разбавления, определяется разностью между значениями исходного объема раствора и его объема после разбавления.
Например. Нужно приготовить 500 мл 1,5 М раствора Н2SO4 из 4 М раствора этой же кислоты. Какой объем раствора исходной концентрации потребуется для этого?
Известны молярные концентрации раствора до разбавления и после разбавления, а также объем кислоты после разбавления, нужно определить, какой объем 4 М кислоты потребуется для разбавления.

V |
= |
С(Х)после pазбVпосле разб. |
= 1,4 500 |
= 175 мл. |
|
С(Х)исх |
|||||
исх |
|
4 |
|
Для разбавления нужно отмерить 175 мл раствора исходной концентрации, поместить его в мерную колбу объемом 500 мл и добавить в колбу воды до метки, обозначающей указанный объем.
Уравнение может быть использовано для учета разбавления при сливании растворов разных веществ без учета взаимодействия между ними.
Например, нужно определить концентрацию Na2SO4 в растворе, полученном в результате сливания 200 мл 2М раствора Na2SO4 и 800 мл 1М раствора ВаС12.
С(Х) после разбавления = |
С(Х)исх Vисх |
= |
2 0,2 |
= 0,4 моль/ л. |
|
Vпосле разбавления |
1 |
||||
|
|
|
Переход от молярной к нормальной концентрации. Молярная и нор-
мальная концентрации одного и того же раствора либо равны (z = 1), либо молярная концентрация меньше нормальной во столько раз, во сколько молярная масса эквивалента меньше молярной массы вещества.
Для перехода от молярной концентрации к нормальной можно использовать соотношения
С(1/ZХ)= |
m(Х) |
; М(1/Z Х)= 1/Z M(Х) |
M(1 / Z Х) V |
Сделав подстановку, получим:
С( Х) = Z m(Х) – молярная концентрация
M(Х) V
Отсюда получаем:
С(1/ZХ)= ZС(Х);
С(Х) = Z1 С(1/Z Х).
Примеры расчетов, связанных с различными способами выражения концентрации растворов.
Пример 1. Какой объем 30%-ного (по массе) гидроксида натрия (ρ = 1,33 г/мл) надо взять для приготовления 250 мл 14%-ного раствора (ρ = 1,15 г/мл)?
Решение. Рассчитаем массу 14%-ного раствора, для которого известны и объем, и плотность:
m(14% раст NaOH) = ρ V = 1,15 250 = 287,5 г.
Определим массу чистого гидроксида в 14%-ном растворе: m(NaOH) = m(14% раст. NaOH) ω = 287,5 0,14 = 40,25 г.
Эта же масса гидроксида натрия будет содержаться и в 30%-ном растворе и будет составлять 30% от всей массы раствора.

ω = 0,3 = |
m(NaOH) |
; m(30% раствора NaOH) = |
40,25 |
|
= 134,2 г. |
||||
m(30%раст ) |
|
||||||||
|
|
|
0,3 |
|
|
||||
Масса 30%-ного раствора определена, рассчитаем его объем, используя |
|||||||||
известное значение плотности: |
|
|
|
|
|
|
|||
|
V = |
|
m(30% раст) |
= |
134,2 |
= 100,9 мл. |
|
||
|
|
ρ |
|
|
|||||
|
|
|
1,33 |
|
|
|
|
||
Пример 2. В 250 мл воды растворили 50 г гексагидрата хлорида кальция (СаСl2 6H2O). Определить массовую долю СаСl2 (%) в полученном растворе.
Решение. Для нахождения массовой доли СаСl2 в растворе по формуле (9.1) нужно знать массу раствора и массу безводного СаСl2.
Масса раствора слагается из массы воды и массы кристаллогидрата:
m(H 2 O) = ρ(H 2 O) V(H 2 O) = 1 250 = 250 г;
mраст = m(H 2 O) + m(CaCl 2 6 H 2 O) = 250 + 50 = 300 г.
Далее следует произвести расчет массы СаСl2, содержащейся в заданной массе кристаллогидрата, исходя из соотношения между молярными массами кристаллогидрата и безводной соли.
М(СаС12)= 111 г/моль.
М(СаС12 6Н2О) = 111 + 6 18 = 219 г/моль. 219 г СаСl2 6H2O содержат 111 г СаСl2
50 г СаСl2 6H2O ––––––––– х г СаСl2 х = 50219111 = 25,34г.
Эта масса соли содержится в 300 г раствора. Отсюда можно определить
ω(СаС12):
ω(СаС12) = m(СаС12 ) = 25,34г = 0,084 или 8,4 % m( раст) ) 300г
Пример 3. Вычислить молярную и нормальную концентрацию 10%- ного раствора CuSO4 (ρ = 1,10 г/мл).
Решение. Молярная концентрация − отношение числа молей растворенного вещества к объему раствора:
С(CuSO |
|
) = |
m(CuSO4 ) |
|
|
4 |
M (CuSO4 )V |
||||
|
|
|
Определим массу сульфата меди в определенном объеме растворителя. Удобно выбрать объем − 1 л. Масса 1 литра (1000 мл) 10%-ного раствора CuSO4 равна
m(10% раст. CuSO 4 ) = ρ V = 1,1 г/мл 1000 мл = 1100 г.
Определим массу CuSO4, содержащуюся в 1100 г 10%-ного раствора: m(CuSO 4 ) = ωCuSO 4 m(10% раст CuSO 4 ) = 0,1 1100 = 110 г.

Фактор эквивалентности сульфата меди равен 1/2, поэтому
М(1/2 CuSO 4 ) = 1/2 М( CuSO4) = 1/2 159,6 г/моль = 79,8 г/моль, М(CuSO 4 ) = 159,6 г/моль.
Зная массу CuSO4, содержащуюся в 1 л 10%-ного раствора, а также молярную массу и молярную массу эквивалента соли, определим молярную и нормальную концентрации раствора:
С(CuSO 4 ) = 159110,61 = 0,689 М. С(1/2 CuSO 4 ) = 79110,8 = 1,378 н.
РАСТВОРЫ НЕЭЛЕКТРОЛИТОВ
КОЛЛИГАТИВНЫЕ СВОЙСТВА РАСТВОРОВ НЕЭЛЕКТРОЛИТОВ
Некоторые важные свойства растворов зависят от числа частиц (атомов, молекул, ионов) в растворе и не зависят от состава раствора. Такими свойствами, которые называются коллигативными, обладают разбавленные раство-
ры неэлектролитов.
К коллигативным свойствам относятся понижение давления пара, понижение температуры замерзания, повышение температуры кипения растворителя в присутствии в нем растворяемого вещества.
ТОНОСКОПИЧЕСКИЙ ЗАКОН РАУЛЯ
Рассмотрим двухкомпонентный раствор, свойства которого близки к идеальному, что означает, что между компонентами раствора практически отсутствует взаимодействие. Как всякий раствор, он содержит определенное количество растворителя и растворенного вещества. Их соотношение определяется концентрацией раствора. Пусть растворитель − летучее вещество, растворенное нет. Выразим состав раствора в молярных долях. N1 − молярная
доля растворителя, а N2 − молярная доля растворенного вещества (безразмерная величины). N1 + N2 = 1. Молярная доля ( Ni ) представляет собой отноше-
ние количества какого-то вещества к общему количеству вещества: Ni = ∑nini .
Жидкость испаряется, поэтому над раствором всегда существует насыщенный пар. Его давление зависит от природы жидкости и условий, при которых происходит испарение.
Равновесное состояние между жидкостью и паром характеризуется дав-
лением насыщенного пара.
Общее давление Р насыщенного пара над раствором слагается из давления пара р1, растворителя и р2, давления растворенного вещества. Давления р1 и р2 называются парциальными. Общее давление в системе в соответствии с законом Дальтона представляет собой их сумму Р= р1+ р2.
Величина парциального давления определяется молярной долей компонента в растворе. Парциальное давление растворителя определяется произве-

дением давления насыщенного пара над растворителем, умноженным на его молярную долю.
р1 = Р1o N1 (1)
Поскольку в рассматриваемом случае растворенное вещество нелетучее, то соответствующее выражение для растворенного вещества
р2 = Р2o N2 (2)
обращается в ноль. Общее давление в системе определяется произведением Р= Р1o N1 ,
гдеР1o−давление насыщенного пара над чистым растворителем.
N1 = 1– N2 ,
поэтому уравнение (2) можно переписать:
Р= Р1o(1– N2 ) (3)
Общее давление над раствором определятся парциальным давлением растворителя, летучего компонента раствора.
Из уравнения (1) следует, что давление насыщенного пара над раствором будет ниже, чем давление над чистым растворителем. Понижение дав-
ления будет тем значительнее, чем больше введено в раствор растворенного вещества.
Первая формулировка тоноскопического закона Рауля:
Давление насыщенного пара над раствором равно его давлению над чистым растворителем, умноженному на молярную долю растворителя:
Р1 = Р1o N1 .
Понижение давления пара определяется разностью Р1o и Р, давлением насыщенного пара над чистым растворителем и раствором.
∆Р = Р1o − Р (4)
Поскольку Р= Р1o(1– N2 ), то можно записать, что
∆Р= Р1o N2 . (5)
Отсюда следует, что относительное понижение давления насыщенного
пара
∆Рo = N2 . (6)
Р1
Вторая формулировка тоноскопического закона Рауля:
Относительное понижение давления насыщенного пара раствора нелетучего вещества равно молярной доле растворенного вещества.
бинарного (состоящего из двух компонентов) раствора летучи, то пар над раствором будет содержать оба компонента (относительное содержание
компонентов в парах будет, как правило, отличаться от содержания их в растворе – пар относительно богаче компонентом, температура кипения которого ниже). Рассмотрим бинарный раствор, состоящий из компонентов А и В, неограниченно растворимых друг в друге. Общее давление пара, согласно пер-
вому закону Рауля, равно
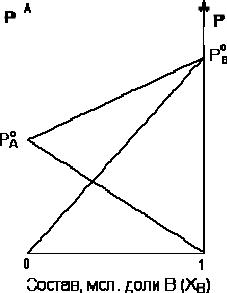
P=P0ANA + P0BNB = P0A–NB(P0A-P0B)
Таким образом, для идеальных бинарных растворов зависимость общего и парциального давления насыщенного пара от состава раствора, выраженного в мольных долях компонента В, является линейной при любых концентрациях. К таким системам относятся, например, системы бензол – толуол, гексан – гептан, смеси изомерных углеводородов и др
Зависимость парциальных и общего давлений пара идеального раствора от концен-
трации
Для реальных растворов данные зависимости являются криволинейными. Если молекулы данного компонента взаимодействуют друг с другом сильнее, чем с молекулами другого компонента, то истинные парциальные давления паров над смесью будут больше, чем вычисленные по первому закону Рауля (положительные отклонения) Если же однородные частицы взаимодействуют друг с другом слабее, чем разнородные, парциальные давления паров компонентов будут меньше вычисленных (отрицательные отклонения). Реальные растворы с положительными отклонениями давления пара образуются из чистых компонентов с поглощением теплоты (∆Нраств > 0), растворы с отрицательными отклонениями образуются с выделением теплоты
(∆Нраств < 0).
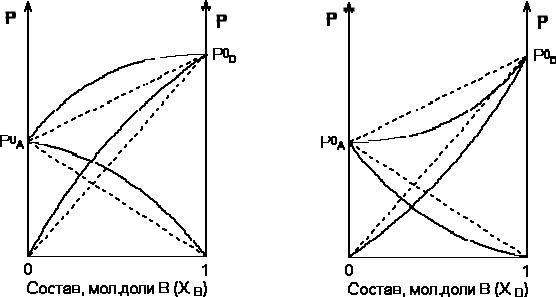
Зависимость парциальных и общего давлений пара идеальных (штриховая линия) и реальных (сплошная линия) бинарных растворов от состава при положительных (слева) и отрицательных (справа) отклонениях от закона Рауля.
КРИОСКОПИЧЕСКИЙ И ЭБУЛЛИОСКОПИЧЕСКИЙ ЗАКОНЫ РАУЛЯ
Температура кипения − это температура, при которой давление насыщенного пара жидкости равно атмосферному давлению. Вода кипит при 100оС, если давление ее насыщенного пара равно 1 атм.
Температура замерзания − это температура, при которой давление насыщенного пара над жидкостью становится равным давлению пара над соответствующим веществом, находящимся в твердой фазе.
Пусть раствор нелетучего вещества закипает при некоторой температуре, при этом в результате частичного улета летучего растворителя концентрация раствора увеличивается, количество растворителя (N1) уменьшается, давление над раствором понижается (уравнение 2). Процесс − равновесный, поэтому для восстановления равновесия нужно повысить температуру, чтобы вновь достичь равенства давления насыщенного пара над раствором и атмосферного (кипения).
Следовательно: раствор кипит при более высокой температуре, чем
чистый растворитель.
Понижение давления пара при введении растворенного вещества в чистый растворитель приводит к тому, что раствор замерзает при более низкой
температуре, чем чистый растворитель.
Эбуллиоскопический закон Рауля: ∆Ткип – повышение температуры
кипения раствора по сравнению с температурой кипения растворителя пропорционально моляльной концентрации растворенного вещества.
∆Tкип, = Кэб ·в(х) (7)
где Кэб – эбуллиоскопическая постоянная, коэффициент пропорциональности.
∆Ткип − повышение температуры кипения,

в(х) − моляльная концентрация растворенного вещества.
Криоскопический закон Рауля: ∆Тзам – понижение температуры
замерзания раствора по сравнению с температурой замерзания растворителя пропорционально моляльной концентрации растворенного вещества.
∆Tзам, = Ккр ·в(х) (8)
гдеКкр– криоскопическая постоянная.
Физический смысл эбуллиоскопической и криоскопической постоянных
определяется следующим образом.
Их числовые значения показывают, на сколько градусов выше кипел бы или на сколько градусов ниже замерзал бы раствор, содержащий 1 моль растворенного вещества в 1000 г растворителя, по сравнению с температурами кипения и замерзания чистого растворителя.
Эбуллиоскопическая и криоскопическая константы не зависят от природы растворенного вещества, а являются характеристиками растворителя. Их значения для некоторых растворителей имеются в таблицах. Значения Кэб и
Ккр для воды равны 0,516 град моль–1 кг и 1,86 град моль–1 кг соответственно.
Для определения молярной массы растворенного вещества, если известно повышение температуры кипения или понижение температуры замерзания раствора, удобно пользоваться следующим соотношением:
∆Т = К1000mA , (9)
MmB
где ∆Т− повышение температуры кипения или понижение температуры замерзания раствора по сравнению с соответствующими характеристиками чистого растворителя;
К − эбуллиоскопическая или криоскопическая константа (единицы измерения град моль–1 кг); отношение представляет собой выражение мо-
ляльной концентрации, где mB – масса растворителя; mA − масса растворенного вещества; М − молярная масса растворенного вещества.
Физический смысл эбуллиоскопической и криоскопической постоянных
определяется следующим образом.
Их числовые значения показывают, на сколько градусов выше кипел бы или на сколько градусов ниже замерзал бы раствор, содержащий 1 моль растворенного вещества в 1000 г растворителя, по сравнению с температурами кипения и замерзания чистого растворителя.

Повышение температуры кипения |
Понижение температуры замерзания |
Эбуллиоскопическая и криоскопическая константы не зависят от природы растворенного вещества, а являются характеристиками растворителя. Их значения для некоторых растворителей имеются в таблицах. Значения Кэб и
Ккр для воды равны 0,516 град моль–1 кг и 1,86 град моль–1 кг соответственно.
Примеры решения задач:
Пример 1. Определить давление насыщенного пара над раствором, полученным растворением 126 г мочевины в 450 г воды при 30оС.
Решение.
Для решения задачи запишем математическое выражение тоноскопического закона Рауля. ∆Р= Р1o N2 . Компонентами раствора являются вода и мо-
чевина. Давление чистого растворителя − воды можно определить, воспользовавшись данными табл. 2 приложения. При температуре 30оС оно составляет
31,8 мм рт. ст. ∆Р − разница между Р1o, давлением насыщенного пара над чистым растворителем, и Р, давлением насыщенного пара над раствором мочевины в воде. Обозначим это давление − х. N2 равно отношению количества вещества мочевины к сумме количества вещества мочевины и воды. Это отношение легко определяется из условия задачи. N2 = n1n+2n2 . Подставив в это
уравнение соответствующие значения масс и молярных масс растворенного
вещества и растворителя, получим N2 |
|
|
126 |
|
|
= 126 +450 = 0,077. Тогда 31,8 – х =31,8 |
|||||
|
|
|
60 |
|
|
|
60 |
18 |
|
|
|
0,077, х = 29,3 мм рт. ст., следовательно, давление насыщенного пара над раствором составляет 29,3 (мм рт. ст.), понижение давления пара над раствором по отношению к давлению насыщенного пара над чистым растворителем со-
ставляет 31,8 – 29,3 = 2,5 (мм рт. ст.).
Пример 2. Определить температуру кипения и температуру замерзания 2%-ного раствора нафталина в бензоле. Температура кипения бензола − 80,1оС, температура замерзания − 5,5оС.
Решение.
На основании эбуллиоскопического и криоскопического законов Рауля
можно записать ∆Т = К1000mA . Для того чтобы определить температуру кипения
MmB
раствора, нужно знать значение эбуллиоскопической константы бензола (ее значение есть в справочниках, она равна 2,53 град моль–1 кг). Тогда, подста-
вив известные величины в уравнение, получим ∆Т = |
2,53 2 1000 |
=0,40 К. По- |
|
128 98 |
|||
|
|
скольку чистый бензол кипит при 80,1оС, а повышение температуры состав-
ляет 0,40 К, то температура кипения раствора нафталина в бензоле составляет
80,5оС.
Температура замерзания этого раствора определяется таким же образом. ∆Т = 5,121282 981000 =0,8 град. Температура замерзания бензола 5,5оС. Понижение
температуры составляет 0,8 градуса, следовательно, температура замерзания 2%-ного раствора нафталина в бензоле составляет 4,7оС.
Пример 3. Определите массовую долю сахарозы в воде, если известно, что температура замерзания этого раствора составляет –0,21оС.
Решение.
Из данных задачи следует, что∆Т =0–(–0,21) = 0,21 градуса. Для определения массовой доли сахарозы в растворе воспользуемся уравнением,
∆Т = К1000mA , в которое подставим известные величины: Ккр− криоскопическую
MmB
константу, равную 1.86 град моль–1 кг, ∆Т и молярную массу сахарозы. Отношение m А = ∆TK M представляет собой массу растворенного вещества, прихо-
дящуюся на 1000 г растворителя, тогда mA = 0,211,86342 =38,6 г. На 1000 г растворителя приходится 38.6 г сахарозы, поэтому для определения массовой доли
растворенного вещества можно воспользоваться формулой ω = mраств.в−ва mраствора
или составить пропорцию:
в 1038.6 г раствора содержится 38.6 г сахарозы в 100 г раствора − х г сахарозы.
Следовательно, массовая доля растворенного вещества составляет
3,71%.
Пример 4. Раствор неэлектролита содержит 2,5 г растворенного вещества в 25 г бензола и замерзает при температуре 4,3оС. Определить молярную массу растворенного вещества.
Решение.
Используя данные условия задачи и температуру замерзания бензола 5,5оС, определим ∆Т. ∆Т = 5,5 – 4,3 = 1,2 град. Определим массу неэлектролита, приходящуюся на 1000 г растворителя. Это можно сделать, если вос-
пользоваться пропорцией |
|
|
на 25 г бензола |
|
приходится 2,5 г растворенного вещест- |
ва |
− |
|
на 1000 г бензола |
х г растворенного вещест- |
