
Курс лекций Ашуйко
.pdfвыражение скорости реакции имеет вид
V = kC νA1 CAν2 |
CAνn , (6) |
1 2 |
n |
где V− скорость реакции;
СAi − концентрации реагирующих веществ;
k− константа скорости химической реакции;
νi − число молекул данного вида, вступающих в реакцию (стехиометри-
ческий коэффициент).
Это выражение называют основным постулатом химической кинетики или уравнением основного кинетического закона.
Физический смысл константы скорости реакции: скорость реакции в
условиях, когда концентрации реагентов равны единице.
В этом случае k = V. Как видно из приведенного уравнения, константа пропорциональна скорости реакции. Она зависит от природы реагентов и от температуры и не зависит от концентрации реагентов.
МОЛЕКУЛЯРНОСТЬ И ПОРЯДОК РЕАКЦИИ
Молекулярность реакции определяется числом молекул, участвующих в элементарном акте взаимодействия, то есть числом одновременно соударяющихся молекул.
(НI) = 0,5(Н2) + 0,5(I2) – мономолекулярная реакция
(Н2) + (Cl2) = 2(HCl) – бимолекулярная реакция (в процессе участвуют две молекулы)
Наиболее вероятны двойные соударения, редко осуществляются тройные, и никогда не осуществляются четверные соударения.
Для реакции аА + вВ = сС, протекающей слева направо, уравнение скорости реакции имеет вид:
V = kСАνА СВνВ , (7)
где νА, νВ − постоянные числа, которые называются показателями порядка реакции по реагентам А и В,
νА − показатель порядка реакции по реагенту А,
νВ − по реагенту В.
Сумма νА + νВ называется суммарным (общим) порядком ν реакции.
Порядок реакции − величина эмпирическая, он характеризует фор- мально-кинетическую зависимость скорости реакции от концентрации реагирующих веществ. Порядок реакции нельзя определить по суммарному стехиометрическому уравнению реакции, оно не определяет скорости реакции. Порядок реакции совпадает с суммой стехиометрических коэффициентов уравнения реакции только в том случае, если оно отражает элементарный акт взаимодействия, во всех других случаях требуется экспериментальное определение показателей порядка реакции.
Реакции могут иметь нулевой, первый, второй и третий порядок, а так-

же дробный порядок.
Понятия "молекулярность реакции" и "порядок реакции" совпадают только для очень простых по механизму реакций.
ЭНЕРГИЯ АКТИВАЦИЯ. ПРЕДСТАВЛЕНИЕ О ТЕОРИИ АКТИВИРОВАННОГО КОМПЛЕКСА
Не всякое столкновение молекул может быть эффективным, то есть привести к взаимодействию молекул. Для эффективного соударения нужно чтобы молекулы:
- были ориентированы в пространстве таким образом, чтобы была возможность разрыва старых связей и образования новых;
- обладали достаточной энергией для образования либо продуктов реакции, либо активированного комплекса (промежуточного комплекса).
Активированный комплекс представляет собой образование, в котором старые связи (в молекулах водорода и йода) уже разрушены, а новые − между атомами водорода и йода еще не образовались, активированный комплекс
легко переходит в продукты реакции. |
|
|
Н − Н |
H H |
H − I |
→ |
|
→ |
|
I − I |
I |
I |
H − I |
Исходные |
|
Активированный |
Продукты |
вещества |
|
комплекс |
реакции |
Для образования активированного комплекса нужны затраты энергии.
Энергия активации - минимальная избыточная энергия, которой должна обладать реагирующая молекула в момент столкновения, чтобы прореагировать, это − тот энергетический барьер, который должны преодолеть молекулы для того, чтобы произошла реакция.
Энергия активации − минимальная избыточная энергия по отношению к средней энергии молекул, которая приводит к химическому взаимодействию. Энергию активации обозначают ЕА.
При нагревании увеличивается интенсивность движения частиц, поэтому увеличение температуры приводит к увеличению частоты столкновения молекул. Но не каждое столкновение является эффективным, поэтому увеличение скорости реакции при повышении температуры нельзя объяснить только увеличением частоты столкновений. При нагревании увеличивается количество активных молекул в результате увеличения возможностей для перераспределения энергии молекул в процессе столкновений.
На основании опытных данных установлено правило Вант-Гоффа: при
повышении температуры на каждые 10о скорость реакции увеличивается примерно в 2-4 раза.
УРАВНЕНИЕ АРРЕНИУСА
Зависимость константы скорости реакции от температуры описывается уравнением Аррениуса
К = Ае−Еа/ RT , (8)
где Еа − энергия активации реакции (кДж/моль), R − газовая постоянная (8,314Дж/К моль, Т − температура, е − основание натурального логарифма. А − предэкспоненциальный множитель, представляющий собой коэффициент пропорциональности. Коэффициент учитывает общее число соударений между молекулами в единице объема за единицу времени и пространственные препятствия, обусловленные неравноценностью отдельных частей сталкивающихся молекул.
Это уравнение легче использовать, если его прологарифмировать . lnK = ln Ae−Ea /RT = lnA - RTEA . (9)
Уравнение линейно. Такая зависимость позволяет графически определить энергию активации процесса (рис. 2).
lnK
Тангенс угла наклона равен - Еа
R
1
Т
Пусть известны константы скорости реакции при нескольких температурах, к1 при температуре Т1 и к2 при температуре Т2 . Прологарифмировав
уравнения Аррениуса, включающие эти значения, получим систему уравнений:
lnk1 = lnA - Еа
RT1
lnk 2 = lnA - Еа .
RT2
Вычтем из первого уравнение второе, получим уравнение Аррениуса,
ln k1 = Ea (T1 −T2 ) , (10)
k2 R
позволяющее рассчитать энергию активации процесса по известным константам скорости при разных температурах.
КАТАЛИЗ
Катализатор - вещество, которое увеличивает скорость химической реакции. Роль катализатора заключается в понижении энергии активации процесса. Сам катализатор в реакции не изменяет ни своего состава, ни своего состояния. Он участвует в промежуточных стадиях взаимодействия, временно связываясь с реагентами.
Первым промышленным производством, в котором был использован катализ, явился процесс Дикона (получение хлора):
4(HCl) +(O2) → 2(H2O) + 2(Cl2).
Если в систему добавить небольшое количество солей меди, то скорость реакции возрастает значительно. Количество катализатора после окончания реакции не изменяется в сравнении с начальным.
Положительные катализаторы ускоряют реакцию, отрицательные
(ингибиторы) замедляют реакцию. Ускоряющее действие катализатора заключается в уменьшении энергии активации катализируемой реакции.
Катализ делится на гомогенный, гетерогенный и автокатализ.
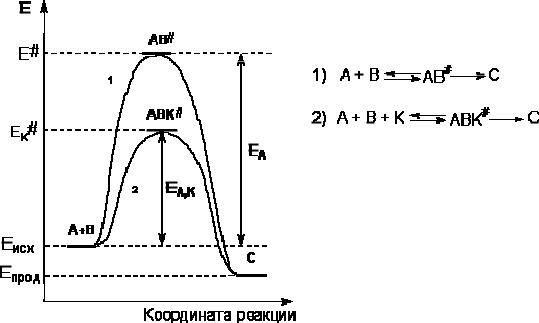
Гомогенный катализ – каталитические реакции, в которых реагенты и катализатор находятся в одной фазе. В случае гомогенно-каталитических процессов катализатор образует с реагентами промежуточные реакционноспособные продукты. Рассмотрим некоторую реакцию
А+ В → С
Вприсутствии катализатора осуществляются две быстро протекающие стадии, в результате которых образуются частицы промежуточного соединения АК и затем (через активированный комплекс АВК#) конечный продукт реакции с регенерацией катализатора:
А+ К → АК
АК + В → С + К
Примером такого процесса может служить реакция разложения ацетальдегида, энергия активации которой EA = 190 кДж/моль:
СН3СНО → СН4 + СО
В присутствии паров йода этот процесс протекает в две стадии:
СН3СНО + I2 → СН3I + НI + СО
СН3I + НI → СН4 + I2
Уменьшение энергии активации этой реакции в присутствии катализатора составляет 54 кДж/моль; константа скорости реакции при этом увеличивается приблизительно в 105 раз. Наиболее распространенным типом гомогенного катализа является кислотный катализ, при котором в роли катализатора выступают ионы водорода Н+.
Гетерогенный катализ – каталитические реакции, идущие на поверхности раздела фаз, образуемых катализатором и реагирующими веществами. Механизм гетерогенно-каталитических процессов значительно более сложен, чем в случае гомогенного катализа. В каждой гетеро- генно-каталитической реакции можно выделить как минимум шесть стадий:
1.Диффузия исходных веществ к поверхности катализатора.
2.Адсорбция исходных веществ на поверхности с образованием некоторого промежуточного соединения:
А + В + К → АВК
3. Активация адсорбированного состояния (необходимая для этого энергия есть истинная энергия активации процесса):
АВК → АВК#
4. Распад активированного комплекса с образованием адсорбированных продуктов реакции:
АВК# → СDК
5. Десорбция продуктов реакции с поверхности катализатора.
СDК → С + D + К
6. Диффузия продуктов реакции от поверхности катализатора.
Специфической особенностью гетерокаталитических процессов является способность катализатора к промотированию и отравлению.
Промотирование – увеличение активности катализатора в присутствии веществ, которые сами не являются катализаторами данного процесса (промоторов). Например, для катализируемой металлическим никелем реакции
СО + Н2 ––> СН4 + Н2О
введение в никелевый катализатор небольшой примеси церия приводит к резкому возрастанию активности катализатора.
Отравление – резкое снижение активности катализатора в присутствии некоторых веществ (т. н. каталитических ядов). Например, для реакции синтеза аммиака (катализатор – губчатое железо), присутствие в
реакционной смеси соединений кислорода или серы вызывает резкое снижение активности железного катализатора; в то же время способность катализатора адсорбировать исходные вещества снижается очень незначительно.
Автокатализ – процесс каталитического ускорения химической реакции одним из её продуктов. В качестве примера можно привести катализируемую ионами водорода реакцию гидролиза сложных эфиров. Образующаяся при гидролизе кислота диссоциирует с образованием протонов, которые ускоряют реакцию гидролиза. Особенность автокаталитической реакции состоит в том, что данная реакция протекает с постоянным возрастанием концентрации катализатора. Поэтому в начальный период реакции скорость её возрастает, а на последующих стадиях в результате убыли концентрации реагентов скорость начинает уменьшаться.
ОБЩАЯ ХАРАКТЕРИСТИКА РАСТВОРОВ. СПОСОБЫ ВЫРАЖЕНИЯ СОСТАВА РАСТВОРОВ
Растворы – однофазная система переменного состава, содержащая два и большее число компонентов.
Компонент - составная часть системы, которая является химически однородным веществом, может быть выделена из системы и может существовать в изолированном состоянии в течение длительного времени.
Компонент, взятый в избытке и в том же агрегатном состоянии, что и сам раствор, считают растворителем, а компонент, взятый в недостатке, – растворенным веществом.
В зависимости от состава и природы растворенных веществ растворы классифицируются:
1)по агрегатному состоянию: жидкие, твердые, газообразные.
-Жидкие растворы-растворы-системы, состоящие из растворителя и одного или нескольких, растворенных веществ (газы, жидкости, твердые вещества). Например, раствор сульфата меди в воде, раствор хлороводорода в воде, раствор эфира в спирте.
-Твердые растворов – это сплавы металлов (латунь-сплав меди и цинка).
-Газообразные растворы-смеси газов, например воздух (примерный состав по объему: 21% кислорода, 78% азота и 1% других газов). Наиболее распространены жидкие растворы (водные и неводные). В водных растворах растворителем является вода, в неводных растворителем (сольвентом) являются другие жидкости (бензол, спирт и т.д.)
2)по содержанию растворенного вещества: разбавленные и концен-
трированные. Принято считать, что в концентрированном растворе массовая доля растворенного вещества больше 20-30%.
3)по степени насыщенности: насыщенные, ненасыщенные и пере-
сыщенные растворы. Насыщенный раствор- раствор, находящийся в равновесии
срастворяемым веществом. В насыщенном растворе концентрация вещества
определяется его растворимостью при данных условиях. Растворы с меньшей концентрацией называются ненасыщенными. Раствор, содержащий вещества больше, чем это определяется его растворимостью при данных условиях, назы-
вается пересыщенным.
Растворение – сложный физико-химический процесс, в котором происходит взаимодействие молекул растворителя с частицами растворенного вещества. В результате этого взаимодействия образуются сольваты.
Сольваты – продукты переменного состава, которые образуются при химическом взаимодействии частиц растворенного вещества с молекулами растворителя. Если растворителем является вода, то образующиеся сольваты называются гидратами. Процесс образования сольватов называется сольватацией, образования гидратов – гидратацией. Примером процесса гидратации может служить растворение кристаллического NaCl в воде с образованием гидратиро-
ванных ионов.
NaCl(к)+ aq → {Na}+aq + {Cl}-aq
При растворении сульфата меди (II) (CuSO4) (вещества белого цвета) в воде происходит гидратация образующихся ионов, в результате чего раствор приобретает голубую окраску. При выпаривании раствора образуются кристаллогидраты сульфата меди (II), например CuSO4.5H2O. Кристаллические вещества, содержащие молекулы воды, называются кристаллогидратами, а вода, входящая в их состав, кристаллизационной водой.
Доказательством физико-химического характера процесса растворения являются тепловые эффекты. Тепловой эффект растворения равен сумме тепловых эффектов физического и химического процессов. Физический процесс протекает с поглощением теплоты, химический – с выделением. Если в результате гидратации (сольватации) выделяется теплоты больше, чем ее поглощается при разрушении структуры вещества (физический процесс), то растворение – экзотермический процесс (растворение KOH, H2SO4).
Если для разрушения структуры вещества необходимо больше теплоты, чем ее образуется при гидратации, то растворение – эндотермический процесс
(растворение KCl, NaNO3, K2SO4)
В общем случае при растворении происходит изменение свойств и растворителя, и растворенного вещества, что обусловлено взаимодействием частиц между собой по различным типам взаимодействия: Ван-дер- Ваальсового (во всех случаях), ион-дипольного (в растворах электролитов в полярных растворителях), специфических взаимодействий (образование водородных или донорно-акцепторных связей). Учет всех этих взаимодействий представляет собой очень сложную задачу. Очевидно, что чем больше концентрация раствора, тем интенсивнее взаимодействие частиц, тем сложнее структура раствора. Поэтому количественная теория разработана только для идеальных растворов, единственной движущей силой образования такого раствора является увеличение энтропии системы ∆S; ка- кие-либо тепловые или объемные эффекты при растворении отсутствуют
(∆Н = 0, ∆V = 0). К идеальным можно отнести газовые растворы и растворы неполярных жидкостей, в которых энергия взаимодействия разнородных частиц EA-B близка к энергиям взаимодействия одинаковых частиц EA- A и EB-B. Идеальными можно считать также бесконечно разбавленные растворы, в которых можно пренебречь взаимодействием частиц растворителя и растворенного вещества между собой. Свойства таких растворов зависят только от концентрации растворенного вещества, но не зависят от его природы.
Растворимость твердых веществ в жидкостях определяется природой веществ и, как правило, существенно зависит от температуры; сведения о растворимости твердых тел целиком основаны на опытных данных. Качественным обобщением экспериментальных данных по растворимости является принцип "подобное в подобном": полярные растворители хорошо растворяют полярные вещества и плохо – неполярные, и наоборот.
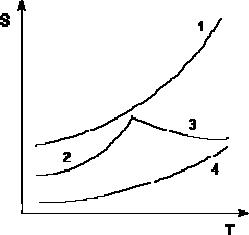
Кривые растворимости некоторых солей в воде.
1 – КNО3, 2 – Nа2SО4·10Н2О, 3 – Nа2SО4, 4 – Ва(NО3)2
Зависимость растворимости S от температуры обычно изображают графически в виде кривых растворимости. Поскольку теплота растворения твердых веществ в жидкостях может быть как положительной, так и отрицательной, растворимость при увеличении температуры может увеличиваться либо уменьшаться (согласно принципу Ле Шателье).
Растворимость газов в жидкостях зависит от ряда факторов: при-
роды газа и жидкости, давления, температуры, концентрации растворенных в жидкости веществ (особенно сильно влияет на растворимость газов концентрация электролитов).
Наибольшее влияние на растворимость газов в жидкостях оказывает природа веществ. Так, в 1 литре воды при t = 18 °С и P = 1 атм. растворяется 0,017 л. азота, 748,8 л. аммиака или 427,8 л. хлороводорода. Аномально высокая растворимость газов в жидкостях обычно обусловливается их
специфическим взаимодействием с растворителем – образованием химического соединения (для аммиака) или диссоциацией в растворе на ионы (для хлороводорода). Газы, молекулы которых неполярны, растворяются, как правило, лучше в неполярных жидкостях – и наоборот. Зависимость растворимости газов от давления выражается законом Генри – Дальтона:
Растворимость газа в жидкости прямо пропорциональна его давлению над жидкостью.
С=kP
Здесь С – концентрация раствора газа в жидкости, k – коэффициент пропорциональности, зависящий от природы газа. Закон Генри – Дальтона справедлив только для разбавленных растворов при малых давлениях, когда газы можно считать идеальными. Газы, способные к специфическому взаимодействию с растворителем, данному закону не подчиняются.
Растворимость газов в жидкостях существенно зависит от темпера-
туры;
Как правило, при растворении газа в жидкости выделяется теплота (∆Н0298 < 0), поэтому с повышением температуры растворимость уменьшается.
Существуют следующие способы выражения состава (концентрации) растворов:
Массовая доля растворенного вещества (ω). Массовая доля раство-
ренного вещества ω – отношение массы растворенного вещества к массе раствора (можно в процентах). Доля раствора, состоящего из растворенного вещества и растворителя
ω (Х) = |
m(X) |
, |
m(X) +m(S) |
где ω (Х) − массовая доля растворенного вещества; m(X)− масса растворенного вещества X; m(S) − масса растворителя S. Если известно, что для ка- ких-то целей употребляется 10%-ный раствор вещества А, то это означает, что в ста граммах такого раствора содержится 10 граммов растворенного вещества. Если масса раствора больше или меньше 100 граммов, массу растворенного вещества легко определить, пользуясь уравнением. Единицы измерения: %, доли единицы.
Молярная концентрация (С). Молярная концентрация − отношение количества растворенного вещества к объему раствора , моль/дм3 (моль/л) :
С(Х) = |
n(Х) |
= |
m(X) |
, |
|
V |
M(X)V |
||||
|
|
|
где С(Х) − молярная концентрация растворенного вещества Х, моль/л; n (Х) − количество растворенного вещества Х, моль; V − объем раствора, л; m − масса растворенного вещества; М(Х) − молярная масса

вещества.
Молярная концентрация определяется числом молей растворенного вещества, содержащихся в 1 литре раствора. Так, 0,1 М раствор − это раствор, в одном литре которого содержится 0,1 моля растворенного вещества. Единицы измерения: моль/л. Обозначение 0,1 М эквивалентно обозначению 0,1 моль/л. Растворы, содержащие доли молей в 1 л раствора, то есть 0,1, 0,01 и 0,001, называются соответственно децимолярный, сантимолярный, миллимолярный. Концентрация вещества в растворе, как и плотность раствора, − интенсивная величина, независимо от количества раствора соотношение между компонентами раствора и его плотность остаются постоянными, количество растворенного вещества в растворе зависит от концентрации и от количества раствора.
Молярная концентрация эквивалента (нормальная) С( fэкв(Х)Х) или С( Z1 Х). Молярная концентрация эквивалента (нормальная) – отношение коли-
чества вещества эквивалента (в моль-эквивалентах) к объему раствора (в л), моль/л:
С( |
1 |
Х) = |
n(1/ ZX) |
= |
m( X ) |
, |
|
M (1/ZХ )V |
|||||||
Z |
V |
||||||
|
|
|
|
|
где С (1/ZХ) – нормальная концентрация; n(1/Z X) – количество вещества
эквивалента, моль; V – объем раствора, л; m(X) – масса растворенного вещества; М(1/ZХ) – молярная масса эквивалента. Молярная масса эквивалента вещества М(1/ZХ) равна произведению фактора эквивалентности fэкв(Х) на мо-
лярную массу вещества Х. М(1/ZХ) = fэкв(Х) М(Х) = М(Х)1/ZХ.
Нормальная концентрация определяется числом молярных масс эквивалентов растворенного вещества, содержащихся в 1 литре раствора. Раствор, содержащий 1 моль эквивалентов вещества Х в 1 л раствора, называют нормальным раствором этого вещества. Единицы измерения − моль/л, нормальную концентрацию можно обозначать − н., например, 1н. раствор NаОН.
Если взаимодействуют растворы веществ с известными нормальными концентрациями, для которых
С(1/ZХ) = nV(1(/ХZХ) ) ; n(1/ZХ) = С(1/ZХ) V(X);
C(1/ZУ) = n(1/ZY ) ; n(1/ZУ)= С(1/ZУ) V(У),
V (Y )
то справедливы соотношения:
n(1/ZХ) = n(1/ZУ), С(1/ZХ) V(Х) = С(1/ZУ) V(У).
Если произведение нормальной концентрации на объем для обоих растворов будет одинаковым, то растворенные вещества прореагируют в эквивалентных количествах.
Молярная доля растворенного вещества (N). Молярная доля – отношение количества растворенного вещества к суммарному количеству вещества в растворе:
