
Курс лекций Ашуйко
.pdf
образованием осадков нерастворимых гидроксидов могут гидролизоваться соли алюминия, хрома (III), железа (III). В большинстве случаев совместного гидролиза образуются не гидроксиды, а основные соли, растворимость которых иногда меньше, чем гидроксидов. Например, растворимость гидрокарбоната меди (II) (СuОН)2СО3 меньше, чем гидроксида меди Сu(ОН)2 (II), поэтому конечным продуктом совместного гидролиза карбоната натрия и сульфата меди будет основная соль и диоксид углерода. Однозначно продукты совместного гидролиза предугадать трудно.
Особенности гидролиза кислых и основных солей. При рассмотрении гидролиза кислых и основных солей в водных растворах следует учитывать следующие процессы:
а) диссоциацию соли в водном растворе, которая протекает практически нацело, α ≈1;
б) диссоциацию сложных ионов (гидро - или гидроксо-), которая протекает в незначительной степени;
с) гидролиз гидроили гидроксоионов.
Например, рассмотрим процессы, происходящие в водном растворе
гидрокарбоната натрия. |
|
Процесс а) NaНСО3= Na+ + НСО3–, |
α 1; |
Процесс б) НСО3– Н+ + СО32– , |
К = 4,7 10–11; |
Процесс с) НСО3– + Н2О Н2СО3 + ОН–, |
К = 2,2 10–8. |
Процесс (а) определяет концентрацию исходных гидролизующихся ионов, она равна концентрации соли.
Процессы (б) и (с) определяют равновесные концентрации Н+ и ОН–. Сравнивая их, можно определить характер среды. Гидрокарбонат-ион диссоциирует с образованием ионов водорода (процесс б), гидролиз этого же иона (процесс с) происходит с образованием ионов ОН–. Процессы диссоциации и гидролиза конкурируют.
Сравним константы равновесия процессов (б) и (с). Константа равновесия процесса (б) равна 4,7 10–11, это − константа диссоциации угольной ки-
слоты по второй ступени. |
|
|
|
|
10−14 |
|
|
Кгидр. НСО− |
= |
|
Кw |
= |
= 2,2 10–8. |
||
К1дис.Н2 СО3 |
4,5 10−7 |
||||||
3 |
|
|
|
||||
Поскольку константа гидролиза больше константы равновесия диссо- |
|||||||
циации НСО3− , то степень гидролиза |
|
|
|
||||
|
β = |
Кгидp. / |
СНСО3− |
|
|||
больше степени диссоциации НСО3− :
α = 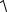 Кдисс.2 Н2 СО3 / СНСО3− .
Кдисс.2 Н2 СО3 / СНСО3− .
Следовательно, процесс (с) идет глубже, чем (б), и поэтому ионов ОН–, образовавшихся в растворе за счет гидролиза, будет больше, чем ионов Н+, образовавшихся за счет диссоциации НСО3− . рН раствора NaНСО3 > 7, так как
характер среды определяется процессом гидролиза.
Рассмотрим процесс взаимодействия с водой кислой соли дигидрофосфата натрия.
В растворе NaH2PO4 имеют место процессы: |
|
а) NaH2PO4 = Na+ + H2PO–4, |
α 1; |
б) Н2РО4– Н+ + Н2РО42–, |
К2дис.Н3 РО4 = 6,3 10–8; |
с) Н2РО4– + Н2О Н3РО4 + ОН–, |
Кгидр. = 1,3 10–12. |
Процесс (а) протекает практически нацело и определяет концентрацию ионов Na+ и H2PO4– гидролизующейся соли. За счет процесса (б) в растворе образуются ионы водорода, а за счет процесса (с) − ионы ОН–. Из сравнения приведенных констант равновесия процессов (б) и (с) следует, чтоКгидр. = 1,3
10–12<< К2дис.Н3 РО4 = 6,3 10–8. Это дает основание считать, что определяющим характер среды в растворе является процесс диссоциации гидроаниона (процесс б). Среда в растворе соли − слабокислая.
КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ
Комплексные соединения представляют собой соединения высшего порядка, состоящие из атома элемента в определенном валентном состоянии, связанного с несколькими молекулами или ионами, и способные к существованию в твердой, жидкой, газовой фазах.
СТРУКТУРА КОМПЛЕКСНЫХ СОЕДИНЕНИЙ
Комплексное соединение состоит из центрального атома (иона) – комплексообразователя, связанного с ионами или нейтральными молекулами, которые называются лигандами. Суммарное число лигандов, связанных с центральным атомом, характеризуется координационным числом (КЧ). Наиболее распространенные значения КЧ – 2, 4, 6.
Комплексообразователь и лиганды образуют внутреннюю сферу комплексного соединения, которую в формулах заключают в квадратные скобки. Ионы, компенсирующие заряд внутренней сферы, составляют внешнюю ко-
ординационную сферу.
Комплексообразователями могут быть как нейтральные, так и заряженные частицы (ионы). Чаще всего, это – катионы d-, f-металлов, иногда р- элементов.
Роль лигандов также выполняют как нейтральные, так и заряженные частицы. Наиболее распространены: H2O, NH3, CO, CN-, OH-, F-, Cl- и др.
Комплексообразователи являются акцепторами донорных пар лигандов. В зависимости от того, сколько электронных пар донирует лиганд во внутреннюю координационную сферу комплекса, различают монодентантные и полидентантные лиганды.
Координационное число зависит:
от природы центрального атома; заряда комплексообразователя; условия образования комплексов.
Например, в хлориде тетраамминцинка [Zn(NH3)4]Cl2 имеется комплексный ион [Zn(NH3)4]2+, а внешняя координационная сфера представлена хло- рид-ионом; катион Zn2+ – комплексообразователь, молекулы NH3 – лиганды, координационное число - 4. Так как заряд внутренней координационной сферы >0, комплексная частица представляет собой комплексный катион.
Гексафтороферрат K3[FeF6] имеет комплексный ион [FeF6]3–, катион Fe3+ – комплексообразователь, внешняя координационная сфера представлена катионом калия, ионы F–– лиганды, координационное число – 6. Так как, заряд внутренней координационной сферы <0, то комплексная частица представляет со-
бой комплексный анион.
Гексакарбонил хрома [Cr(CO)6] – нейтральное комплексное соедине-
ние, внешней сферы не имеет.
НОМЕНКЛАТУРА КОМПЛЕКСНЫХ СОЕДИНЕНИЙ
В комплексном ионе вначале перечисляют лиганды, а затем называют комплексообразователь. Если в состав комплексного соединения входят различные лиганды, вначале называют нейтральные молекулы, а затем – ионы с добавлением окончания -о.
Нейтральные |
|
|
|
|
|
Ионы |
|
молекулы |
|
|
|
|
|
|
|
аква- (H2O) |
циано- (CN–) |
|
гидроксо- (OH–) |
аммин- (NH3) |
фторо- (F–) |
|
нитрито- (NO2–) |
карбонил- (CO) |
хлоро- (Cl–) |
|
родано- (NCS–) |
нитрозил- (NO) |
йодо- (I–) |
|
тиосульфато- (S2O32–) |
|
|
|
|
Число лигандов указывается числовой приставкой: ди- (2), три- (3), тет-
ра- (4), пента- (5), гекса- (6).
Для катионных и нейтральных комплексов используют обычное название металла с указанием степени окисления. Например:
[Co(H2O)6]SO4 – сульфат гексааквакобальта (II); [Ni(NH3)2Cl2] – диамминдихлороникель (II).
Для анионных комплексов к латинскому названию металла добавляют
суффикс -ат: аргентат (серебро), аурат (золото), купрат (медь), феррат (железо), плюмбат (свинец), станнат (олово), меркурат (ртуть). Например:
K3[Fe(CN)6] – гексацианоферрат (III) калия; Na3[Ag(S2O3)2] – дитиосульфатоаргентат натрия.
ДИССОЦИАЦИЯ КОМПЛЕКСНЫХ СОЕДИНЕНИЙ В ВОДНЫХ РАСТВОРАХ
Комплексные соединения, в состав которых входят комплексные ионы, называются комплексными электролитами. Связь между комплексным ионом и внешней сферой – ионная. Следовательно, диссоциация на ионы внешней координационной сферы и комплексные ионы (первичная диссоциация) протекает практически полностью. Например:
[Ni(NH3)4]Cl2→ [Ni(NH3)4]2+ + 2Cl–; α =1 K4[Fe(CN)6] → 4K+ +[Fe(CN)6]4–; α =1
У комплексных неэлектролитов внешняя координационная сфера отсутствует. Примером комплексного неэлектролита является [Co(NH3)2Br2].
Диссоциация комплексного иона (вторичная диссоциация) протекает аналогично диссоциации слабых электролитов. Лиганды связаны с комплексообразователями ковалентной связью, поэтому диссоциируют в незначительной степени. Вторичная диссоциация комплексных соединений протекает ступенчато, процессы диссоциации равновесны, подчиняются закону действующих масс и количественно характеризуются константами диссоциации, которые называют константами нестойкости.
Произведение ступенчатых констант нестойкости равно общей константе нестойкости: Kн = Kн1 · Kн2 · Kн3 · Kн4 · …
Например, для комплексного иона [HgI4]2– ступенчатую диссоциацию можно проиллюстрировать следующими уравнениями:
2– |
– |
|
|
– |
|
|
|
|
|
С |
|
− С |
I |
- |
|
|
|
|
|
–3 |
|
|||
|
|
, Kн1 |
|
|
|
|
[HgI3 ] |
|
|
|
|
|
|
|
10 |
|
||||||||
[HgI4] |
↔ [HgI3] + I |
= |
|
|
|
|
|
|
|
|
|
= 5,9 |
|
; |
||||||||||
|
|
C |
|
|
]2− |
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
[HgI |
4 |
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
– |
– |
– |
, Kн2 1 |
|
|
|
|
С[HgI2 |
|
] |
CI- |
|
|
|
|
10 |
– |
|||||||
[HgI3] ↔ [HgI2] + I |
|
= |
|
|
|
|
|
|
|
|
|
|
= 1,66 |
|
||||||||||
|
|
|
C[HgI3 ]− |
|
|
|
|
|||||||||||||||||
4; |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
– |
+ |
– |
, Kн3 = |
|
С[HgI]+ CI- |
|
|
|
|
10 |
–11 |
|
|
|||||||||||
[HgI2] ↔ [HgI] + I |
|
|
|
|
|
|
|
|
|
= 1,1 |
|
; |
|
|||||||||||
|
|
C[HgI2 ] |
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
[HgI]+ ↔ Hg2+ + I–, Кн 4 = |
СHg 2+ CI- |
|
|
= 1,35 10–13; |
|
|
||||||||||||||||||
|
|
|
|
|
||||||||||||||||||||
|
|
|
|
|
|
|
|
C[HgI]+ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|||

[HgI4]2– Hg2+ + 4I–, Kн = |
С |
2+ C |
4- |
= 1,5 10–30. |
|
Hg |
|
I |
|||
C |
|
2− |
|||
|
[HgI4 ] |
|
|
|
|
Константы нестойкости зависят от природы комплексного иона и от температуры. Их значения приведены в таблицах справочной литературы.
Процесс образования комплексной частицы характеризуется величи-
ной, обратной Kн, называемой константой устойчивости: |
Kу = |
1 |
. |
|
|||
|
|
KН |
|
Константа нестойкости связана с изменением энергии Гиббса уравне-
нием:
∆GT0 = –RTlnKн.
ПОЛУЧЕНИЕ КОМПЛЕКСНЫХ СОЕДИНЕНИЙ
Реакции комплексообразования можно рассматривать как процесс образования устойчивой молекулярной частицы, связь в которой осуществляется по донорно-акцепторному механизму.
Al2(SO4)3 + 12NaOH→2Na3[Al(OH)6] + 3Na2SO4 CuSO4 + 4NH3 →[Cu(NH3)4]SO4
Процессы комплексообразования часто используются для перевода труднорастворимого соединения в раствор. Осадок AgCl в насыщенном растворе хлорида серебра постепенно исчезает, если к нему добавить избыток раствора хлорида калия:
AgCl + 2KCl → K[AgCl2]
ПРИМЕР 1. Вычислить концентрацию ионов цинка в растворе тетрацианоцинката натрия с концентрацией 0,3 моль/л при избытке цианидионов, равном 0,01 моль/л.
Решение. Первичная диссоциация комплексного соединения протекает практически полностью:
Na2[Zn(CN)4] → 2Na+ +[Zn(CN)4]2–.
Cуммарный процесс вторичной диссоциации комплексного иона:
[Zn(CN)4]2– Zn2+ + 4CN–.
Запишем для этого процесса выражение константы химического равновесия, оно равно константе нестойкости [Zn(CN)4]2–:
Kн = СZn 2 + CCN4 - , где Kн = 2,4 10–20 (из таблицы).
C[Zn(CN)4 ]2−
Поскольку концентрация цианид-ионов, образующихся в результате диссоциации комплексного иона, значительно меньше концентрации вве-

денного избытка, можно считать, что CCN − в равновесной системе равна 0,01 моль/л, т. е. концентрацией цианид-ионов, образующихся в результате диссоциации комплексного иона, можно пренебречь. Подставив известные из условия задачи значения, получаем:
СZn 2+ = 2,4 10−20 0,3 = 7,2 10–13 моль/л. (0,01)4
Комплексные частицы при определенных условиях могут разрушаться. Такими условиями могут быть нагревание, изменение рН растворов, добавление различных реагентов, которые либо приведут к образованию новых более устойчивых комплексов, либо будут разрушать комплекс за счет образования малорастворимых электролитов, либо приведут к окислитель- но-восстановительному процессу с участием комплексов.
ПРИМЕР 2. При какой концентрации ионов хлора начнет выпадать осадок AgCl из 0,1 М раствора [Ag(NH3)2]NO3, содержащего 1 моль аммиака в 1 л раствора?
Решение. Образование осадка AgCl возможно при условии, что произведение концентраций, образующих осадок ионов Ag+ и Cl–, превышает значение произведения растворимости AgCl:
ПСAgCl > ПРAgCl или СAg + СCl − > ПРAgCl.
Отсюда СCl − > ПРAgCl .
CAg+
Ионы Ag+ образуются в растворе за счет диссоциации комплексного иона: [Ag(NH3)2]+ Ag+ + 2NH3.
Равновесную концентрацию ионов серебра обозначим СAg + , равновесная концентрация аммиака, образующаяся при диссоциации комплексного иона, будет в два раза больше и составит 2СAg + , равновесная концентрация комплексного иона – 0,1 – СAg + , так как исходная концентрация комплексных ионов совпадает с исходной концентрацией раствора комплексной соли.
Поскольку концентрация молекул аммиака, образующихся в результате диссоциации комплексного иона, значительно меньше концентрации избыточного аммиака, содержащегося в растворе комплексной соли, можно считать, что CNH 3 = 1 моль/л, т. е. концентрацией молекул аммиака, обра-
зующихся в результате диссоциации комплексного иона, пренебрегаем. Подставив значение CNH 3 в выражение Kн, получим значение СAg + :
Kн = |
CAg+ CNH2 |
3 |
, или 9,31 10–8 = |
CAg+ 12 |
= |
CAg+ |
. |
||
C |
|
+ |
0,1 |
0,1 |
|||||
|
|
|
|
|
|||||
|
[Ag(NH3 )2 |
] |
|
|
|
|
|
|
|
Откуда CAg+ = 9,31 10–9моль/л.
СCl − > |
ПР |
> |
1,56 10−10 |
= 1,68 10–2 моль/л. |
|||
C |
Ag |
+ |
|
9,31 10−9 |
|||
|
|
|
|
||||
|
|
|
|
|
|
|
|
При концентрации хлорид-ионов больше 1,68 10–2 моль/л из раствора комплексной соли начнет выпадать осадок AgCl.
ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ
Классификацию химических реакций можно проводить по разным признакам.
По числу и составу исходных веществ и продуктов реакции различают:
CO2 + Na2O → Na2CO3; 2Fe(OH)3 → Fe2O3 + 3H2O;
AgNO3 + KCl → AgCl + KNO3;
Cu(NO3)2+ Zn→ Cu + Zn(NO3)2.
Кроме того, реакции можно разделить на два типа: реакции без изменения степени окисления и реакции с изменением степени окисления.
Реакции, в которых происходит изменение степеней окисления атомов элементов, входящих в состав реагирующих соединений, называются окис-
лительно-восстановительными (ОВР):
Степень окисления элемента – это условный заряд его атомов в соединении, вычисленный исходя из предположения, что данное соединение состоит только из заряженных частиц – одноатомных ионов.
В простых веществах степень окисления элемента принимается равной
нулю (Cu0, Cl 02 , H 02 , P 04 и т.д.).
Степень окисления данного элемента в его соединениях может выражаться как положительными, так и отрицательными числами, не только целыми, но и дробными. При этом для любого соединения алгебраическая сум-
ма произведений степеней окисления элементов на число их атомов в молекуле (или структурной единице вещества) равна нулю.
Для подсчета степени окисления элемента в соединении пользуются следующими правилами:
1.Степень окисления элемента водорода считают равной +1 (за исключением водорода, входящего в состав гидридов типичных металлов, где она равна -1).
2.Степень окисления элемента кислорода во всех случаях, кроме его соединения с фтором, а также соединений, где имеются связанные между со-
бой атомы кислорода, равна -2. В соединения с фтором OF2, поскольку фтор является более электроотрицательным элементом, чем кислород, степень окисления кислорода +2. В соединениях, содержащих связанные между собой атомы кислорода, степень окисления кислорода иная; например, в пероксиде водорода Н2О2 она равна -1, а в супероксиде калия КО2 составляет -1/2.
3.Степень окисления элемента фтора во всех соединениях равна -1.
4.Степень окисления элементов Li, Na, K, Rb, Cs во всех их соединениях равна +1.
5.Степень окисления элементов Be, Mg, Ca, Sr, Ba в их соединениях
равна +2.
Используя приведенные выше правила, можно, на основании формулы вещества и известных степеней окисления всех составляющих его элементов, кроме одного, найти степень окисления последнего.
Покажем это на примере подсчета степени окисления в соединении
HNO3.
HNO3 – азотная кислота. В этом соединении известны степени окисления водорода +1 и кислорода -2. Степень окисления азота должна быть положительной (x).
Решаем уравнение: 1 + х + 3(-2) = 0; х = 5.
Следовательно, степень окисления азота в азотной кислоте H+N+5O 3−2
равна +5.
Высшая положительная степень окисления элемента, как правило,
соответствует номеру группы периодической системы, в которой находится данный элемент (K+, Mg+2, Al+3, P+5, S+6, Cr+6, Mn+7).
Исключение составляют элементы I группы побочной подгруппы (Cu+2, Ag+2, Au+3) и элементы VIII группы: благородные газы и элементы триад (Fe+6, Co+3, Ni+3 и другие расположенные под ними). Высшая степень окисления фтора равна 0.
Низшая степень окисления для металлов равна 0. У неметаллов низшая степень окисления отрицательна и, в большинстве случаев, равна разности чисел номера подгруппы элемента и восьми (число электронов во внеш-
ней оболочке инертных газов Ne, Ar и др.). Низшая степень окисления: Р-3 (5 - 8 = -3), Se-2 (6 - 8 = -2), I-1 (7 - 8 = -1).
Окислителями называют вещества (атомы, ионы), принимающие электроны. Степень окисления атома-окислителя понижается:
Cu+2 + 2e– → Cu0
O2 + 4e– → 2O–2
Восстановителями называют вещества (атомы, ионы), отдающие электроны. Степень окисления атома-восстановителя повышается:
Ca0 – 2e– → Ca+2
2I–1 – 2e– → I2
Важнейшими окислителями являются вещества, содержащие атомы в высшей степени окисления: KMnO4, K2Cr2O7, H2SO4(к), HNO3, PbO2, неметаллы в свободном состоянии (галогены, кислород, озон).
Важнейшими восстановителями – вещества, содержащие атомы в низшей степени окисления, KI, KBr, Na2S, NH3, металлы в свободном состоянии.:
Атомы в промежуточной степени окисления в зависимости от типа реакции и условий ее протекания могут быть окислителями или восстановите-
лями, т. е. проявляют окислительно-восстановительную двойственность. Например:
H2O2 – проявляет окислительно-восстановительную двойственность, является и окислителем, и восстановителем (степень окисления кислорода -1 – промежуточная);
Существует 2 метода расстановки коэффициентов в окислительновосстановительных реакциях:
метод ионно-электронный (метод полуреакций); метод электронного баланса (электронно-молекулярный).
Электронно-ионный баланс (метод полуреакций) – метод нахождения коэффициентов, в котором рассматривается обмен электронами между реальными частицами в растворе с учетом характера среды.
Для уравнивания кислорода в ионно-молекулярных полуреакциях используют молекулы H2O, катионы H+ в кислой среде, гидроксид-ионы OH– в щелочной среде.
Правило кислой среды: в ту часть полуреакции, где не хватает кислорода, на каждый недостающий кислород добавляется по одной молекуле H2O, а в противоположную часть – необходимое для уравнивания водорода число катионов H+.
Правило щелочной среды: в ту часть полуреакции, где не хватает кислорода, на каждый недостающий кислород добавляется по два гидроксидиона OH–, а в противоположную часть – необходимое для уравнивания водорода число молекул H2O.
В нейтральной среде в зависимости от продуктов реакции используется или правило кислой среды, или правило щелочной среды.
Рассмотрим пример расстановки коэффициентов этим методом для реакции:
KMnO4 + HCl →
1.Записывают схему реакции с указанием степеней окисления элементов
ивыделяют элементы, изменяющие свои степени окисления:
+1 +7 −2 |
+1 −1 +2 −1 |
+1 −1 |
0 |
+1 −2 |
K Mn O4 |
+ HCl → Mn Cl2 |
+ KCl +Cl2 |
+ H2 O . |
|
2. Приводят эту схему в ионно-молекулярной форме, чтобы определить реальные частицы, существующие в растворе:
K+ + MnO−4 + H+ +Cl− → Mn2+ + 2Cl− + K+ +Cl− + Cl2 + H2O .
3. Выделяют частицы, в состав которых входят элементы, изменяющие свои степени окисления:
MnO4− |
→ Mn2+ |
Cl− |
→Cl2 |
4. Чтобы получить полуреакции, следует соблюдать баланс по числу атомов каждого элемента. Поскольку в данном примере среда кислая, для уравнивания полуреакций пользуются правилом кислой среды. В первой полуреакции в правой части не хватает четыре атома кислорода, следовательно, в эту часть записывают четыре молекулы воды. Для баланса по водороду в

левую часть добавляют восемь катионов водорода. Во второй полуреакции уравнивают только число атомов хлора:
MnO4− +8H+ |
→ Mn2+ + 4H2O |
2Cl− |
→Cl2 |
5. Определяют суммарные заряды в левых и правых частях полуреакций и добавлением или вычитанием электронов уравнивают заряды:
MnO− +8H+ |
+5e− = Mn2+ + 4H O |
1442443 |
1442443 |
+7 |
+2 |
2Cl− −2e− = Cl |
|
{ |
{2 |
−2 |
0 |
|
|
6. Устанавливают дополнительные множители для окислителя и вос- |
|
становителя на основании того, что число электронов, отданных восстановителем, должно быть равно числу электронов, принятых окислителем:
MnO4− +8H+ +5e− = Mn2+ + 4H2O |
|
5 |
|
10 |
|
2 |
|
|
|
||||
2Cl− −2e− = Cl2 |
|
2 |
|
|
5 |
|
|
|
|
|
7. Первую полуреакцию умножают на два, вторую – на пять и складывают правые и левые части полуреакций, в результате чего получают суммарное ионно-молекулярное уравнение реакции:
MnO4− +8H+ +5e− = Mn2+ + 4H2O |
|
5 |
|
10 |
|
2 |
|
|
|
||||
2Cl− −2e− = Cl2 |
|
2 |
|
|
5 |
|
|
|
|
|
|||
|
|
|
|
2MnO−4 +16H+ +10Cl− = 2Mn2+ +8H2O +5Cl2
8. Записывают окончательное уравнение в молекулярной форме: 2KMnO-4 +16HCl = 2MnCl2 +8H2O +5Cl2 + 2KCl
На протекание ОВР могут оказывать влияние следующие факторы: а) концентрация окислителя; б) природа восстановителя; в) температура; г) характер среды (кислая, нейтральная или щелочная).
Окислительные свойства перманганата калия. При взаимодействии
KMnO4 с восстановителем образуются различные продукты восстановления в зависимости от кислотности среды в соответствии со следующей схемой:
|
|
|
|
|
|
кислая (H+) |
|
+2 |
|
|
|||
|
|
|
|
|
|
|
|
|
|
Mn2+ (MnSO ) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
4 |
|
|
|
|
|
|
|
|
нейтральная (H2O) |
бесцветный раствор |
||||||
− |
+7 |
Восста- |
+ среда |
|
|
+4 |
|
|
|
||||
MnO4 |
(KMnO4) + |
новитель |
|
|
|
|
|
|
MnO2 |
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
бурый осадок |
|
|
|
|
|
|
|
|
|
- |
|
|
MnO |
+6 |
|
) |
|
|
|
|
|
|
|
щелочная (OH ) |
2− (K MnO |
||||||
|
|
|
|
|
|
|
|
|
|
4 |
2 |
4 |
|
|
|
|
|
|
|
|
|
|
|
зеленый раствор |
|
|
|
Окислительные свойства дихромата и хромата калия. При восста-
новлении K2Cr2O7 и K2CrO4 cтепень окисления хрома понижается с +6 до +3 в соответствии с представленными ниже схемами:
