
- •Минобрнауки россии
- •Введение
- •Правила работы и поведения в лаборатории
- •Список необходимого оборудования
- •Порядок выполнения работ и оформления лабораторного журнала
- •Тема 1. Техника микроскопирования (1 ч)
- •Тема 2. Приготовление препаратов микроорганизмов прижизненное изучение микроорганизмов (1 ч)
- •Тема 3. Питательные среды, их приготовление, разливка. Получение элективных культур (1 ч)
- •Тема 4. Экология микроорганизмов. Основы санитарно-бактериологического анализа
- •1000 Л – х микробов
- •Критерии для санитарной оценки воздуха жилых помещений (число микроорганизмов в 1 м3 воздуха) по а.И.Шафиру
- •Тема 5. Получение чистых культур. Изучение особенностей микроорганизмов с целью их идентификации (4 ч)
- •Обнаружение волютина
- •Обнаружение гликогена и гранулезы
- •Тема 6. Изучение ветвящихся и образующих плодовые тела форм бактерий методом элективных культур
- •Тема 7. Трансформация микроорганизмами соединений азота
- •Изучение культуры
- •Закладка элективной культуры азотобактера
- •Изучение культуры
- •Закладка элективных культур первой и второй фаз нитрификации
- •Изучение первой фазы нитрификации
- •Изучение второй фазы нитрификации
- •Закладка элективной культуры
- •Изучение культуры
- •Тема 8. Участие микроорганизмов в круговороте углерода (3 ч)
- •Закладка элективной культуры
- •Изучение культуры
- •Закладка элективной культуры
- •Закладка элективной культуры тионовых серобактерий
- •Закладка элективной культуры десульфатирующих бактерий
- •Изучение культур
- •Рецепты некоторых красителей, индикаторов и растворов
- •Литература
Обнаружение волютина
Фиксированный мазок окрасить метиленовым синим. Волютиновые зерна окрашиваются в интенсивно синий, цитозоль – в голубой цвет.
Обнаружение гликогена и гранулезы
Приготовить препарат «раздавленная капля».
Окрасить раствором Люголя: гранулезу – стандартным; гликоген – более концентрированным.
Обнаружение жира
Каплю суспензии бактерий смешать с каплей 40-процентного формалина на предметном стекле.
Через 5 минут добавить каплю метиленового синего.
Через 10 минут добавить каплю судана III.
Микроскопировать под покровным стеклом. Цитоплазма приобретает синий цвет, капли жира – розовый.
Работа 21. Идентификация бактерий
Составить карту свойств бактерий, выделенных в чистой культуре, по форме:
-
Морфологические свойства
Культуральные свойства. Характеристика колоний.
Физиологические свойства
Форма, расположение, споры, капсулы.
Окраска по Граму, включения
Подвижность
Размер
Форма
Поверхность
Цвет
Край
Консистенция
Тип дыхания (по уколу в МПА)
Протеолитические свойства
Свертывание молока
Рост на картофеле
Пузырьки газа на МПБ
Наличие желатиназы
Провести идентификацию по Ленису. См. список литературы ().
Сверить точность определения по Берги.
Занести ход определения и характеристику вида в лабораторный журнал.
Тема 6. Изучение ветвящихся и образующих плодовые тела форм бактерий методом элективных культур
Работа 22. Миксобактерии
Оборудование: чашки Петри, колбы со стерильной дистиллированной водой, пипетка, пинцет, предметные стекла, спиртовка, петли, скальпель, препаровальные иглы, навозный агар, кроличий помет, однопроцентный раствор фуксина.
Ход работы
Закладка элективной культуры миксобактерий
Вскипятить 10 г свежего кроличьего помета в 0,1 л водопроводной воды, профильтровать через ватный фильтр.
К фильтрату добавить 0,5 г крахмала и 2 г агара. Разлить. Стерилизовать при 1 атм. 30 минут.
Навозный агар разлить в чашки Петри, соблюдая стерильность, дать застыть,
Заразить среду небольшим количеством кроличьего помета с помощью пинцета.
Выращивать при t = 25-28°C в течение 14 дней, увлажняя помет дистиллированной водой, чтобы избежать развития плесневых грибов.

Рис. 10. Плодовые тела и формы микроспор и вегетативных клеток некоторых миксобактерий
Изучение культуры
Для изучения характера роста скальпелем вырезать кусочек агара с колониями, nepeнести на предметное стекло, микроскопировать при малом увеличении (рис. 10).
Дли изучения морфологии клеток с колонии взять мазки, окрасить, микроскопмровать с иммерсионной системой, Под микроскопом видны палочковидные клетки и округлые микроцисты миксобактерий.
Проследить цикл развития миксобактерий (рис 11). Зарисовать наблюдаемые формы.
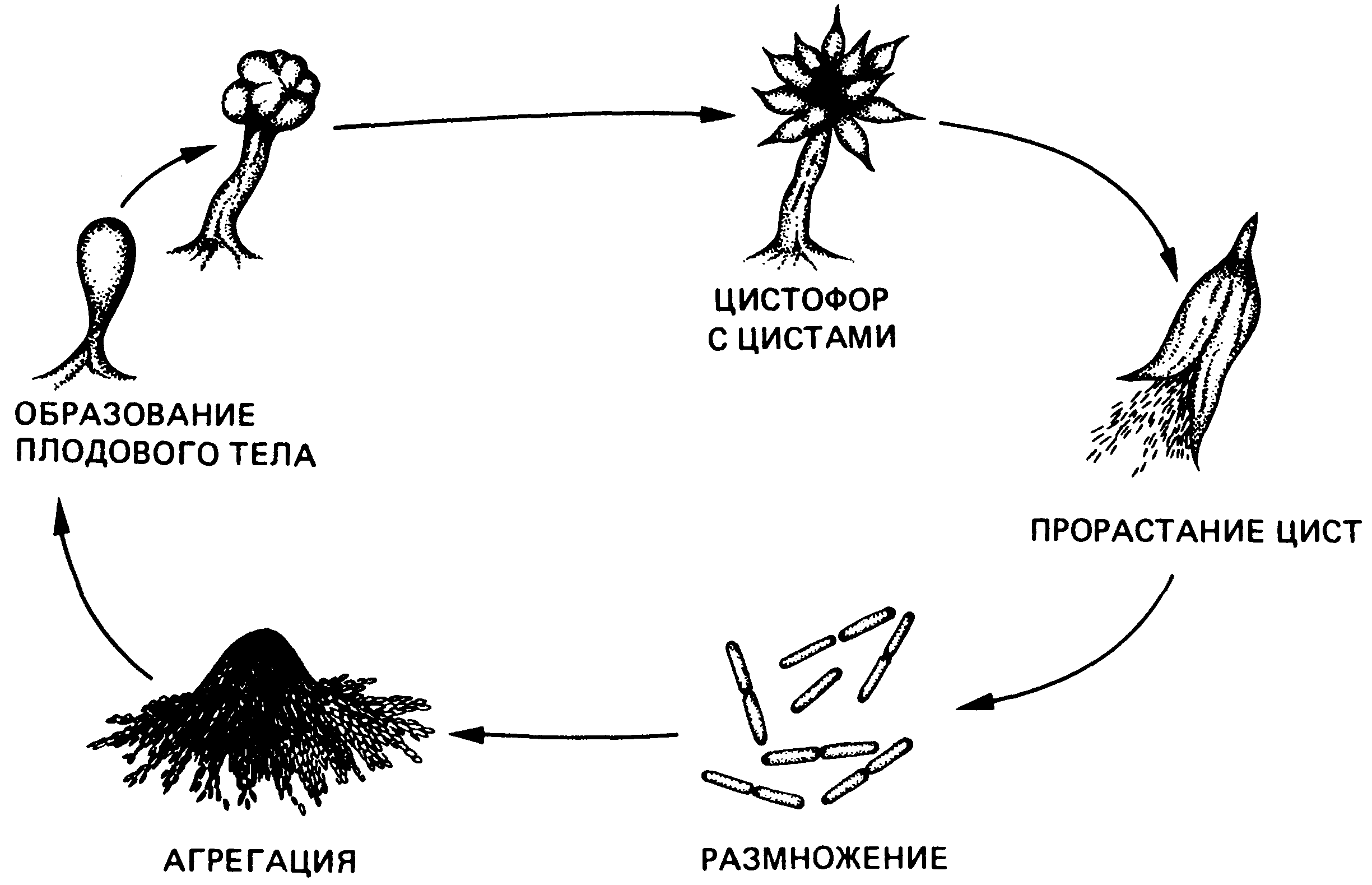
Рис. 11. Цикл развития миксобактерий
Работа 23. Микобактерии
Оборудование: спиртовка, петли, предметные стекла, кристаллизатор с подставкой, промывалка с водой, стерильный парафин, краситель (фуксин или генцианфиолет), стерильные конические колбы, гашетки. Для элективной минеральной среды: NН4 C1 - 0,05 г,К2НР04 - 0,05 г, MgSO4 - 0,02 г, СаСО3 - 0,02 г, воды- 100 мл, почва.
Ход работы
Закладка элективной культуры
1. Питательную среду стерилизовать при 1 атм. 20 минут, разлить в конические колбы слоем 1,5-2 см.
Пипеткой внести капли парафина, t
Заразить небольшим количеством почвы.
Выращивать в течение 2 недель при t = 28-30°С.
Изучение культуры

Рис. 12. Микобактреии
Диск парафина, переворачивая, перенести на предметное стекло.
Петлей снять с диска часть налета, приготовить мазок.
Фиксируют, окрашивают, микроскопируют с иммерсионной системой, отмечая разнообразия форм клеток.
Работа 24. Актиномицеты
Оборудование: стерильные чашки Петри, предметные и покровные стекла, препаровальные иглы, скальпель, почва, сито, 70-80-процснтная уксусная кислота, голодный агар, 60-процентный этанол со следами аммиака, однопроцентный фуксии, промывали с водой.
Ход работы
Закладка элективной культуры
Разлить голодный агар в чашки Петри
С помощью сита равномерно рассеять мелкозем по поверхности агаровой пластинки. Наиболее благоприятна навеска до 20 мг.
Проращивать культуру при t = 25-28°С в течение 8-10 суток.

Рис. 13. Мицелии: актиномицета(1) и гриба (2); 3 – Формы спороносцев у актиномицетов
Изучение культуры
Вырезать блоки агара с колониями, перенести на предметное стекло.
Микроскопировать при малом увеличении. На препарате различается светлый воздушный и субстратный мицелий, гифы-спороносцы (рис. 13).
Для изучения процесса спорообразования изготовить препарат «отпечаток», пользуясь иммерсионной системой.
Зарисовать наблюдаемые формы.
