
0250 / Педиатрия_Майданник
.pdf
|
|
|
|
|
|
Таблица 41 |
Схемы |
терапии |
инфекционного |
эндокардита, |
|||
вызванного грамположительными кокками |
||||||
|
|
|
|
|
|
|
|
|
|
|
Дли- |
|
|
Возбудитель |
|
Схема |
|
тель- |
|
Комментарии |
|
|
ность, |
|
|||
|
|
|
|
|
|
|
|
|
|
|
нед |
|
|
1 |
|
2 |
|
3 |
|
4 |
|
|
|
|
|
|
|
а-гемолитиче- |
1. Пенициллин G |
2 |
ские |
4 млн ЕД в/в |
|
(зеленящие) |
каждые 6 ч |
|
стрептококки; |
плюс |
|
Strep, bow's |
гентамицин |
|
|
1,0 мг/кг каждые |
|
|
12 ч в/в, ИЛИ |
|
|
2. Пенициллин G |
4 |
|
4 млн ЕД в/в |
|
|
каждые 6 ч |
|
плюс
гентамицин 1,0 мг/кг каждые
12 ч в/в (только первые две недели), ИЛИ
Стандартный режим для больных без почечной недостаточности, без патологии восьмой пары
черепных нервов или серьезных осложнений
Для пациентов с осложненным течением заболевания — например, с поражением ЦНС, шоком, умеренной устойчивостью стреп-
тококков к пенициллину, неэффективностью предыдущего
лечения
3. Пенициллин G |
4 |
Для пациентов с почечной |
4 млн ЕД в/в |
|
недостаточностью или с патоло- |
каждые 6 ч, |
|
гией восьмой пары черепных |
ИЛИ |
|
нервов |
4. Цефтриаксон |
4 |
Для пациентов с аллергией |
2 г в/в один |
|
к пенициллину |
раз в день, |
|
|
ИЛИ
|
5. Ванкомицин |
4 |
|
.10 мг/кг в/в |
|
|
каждые 12 ч |
|
Strop, fecaiis и |
1. Ампициллин |
4—6 |
другие устойчи- |
2 г в/в каждые |
|
вые к пеницил- |
4 ч плюс гента- |
|
лину стрепто- |
мицин 1,0 мг/кг |
|
кокки |
в/в каждые 8 ч, |
|
|
ИЛИ |
|
|
2. Ванкомицин |
4—6 |
|
15 мг/кг в/в |
|
|
каждые 12 ч |
|
|
плюс гентами- |
|
цин 1,0 мг/кг в/в (но не более 80 мг) каждые 8 ч
Для пациентов с аллергией к пенициллинам и цефалоспоринам
Должно быть достаточно 4 нед в большинстве случаев при
существовании симптомов менее 3 мес
Для пациентов с аллергией
к пенициллинам; 4 нед должно быть достаточно в большинстве случаев. Необходимо контролировать концентрацию в сыворотке
2 3 1
|
|
|
|
Окончание таблицы 41 |
|
|
|
|
|
1 |
2 |
3 |
4 |
|
|
|
|
|
|
Staph, aureus |
1. Нафциллин |
4 - 6 |
Стандартный режим |
|
|
1,5 г в/в каж- |
|
|
|
|
дые 4 ч, |
|
|
ι; |
|
ИЛИ |
|
|
|
|
2. Нафциллин |
4 - 6 |
Для пациентов с тяжелым диссе- |
|
|
в той же дозе |
|
минированным стафилококковым |
|
|
плюс гентами- |
|
поражением, синергизм может |
|
|
цин 1,0 |
мг/кг |
|
иметь преимущества на ранних |
|
в/в каждые 8 ч |
|
этапах лечения |
|
|
только первые |
|
|
|
|
3—5 дней, |
|
|
|
|
ИЛИ |
|
|
|
|
3. Цефазолин |
4 - 6 |
Для пациентов с аллергией |
|
|
2 г в/в каждые |
|
к пенициллинам |
|
|
8 ч, |
|
|
|
|
ИЛИ |
|
|
|
|
4. Ванкомицин |
4 - 6 |
Для пациентов с аллергией |
|
|
15 мг/кг |
в/в |
|
к пенициллинам и цефалоспо- |
|
каждые |
12'ч |
|
ринам; при наличии штаммов, |
|
|
|
|
устойчивых к метициллину |
Стрептококки |
1. Пенициллин G |
2 - 4 |
|
|
группы A, Strep. |
2 млн ЕД в/в |
|
|
|
Pneumoniae |
каждые 6 ч, |
|
|
|
|
ИЛИ |
|
|
|
|
2. Цефазолин |
2 ^ t |
|
|
|
1 г в/в каждые |
|
|
|
|
8 ч |
|
|
|
НАСЕК группа |
1. Ампициллин |
4 |
Гентамицин можно отменить, |
|
|
2 г в/в каждые |
|
если возбудитель полностью |
|
|
4 ч плюс гента- |
|
чувствителен к ампициллину |
|
|
мицин 1,0 мг/кг |
|
|
|
|
в/в каждые 12 ч |
|
|
|
|
2. Цефтриаксон |
4 |
Для пациентов с аллергией |
|
|
1—2 г в/в один |
|
на пенициллины; подходит для |
|
|
раз в день |
|
лечения дома после стабилиза- |
|
|
|
|
|
ции состояния в больнице |
|
|
|
|
|
ционном эндокардите, вызванном зеленящим стрептококком, оказывает комбинация пенициллина с аминогликозидами (гентамицин, тобрамицин, амикацин и др.), в частности с гентамицином в суточной дозе 7,5 мг на 1 кг массы больного каждые 8 часов. Это обусловлено синергическим: действием этих препаратов, что позволяет в ряде случаев сократить сроки антибактериальной терапии. При аллергии к пенициллину используется цефтриаксон в дозе 50—75 мг/кг в сутки — цефалоспорин 3-го поколения, который назначается лишь один раз в сутки. Препаратом резерва является ванкомицин, который назначают по 40 мг/кг в сутки в 4 приема внутривенно.
232
Отсутствие эффекта от антибактериальной терапии может быть связано со стафилококковой природой эндокардита. В этих случаях применяют пенициллиназоустойчивые пенициллины (метициллин или оксациллин по 200—400 мг/кг/сутки) или их комбинацию с аминогликозидами. Однако в последние годы появилось много штаммов стафилококков, продуцирующих бета-лактамазу, метициллинрезистентных штаммов золотистого стафилококка. Препаратами выбора в подобных наблюдениях являются нафциллин (по 150 мг/кг в сутки внутривенно в 4 приема), ванкомицин (по 40 мг/кг в сутки в 4 приема внутривенно) или имипенем (по 50 мг/кг в сутки в 4 приема внутривенно).
При энтерококковом эндокардите, развивающемся, как правило, после вмешательств на желудочно-кишечном тракте или мочеполовых путях, в связи с неэффективностью цефалоспоринов чаще используют ампициллин (по 25 мг/кг каждые 6 ч) или ванкомицин в сочетании с аминогликозидами.
Большие трудности связаны с лечением больных инфекционным эндокардитом, возбудителями которого являются грамотрицательная флора, кишечная палочка, протей, синегнойная палочка и др. Это всегда неблагополучный фон, хроническая тяжелая патология (сахарный диабет, болезни крови и т.д.), предшествующая терапия стероидами, цитостатиками и др. В лечении инфекционного эндокардита в подобных случаях назначают цефалоспорины 2-го и 3-го поколения (цефотаксим, цефтриаксон), ампициллин, карбенициллин в сочетании с аминогликозидами. Используют большие дозировки для длительного (в течение 4—6 недель) парентерального введения.
Лечение антибактериальными препаратами продолжается в течение 4—6 недель, а иногда антибактериальная терапия продлевается до 8 недель и более. Ее продолжают и после нормализации температуры до стойкого улучшения состояния, ликвидации проявлений васкулитов, повторных отрицательных анализов на гемокультуру. При недостаточной антибактериальной терапии рецидив клинических проявлений с лихорадкой отмечается обычно в течение 1—2 недель после прекращения лечения. Такие клинические ситуации требуют повторного курса антибиотиков, при этом приходится либо увеличивать дозы уже применяемых средств, либо производить замену препаратов.
В лечении используют другие средства с антибактериальными свойствами, например диоксидин 60—100 мл внутривенно капельно. Вводится по показаниям антистафилококковая плазма, антистафилококковый глобулин и др.
В комплексной терапии ИЭ используются нестероидные противовоспалительные препараты (диклофенак натрия по 2—3 мг/кг в сутки, индометацин по 2—2,5 мг/кг в сутки). При выраженных иммунологических проявлениях (тяжелое течение гломерулонефрита, миокардит) и недостаточном влиянии на эти процессы антибиотикотерапии на определенных этапах болезни присоединяют глкжокортикоиды (преднизолон по 0,5—1 мг/кг в сутки). Это позволяет уменьшить проявления нефротического синдрома, сердечной, почечной недостаточности. В зависимости от изменений иммунного статуса к лечению подключают имму-
233
нокорригирующие средства (тимоген, Т-активин и др.); антигистаминные препараты (супрастин, тавегил).
В зависимости от органной патологии и клинических проявлений проводится комплексная терапия левожелудочковой сердечной недостаточности (нужно только помнить, что применение сердечных гликозидов может быть опасным из-за отрыва вегетации), тромбоэмболических осложнений (гепарин по 100—200 ЕД/кг парентерально под контролем свертываемости крови); назначаются гипотензивные средства, препараты железа и т.д.
Определенную помошь в лечении инфекционного эндокардита, особенно при сложностях с антибактериальной терапией, оказывают немедикаментозные методы лечения — аутотрансфузии ультрафиолетом облученной крови (АУФОК), плазмаферез. На фоне АУФОК достигается антисептический эффект, коррекция микроциркуляторных, иммунологических нарушений. Плазмаферез особенно показан при выраженном интоксикационном синдроме, аутоиммунных процессах с увеличением циркулирующих иммунных комплексов, а также при гемореологических расстройствах, обусловленных преимущественно плазменными факторами гемостаза.
При отсутствии эффекта от медикаментозной терапии следует использовать возможности хирургических методов лечения, которые все шире применяются в последние годы и к которым существуют определенные показания. Прежде всего это нарастающая сердечная недостаточность при грубых клапанных дефектах, рефрактерная к лекарственной терапии; прогрессирующая сердечная недостаточность на фоне длительно не контролируемой инфекции (как правило, при грамотрицательной флоре и грибах). Хирургическое лечение показано также при рецидивирующем тромбоэмболическом синдроме; при больших и очень подвижных вегетациях на клапанах (по заключению ЭхоКГ); абсцессах миокарда и клапанного кольца; при повторных ранних рецидивах инфекционного эндокардита.
Хирургическое лечение обычно состоит из удаления инфицированного нативного клапана и установки клапанного протеза. Для выполнения операции замещения клапана при инфекционном эндокардите необходимо наличие четких показаний, так как протезы клапанов приводят к значительному снижению трудоспособности в отдаленном периоде. Однако, если хирургическое вмешательство показано, его не следует откладывать, потому что состояние больного может резко ухудшиться. Протезирование клапана может оказаться успешным даже в случаях, когда продолжительность антибактериальной терапии была слишком малой для уничтожения возбудителя. К другим процедурам относятся иссечение вегетации, вальвулопластика, реконструкция клапана и закрытие полости абсцесса.
ПРОФИЛАКТИКА. Огромное значение при инфекционном эндокардите имеют профилактические мероприятия. Любые очаги инфекции требуют тщательной и полной санации. Это касается прежде всего больных с приобретенными и врожденными пороками сердца; больных, перенесших инфекционный эндокардит. Все хирургические вмешатель-
234
ства или манипуляции, которые могут привести к бактериемии, должны проводиться по строгим медицинским показаниям, а при необходимости их выполнения (экстракции зубов, тонзиллэктомия, гинекологические операции и др.) должны сопровождаться антибактериальной терапией до и после операции. Выбор антибиотика осуществляется эмпирически на основании предполагаемой инфекции (табл. 42). Например, при стоматологических вмешательствах рекомендуется превентивное одноразовое введение 50 мг/кг массы больного (обычно 0,75—2 г) амоксициллина за 1 час до операции и половинную дозу через 6 ч. При операциях на желудочно-кишечном тракте или урологических вмешательствах, где при бактериемии чаще выявляется энтерококк, рекомендуется за 0,5—1 час до вмешательства введение внутримышечно 50 мг/кг (не более 2 г) ампициллина и 1,5—2 мг/кг гентамицина. При невозможности провести парентеральную терапию может быть использован амоксициллин внутрь за 1 час до и через 6 часов после операции.
|
|
Таблица 42 |
Режимы профилактики инфекционного эндокардита |
||
|
|
|
Стандартный |
При стоматологических вме- |
Амоксициллин 3,0 г внутрь за |
режим |
шательствах; операциях на |
1 ч до, затем 1,5 г через 6 ч |
|
органах полости рта, верхних |
|
|
дыхательных путях; |
|
|
небольших манипуляциях |
|
|
на желудочно-кишечном |
|
|
и мочеполовом трактах |
|
|
|
|
Специальные |
Пероральный режим для |
Клиндамицин 300 мг внутрь |
режимы |
пациентов с аллергией |
за 1 ч до, затем 150 мг через |
|
к пенициллину (только при |
6 ч |
|
вмешательствах на полости |
|
|
рта и дыхательных путях) |
|
|
|
|
|
Парентеральный режим для |
Ампициллин 2,0 г в/м или в/в |
|
пациентов высокого риска; |
плюс гентамицин 1,5 мг/кг |
|
то же при вмешательствах |
в/м или в/в за 0,5 ч до |
|
на желудочно-кишечном |
|
|
и мочеполовом трактах |
|
|
|
|
|
Парентеральный режим |
Ванкомицин 1,0 г в/в мед- |
|
для пациентов с аллергией |
ленно в течение 1 ч, начиная |
|
к пенициллину |
за 1 ч до; добавить гентами- |
|
|
цин 1,5 мг/кг в/м или в/в |
|
|
при вовлечении желудочно- |
|
|
кишечного или мочеполового |
|
|
тракта |
|
|
|
|
Операции на сердце, включая |
Цефазолин 2,0 г в/в в момент |
|
протезирование клапанов |
дачи наркоза, с повторением |
|
|
через 8 и 16 ч или ванкоми- |
|
|
цин 1,0 г в/в медленно |
|
|
в течение одного часа, начи- |
|
|
ная с момента дачи наркоза, |
|
|
затем по 0,5 г в/в через 8 и |
|
|
16 ч |
|
|
|
2 3 5
КАРДИОМИОПАТИИ
Термин «кардиомиопатия» впервые был использован в 1957 году для обозначения группы заболеваний миокарда неизвестной этиологии. В 1972 году было дано следующее определение кардиомиопатий: «Кардиомиопатия — это острое, подострое или хроническое поражение сердечной мышцы неизвестной или неясной этиологии, часто сочетающееся с поражением эндокарда, иногда и перикарда». Это определение принято экспертами ВОЗ как основополагающее. Эта патология не вызвана ревматизмом, кардитом, диффузными заболеваниями соединительной ткани, хотя в последние десятилетия ряд авторов выделяют первичные и вторичные (или симптоматические) кардиомиопатий, которые являются атрибутом ряда заболеваний: при нарушении обмена веществ (гликогеноз, гемохроматоз, парфериновая болезнь), эндокринопатиях (микседема), при нейромышечных дистрофиях, токсических состояниях (наркомания и др.).
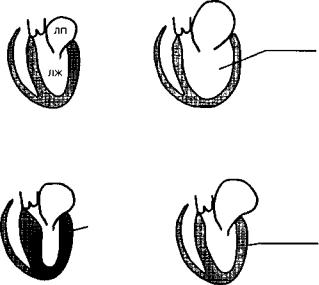
Согласно классификации ВОЗ, кардиомиопатий классифицируют по ведущим гемодинамическим или анатомическим признакам. В соответствии с этим различают три формы кардиомиопатий: 1) дилатационную (или застойную); 2) гипертрофическую; 3) рестриктивную (рис. 28).
ДИЛАТАЦИОННАЯ КАРДИОМИОПАТИЯ - это тяжелое заболевание миокарда, характеризующееся расширением полостей сердца, снижением его сократительной способности, развитием сердечной недоста-
Дилатация ЛЖ с минимальной
гипертрофией
Норма |
Дилатационная |
|
кардиомиопатия |
Гипертрофия ЛЖ (с асимметричной гипертрофией перегородки)
Инфильтрация, или фиброз
Гипертрофическая |
Рестрикгивная |
кардиомиопатия |
кардиомиопатия |
Рис. 28. Анатомические изменения при кардиомиопатиях: ЛП — левое предсердие; ЛЖ — левый желудочек
236

точности, нарушением ритма сердца, тромбоэмболиями. Диагноз дилатационной кардиомиопатии устанавливают при наличии дилатации и систолической дисфункции левого желудочка и отсутствии врожденных пороков сердца, коронарной, клапанной или перикардиальной патологии, а также поражения сердца при гипертензии.
ЭПИДЕМИОЛОГИЯ. Действительная распространенность дилатационной кардиомиопатии не установлена в связи с недостаточной изученностью заболевания. Эпидемиологические данные о дилатаиионной кардиомиопатии свидетельствуют о том, что ее распространенность в разных странах мира составляет от 1 до 10 случаев на 100 000 населения.
ЭТИОЛОГИЯ. Наиболее вероятным представляется наличие нескольких специфических причин данного состояния. Дилатационная кардиомиопатия может носить семейный или предположительно генетический характер.
Семейная форма дилатационной кардиомиопатии встречается редко, составляя 6—9% всех случаев заболевания. Описаны случаи аутосом- но-доминантного и рецессивного наследования, а также известна форма заболевания, сцепленная с Х-хромосомой. При картировании генов (рис. 29) у больных дилатационной кардиомиопатией с нарушениями функции проводимости дефектные гены выявлены в коротком плече хромосомы 3 (Зр25-р22) и в хромосоме 1 (lpl-ql), а при «чистой» форме
Хромосома! |
Хромосома 3 |
Хромосома! |
Хромосома 9 |
Хромосомах |
Хромосомах |
Зр25-р22
А |
Б |
Рис. 29. Картирование генов у больных с дилатационной кардиомиопатией:
А— при аутосомно-доминантном наследовании с сопутствующими дефектами;
Б— при аутосомно-доминантном наследовании (без других дефектов);
В— при Х-сцепленном наследовании
237
заболевания — в хромосомах 1 (Iq32) и 9 (9ql3-q22). В случае Х-сцеп- ленной формы (рис. 26) дилатационной кардиомиопатии мутантный ген локализуется в коротком плече Х-хро.мосомы (Хр21) или на длинном плече Х-хромосомы—Xq28 (при синдроме Барта).
Установлена связь с антигенами системы HLA: частота встречаемости HLA-B27, HLA-A2, HLA-DR4 и HLA-DQ4 больше, чем в контрольной группе, а частота встречаемости HLA-DRw6 меньше, чем в контроле. Связь со специфическими антигенами HLA при дилатационной кардиомиопатии свидетельствует о возможной иммунологической основе этого заболевания. Однако указанные конкретные антигены системы HLA встречаются менее чем у 50% пациентов с дилатационной кардиомиопатией. Гетерогенность этих антигенов не позволяет определить место расположения гена, предположительно обуславливающего заболевание.
Развитие дилатационной кардиомиопатии связывают с воздействием вирусов (Коксаки ВЗ, вирус энцефаломиокардита, аденовирусы, вирус эпидемического паротита, краснухи и др.), дефицитом потребления селена, наследственным дефицитом карнитина и бета-кетолазы, с применением антрациклиновых противоопухолевых препаратов (дауномицин, адриамицин) и некоторых других лекарственных препаратов (сульфаниламиды, левомицетин и др.).
Дилатация сердца может возникнуть при некоторых системных заболеваниях соединительной ткани (СКВ, ЮРА, болезнь Кавасаки и др.), при эндокринных заболеваниях (тиреотоксикоз, сахарный диабет, катехоламиновая кардиомиопатия, гипотиреоидизм и др.), миопатиях, мукополисахаридозах, гемолитико-уремическом синдроме, синдроме Рейс и др. Особое место занимает дилатационная кардиомиопатия, связанная с синдромом Барта (мышечная гипотония, пропорциональная задержка роста, нейтропения), при котором установлен Х-сцепленный тип наследования
слокализацией мутантного гена на длинном плече Х-хромосомы—(Xq28)
инарушение обмена органических кислот (3-метилглутаконовая ацидурия). Следовательно, дилатационную кардиомиопатию можно диагностировать лишь после исключения других причин дилатации сердца.
ПАТОГЕНЕЗ. В некоторых случаях при дилатационной кардиомиопатии ведущую роль могут играть иммунные механизмы. Выявлен ряд нарушений иммунной регуляции, включая гуморальную и клеточную аутоиммунную реактивность по отношению к миоцитам, снижение клеточной активности естественных киллеров и нарушение деятельности супрессорных клеток. Однако эти нарушения выявляются не у всех больных, причем некоторые из них имеют место также при других заболеваниях сердца.
Считают также, что в случаях вирусного миокардита может запускаться цепь аутоиммунных реакций, приводящих к повреждению миокарда и, в конце концов, к развитию дилатационной кардиомиопатии. Наличие нарушений иммунной регуляции и множества антимиокардиальных антител при дилатационной кардиомиопатии согласуется с этой гипотезой. Однако, как правило, не удается выделить инфицирующий вирус или выявить наличие вирусных антигенов в миокарде у больных.
Первичным патофизиологическим нарушением при дилатационной кардиомиопатии является снижение сократимости миокарда (рис. 30).
238
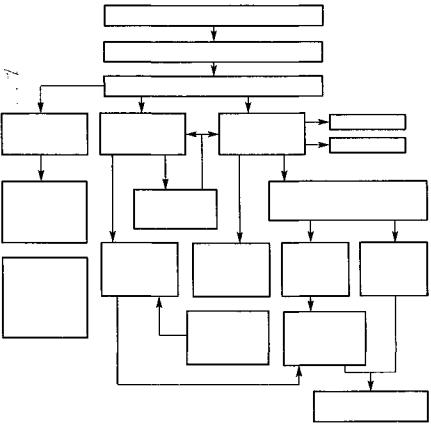
Это приводит к уменьшению фракции выброса левого желудочка, увеличению его конечно-диастолического объема и развитию типичных патофизиологических изменений, характерных для сердечной недостаточности любой этиологии.
При дилатационной кардиомиопатии значительные изменения происходят в миокардиальном комплексе: адренергический рецептор-G-npo- теин-аденилатциклаза. В случае тяжелой сердечной недостаточности имеет место уменьшение плотности β1-адренергических рецепторов на 61—70%. Плотность миокардиальных β2-ρευεπτοροΒ при данном заболевании не изменяется, но ответ на воздействие бета-агонистов несколько снижается (приблизительно на 30%) вследствие разобщения их деятельности. При сердечной недостаточности отмечается также увеличение (на 30—40%) активности ингибиторного Gj-протеина, что может быть причиной разобщения механизма работы β2-рецептора. Функциональная ак-
Увеличение
нагрузки
желудочка
Перегрузка
легких:
диспное
ортопное
Системная
перегрузка:
отеки
асцит
набухание яремных вен
Повреждение миоцитов
Снижение сократимости миокарда
Уменьшение ударного объема
Дилатация |
Уменьшение |
Усталость |
|||
левого |
фракции |
|
Слабость |
||
желудочка |
выброса ЛЖ |
||||
|
|
Повышение активности |
|||
Митральная |
|
симпатического |
|||
регургитация |
|
звена ВНС |
|||
Механизм |
Активация |
Увеличе- |
|
||
системы |
Увеличение |
||||
Франка— |
ние сокра- |
||||
ренин— |
ЧСС |
||||
Стерлинга |
тимости |
||||
ангиотензин |
|
||||
|
|
|
|
||
|
Повышение |
|
Повышение |
|
|
|
альдостерона |
|
ударного |
|
|
|
и ОЦК |
|
объема |
|
|
Падение буфера фракции выброса
Рис. 30. Схема патогенеза дилатационной кардиомиопатии: ОЦК. — объем циркулирующей крови;
ЛЖ — левый желудочек; ЧСС — частота сердечных сокращений
239
тивность Gs-протеина, Н2-гистаминовых рецепторов, М2-мускариновых рецепторов, альфа-рецепторов и аденилатциклазы при дилатационной кардиомиопатии значительно не изменяется. Остальные механизмы, участвующие в сократимости, также не затронуты, включая плотность мест связывания антагонистов кальция, уровни сократительных белков и активность креатинкиназы.
Основной морфологической характеристикой дилатационной кардиомиопатии является дилатация камер сердца. Увеличиваются общая масса сердца, его мышечная масса и объем миоцитов, но увеличения толщины стенки левого желудочка обычно не наблюдается вследствие выраженной дилатации полости желудочка. Характерным признаком дилатационной кардиомиопатии при микроскопическом исследовании является выраженная гипертрофия миоцитов с очень большими, неправильной формы ядрами. Также заметна атрофия миоцитов и потеря миофиламентов. Данные морфологические изменения не коррелируют с тяжестью заболевания. Ультраструктурная патология в виде нарушений в строении митохондрий, расширения Т-трубочек и внутриклеточного образования липидных капель может наблюдаться при дилатационной кардиомиопатии, но может обнаруживаться также при других формах заболевания сердца. Возможно образование интерстициальных паренхиматозных и периваскулярных фокальных инфильтратов из мелких лимфоцитов без признаков повреждения соседних миоцитов. При дилатационной кардиомиопатии почти всегда имеет место фиброз.
КЛИНИКА. Дилатационная кардиомиопатия диагностируется сравнительно легко, поскольку характеризуется достаточно яркой клинической картиной. Довольно трудно выявить лишь начало заболевания, так как некоторое время дилатационное поражение сердца протекает бессимптомно. Заболевают дети всех возрастных групп, в том числе грудного возраста.
Болезнь развивается, как правило, исподволь, однако иногда симптомы появляются внезапно. Ребенок становится раздражительным, теряет аппетит, у него появляется кашель вследствие застоя в сосудах малого круга кровообращения.
Постепенно развиваются признаки сердечной недостаточности: одышка при небольшой физической нагрузке, приступы удушья. Больных беспокоит сердцебиение, перебои. В начальной стадии заболевания преобладают симптомы левожелудочковой недостаточности, в дальнейшем застойные явления развиваются и в большом круге кровообращения.
Сердце значительно увеличено, особенно левый желудочек, поэтому, как правило, наблюдается смещение границ относительной тупости во все стороны. Часто определяется патологическая пульсация в прекардиальной области. Пульс частый (но иногда может быть и брадикардия за счет преходящей или стойкой полной поперечной блокады), выявляются различные нарушения сердечного ритма (экстрасистолия, мерцательная аритмия).
Тоны сердца ослаблены, может быть раздвоение I тона при блокаде ножек пучка Гиса. Появляется ритм галопа, III тон, систолический шум над верхушкой или у нижнего края грудины, обусловленный относи-
240
