
- •Биологически важные гидроксикислоты.
- •Моносахариды
- •Химические свойства.
- •Получение реактивов Гриньяра]
- •Физические и химические свойства
- •Получение и применение
- •Механизм
- •Основный катализ
- •Кислотный катализ
- •Номенклатура
- •Классификация
- •3. Ангидриды и кетены
- •4. Амиды
- •5. Нитрилы
- •6. Сложные эфиры
- •Реакции моносахаридов в открытой форме
- •Реакции моносахаридов в циклической форме
- •Брожение моносахаридов
- •Галогенангидриды карбоновых кислот
- •Используя приведенные выше доводы, оцените относительное сродство к электрофилам бензола, пиррола, фурана и тиофена.
- •Используя приведенные выше доводы, оцените относительное сродство к электрофилам бензола, пиррола, фурана и тиофена.
Используя приведенные выше доводы, оцените относительное сродство к электрофилам бензола, пиррола, фурана и тиофена.
Отличительной чертой рассматриваемых гетероциклических систем является то обстоятельство, что они, в отличие, например, от бензола, могут быть представлены только одной, преобладающей резонансной структурой, в которой нет разделения заряда. Это находится в соответствии с экспериментально полученными величинами теплот сгорания этих соединений, свидетельствующими о меньшей ароматичности, то есть менее эффективной делокализации кратных связей в этих соединениях по сравнению с бензолом. Кроме того, учитывая, что электроотрицательность гетероатома возрастает в следующей последовательности сера < азота < кислорода, можно сказать, что в этой же последовательности уменьшается способность гетероатома отдавать свою неподеленную пару электронов, а, следовательно, и ароматичность гетероциклов.
Поскольку пара электронов гетероатома в большой степени делокализована по p-системе гетероцикла, пиррол является значительно более слабым N-основанием, чем обычные амины. Протонирование пиррола осуществляется преимущественно по a-углеродному атому с образованием неароматического соединения. Образующийся катион атакует другую молекулу пиррола, в результате чего происходит полимеризация.

Фуран и его производные бурно реагирует с сильными, кислотами, при проведении же реакции с разбавленной минеральной кислотой происходит гидролитическое расщепление цикла с образованием 1,4-дикарбонильных соединений с хорошим выходом.
![]()
Тиофен намного более устойчив в кислых средах, чем пиррол и фуран. При взаимодействии его с борфторидом триметилоксония (исключительно активным алкилирующим реагентом) образуется соль S-метилтиофения. Стабильность этой соли связана, очевидно, с тем, что одна из пар электронов атома серы остается вовлеченной в сопряженную p-систему, что сохраняет ароматичность последней.

31.2
ИНДOЛ (бензо[b]пиррол),
мол. м. 117,18; бесцв. кристаллы со
слабым запахом нафталина;
т. пл. 52,5 °С, т. кип. 254 °С; d456 1,0718;
возгоняется при нагр. до 150°С; m 7,03.10-30 Кл.м
(бензол,
25 °С); перегоняется с парами воды,диэтилового
эфира и
NH3;
хорошо раств. в орг. р-рителях, горячей воде,
жидком NH3. Молекула имеет
плоскую конфигурацию.
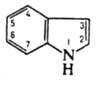 Индол
- слабое основание (рКа —2,4).
При протонировании образует катион 3H-индолия
(ф-ла I), к-рый при взаимод. с
нейтральной молекулой индол
дает димер (II).
Индол
- слабое основание (рКа —2,4).
При протонировании образует катион 3H-индолия
(ф-ла I), к-рый при взаимод. с
нейтральной молекулой индол
дает димер (II).
 Как
слабая к-та (рKа 17),
индол с Na в жидком NH3 образует
N-натрийиндол, с КОН при 130°С - N-калийиндол.
Обладает ароматич. св-вами. Электроф.
замещение идет гл. обр. в положение
3. Нитрование обычно
осуществляется бензоилнитратом, сульфирование -
пиридинсульфотриоксидом, бромирование -
диоксандибромидом, хлорирование -
SO2Cl2, алкилирование -
активными алкилгалогенидами. Ацетилирование в
уксусной к-те также идет в положение 3,
в присут. CH3COONa
- в положение 1; в уксусном
ангидриде образуется
1,3-диацетилиндол. Индол легко присоединяется
по двойной
связи a,b-непредельных
кетонов и нитрилов,
напр.:
Как
слабая к-та (рKа 17),
индол с Na в жидком NH3 образует
N-натрийиндол, с КОН при 130°С - N-калийиндол.
Обладает ароматич. св-вами. Электроф.
замещение идет гл. обр. в положение
3. Нитрование обычно
осуществляется бензоилнитратом, сульфирование -
пиридинсульфотриоксидом, бромирование -
диоксандибромидом, хлорирование -
SO2Cl2, алкилирование -
активными алкилгалогенидами. Ацетилирование в
уксусной к-те также идет в положение 3,
в присут. CH3COONa
- в положение 1; в уксусном
ангидриде образуется
1,3-диацетилиндол. Индол легко присоединяется
по двойной
связи a,b-непредельных
кетонов и нитрилов,
напр.:
 Взаимод.
с альдегидами приводит
к образованию дииндолильных производных,
напр.:
Взаимод.
с альдегидами приводит
к образованию дииндолильных производных,
напр.:
 Аминометилирование (р-ция
Манниха) в мягких условиях протекает в
положение 1, в жестких - в положение 3.
Замещение в бензольное кольцо (преим.
в положения 4 и 6) идет лишь в кислых
средах при блокированном положении 3.
В присут. Н2О2, надкислот или
на свету индол окисляется в индоксил,
к-рый затем превращ. в тример или индиго.
Более жесткое окисление под
действием О3,
МnО2 приводит
к разрыву пиррольного кольца с образованием
2-формамидобензальдегида.
При гидрировании индола водородом в
мягких условиях восстанавливается
пиррольное кольцо, в более жестких - и
бензольное, напр.:
Аминометилирование (р-ция
Манниха) в мягких условиях протекает в
положение 1, в жестких - в положение 3.
Замещение в бензольное кольцо (преим.
в положения 4 и 6) идет лишь в кислых
средах при блокированном положении 3.
В присут. Н2О2, надкислот или
на свету индол окисляется в индоксил,
к-рый затем превращ. в тример или индиго.
Более жесткое окисление под
действием О3,
МnО2 приводит
к разрыву пиррольного кольца с образованием
2-формамидобензальдегида.
При гидрировании индола водородом в
мягких условиях восстанавливается
пиррольное кольцо, в более жестких - и
бензольное, напр.:
 Индол
содержится в эфирных
маслах жасмина
и цитрусовых, входит в состав кам.-уг.
смолы. Кольцо индола - фрагмент молекул важных
прир. соединений
(напр., триптофана, серотонина, мелатонина, буфотенина). Обычно
индол выделяют из нафталиновой фракции
кам.-уг. смолы или
получают дегидрированием о-этиланилина
с послед.циклизацией образующегося
продукта. Индол и его производные
синтезируют также циклизацией арилгидразонов
карбонильных соед. (р-ция Фишера), взаимод.
ариламинов с a-галоген-
или a-гидроксикарбонильными
соед. (р-ция Бишлера) и др. Ядро
индола входит в состав индольных
алкалоидов.
Сам индол-фиксатор запаха в парфюмерии;
его производные используют в произ-ве
биологически активных соед. (гормонов,
галюциногенов) и лек. ср-в
(напр.,индопана, индометацина).
Индол
содержится в эфирных
маслах жасмина
и цитрусовых, входит в состав кам.-уг.
смолы. Кольцо индола - фрагмент молекул важных
прир. соединений
(напр., триптофана, серотонина, мелатонина, буфотенина). Обычно
индол выделяют из нафталиновой фракции
кам.-уг. смолы или
получают дегидрированием о-этиланилина
с послед.циклизацией образующегося
продукта. Индол и его производные
синтезируют также циклизацией арилгидразонов
карбонильных соед. (р-ция Фишера), взаимод.
ариламинов с a-галоген-
или a-гидроксикарбонильными
соед. (р-ция Бишлера) и др. Ядро
индола входит в состав индольных
алкалоидов.
Сам индол-фиксатор запаха в парфюмерии;
его производные используют в произ-ве
биологически активных соед. (гормонов,
галюциногенов) и лек. ср-в
(напр.,индопана, индометацина).
32.1
Кижнера — Вольфа реакция, восстановление карбонильной группы (>С=О) в метиленовую (>СН2). Для этогоальдегид или кетон переводят в гидразон, который разлагают путём нагревания под давлением в присутствииоснований:
![]()
Кетон Гидразин Гидразон
Впоследствии стали часто пользоваться др. вариантом Кижнера - Вольфа реакции: альдегид или кетон, избытокгидразина и едкое кали нагревают в высококипящем растворителе (ди- или триэтиленгликоле) при 180—200 °С. Кижнера - Вольфа реакцию можно применять для восстановления карбонильных соединений, чувствительных ккислотам (ср. Клемменсена реакция). Метод разработали Н. М. Кижнер в 1911 и немецкий учёный Л. Вольф в 1912 (L. Wolff, 1857—1919).
Получение спиртов1. Получение этилового спирта (или винный спирт) путём брожения углеводов: C2H12O6 => C2H5-OH + CO2
Суть брожения заключается в том, что один из простейших сахаров - глюкоза, получаемый в технике из крахмала, под влиянием дрожжевых грибков распадается на этиловый спирт и углекислый газ. Установлено, что процесс брожения вызывают не сами микроорганизмы, а выделяемые ими вещества - зимазы. Для получения этилового спирта обычно используют растительное сырьё, богатое крахмалом: клубни картофеля, хлебные зёрна, зёрна риса и т.д.
2. Гидратация этилена в присутствии серной или фосфорной кислоты CH2=CH2 + KOH => C2H5-OH
3. При
реакции галогеналканов со щёлочью:
 4.
При реакции окисления алкенов
4.
При реакции окисления алкенов 5.
Гидролиз жиров: в этой реакции получается
всем известный спирт
- глицерин
5.
Гидролиз жиров: в этой реакции получается
всем известный спирт
- глицерин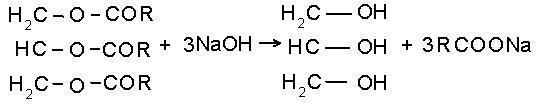 Кстати, глицерин входит
в состав многих косметических средств
как консервант и как средство,
предотвращающее замерзание и высыхание!
Кстати, глицерин входит
в состав многих косметических средств
как консервант и как средство,
предотвращающее замерзание и высыхание!
32.2
Химические свойства пиридина определяются наличием ароматической системы и атома азота с неподеленной электронной парой.
1. Основные свойства. Пиридин — более слабое основание, чем алифатические амины (Кb = 1,7.10-9). Его водный раствор окрашивает лакмус в синий цвет:

При взаимодействии пиридина с сильными кислотами образуются соли пиридиния:
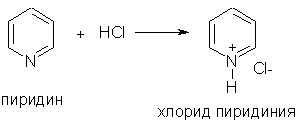
2. Ароматические свойства. Подобно бензолу, пиридин вступает в реакции электрофильного замещения, однако его активность в этих реакциях ниже, чем бензола, из-за большой электроотрицательности атома азота. Пиридин нитруется при 300 °С с низким выходом:

Атом азота в реакциях электрофильного замещения ведет себя как заместитель 2-го рода, поэтому электрофильное замещение происходит в мета-положение.
В отличие от бензола, пиридин способен вступать в реакции нуклеофильного замещения, поскольку атом азота оттягивает на себя электронную плотность из ароматической системы, и орто-пара-положения по отношению к атому азота обеднены электронами. Так, пиридин может реагировать с амидом натрия, образуя смесь орто- и пара-аминопиридинов (реакция Чичибабина):

3. При гидрировании пиридина образуется пиперидин, который представляет собой циклический вторичный амин и является гораздо более сильным основанием, чем пиридин:

4. Гомологи пиридина по свойствам похожи на гомологи бензола. Так, при окислении боковых цепей образуются соответствующие карбоновые кислоты:

Никотиновая кислота и ее амид — важные лекарственные препараты
