
- •Биологически важные гидроксикислоты.
- •Моносахариды
- •Химические свойства.
- •Получение реактивов Гриньяра]
- •Физические и химические свойства
- •Получение и применение
- •Механизм
- •Основный катализ
- •Кислотный катализ
- •Номенклатура
- •Классификация
- •3. Ангидриды и кетены
- •4. Амиды
- •5. Нитрилы
- •6. Сложные эфиры
- •Реакции моносахаридов в открытой форме
- •Реакции моносахаридов в циклической форме
- •Брожение моносахаридов
- •Галогенангидриды карбоновых кислот
- •Используя приведенные выше доводы, оцените относительное сродство к электрофилам бензола, пиррола, фурана и тиофена.
- •Используя приведенные выше доводы, оцените относительное сродство к электрофилам бензола, пиррола, фурана и тиофена.
1.1
Механизм образования реагентов Гриньяра
В настоящее время не существует единого взгляда на общий механизм реакции. Хотя существует около 30-ти механизмов, наиболее принятым считается механизм Блонберга, Бодевидца и Бикельхаунта (для органических хлоридов).

ГРИНЬЯРА РЕАКЦИЯ,
синтез орг. соединений с применением
магнийорг. галогенидов RMgHal (реактивов
Гриньяра). Последние обычно получают
по р-ции: RHal + Mg -> RMgHal. При этом р-р RHal
в диэтиловом
эфире медленно
приперемешивании прибавляют
к суспензии Mg
в этом же р-рителе. Во мн. случаях (особенно
при работе с ArHal)магний активируют,
для чего в реакц. смесь добавляют I2,
BrCH2CH2Br
или С2Н5Вг.
Для синтеза RMgHal из СН2=СННа1
и ArCl вместо диэтилового
эфира применяют ТГФ или
др. циклич. эфиры, а также эфиры
ди-итриэтиленгликоля.
Из соед., содержащих подвижный атом Н
(ацетилены, пиррол, индол и
др.), реактив Гриньяра получают обменной
р-цией, напр.:
![]()
Активность RHal уменьшается в ряду: RI > RBr > RC1.
При получении реактива Гриньяра на практике применяют RBr, т.к. RC1 мало реакционноспособен, а р-ции с RI сопровождаются побочными процессами в большей степени, чем с бромидами. В случае вторичных и особенно третичных RI наблюдается отщепление HI с образованием олефина. Другая побочная р-ция, к-рая часто сопровождает синтез алкилмагнийгалогенидов,-образование углеводородов (р-ция Вюрца-Гриньяра): R'Hal + RMgHal -> R—R' + MgHal2. В присут. каталитич. кол-в солей переходных металлов образуется обычно R—R (р-ция Хараша).
Магнийорг. галогениды чрезвычайно
реакционноспо-собны. наиб. широко их
применяют в р-циях с соед., содержащими
поляризованную кратную
связь (напр.,
С=O, С![]() N,
C=S).
N,
C=S).
При взаимод. RMgHal
с формальдегидом, оксидом этилена или этиленхлоргидрином образуются
первичные спирты,
из др. альдегидов и формиатов (эфиров)-
вторичные, из кетонов, ангидридов, хлорангидридов и
сложных эфиров-третичные, напр.:
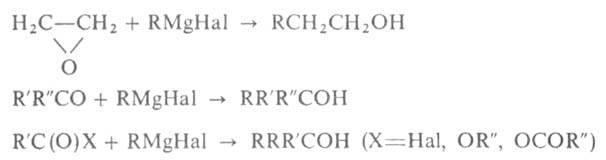
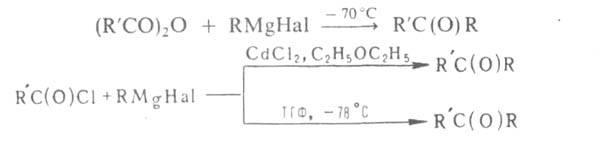
Р-цию RMgHal
с ангидридами и хлорангидридами в
спец. условиях используют для синтеза
кетонов, напр.:
Наиб. широко для
синтеза кетонов применяют амиды к-т
и нитрилы:
![]()
Кетоны образуются
также в Гриньяра реакции с
применением орто-угольных эфиров:
C(OR')4 +
RMgHal -> RRC(OR')2 ->
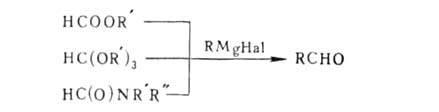
RC(O)R Удобный метод синтеза альдегидов-р-ции
с использованием ортомуравьиного эфира;
вместо него применяют также формиаты (эфиры
и соли)
и формамиды (обычно
N-метилформанилид):
1.2
Соединения этого класса являются достаточно простыми представителями природных соединений, они весьма часто встречаются в самых различных природных источниках. Гидроксиалкановые кислоты были выделены из ланолина, пчелиного воска, коры, корней, воскообразного слоя листьев, семян, бактерий и грибов. Наиболее часто встречаются б-гидроксикислоты, a в комбинации со сфингозинами животных и фитосфингозинами растений и Микроорганизмов они, очевидно, входят в состав всего живого.
В-гидроксикислоты играют важную роль в биосинтезе и катаболизме жирных кислот. Жирные кислоты с длинной цепью с одной и более гидроксильными группами обнаружены в жирах растительного и животного происхождения. В таких молекулах гидроксильные функции находятся, главным образом, на некотором расстоянии от карбоксильной группы.
Некоторые оксикислоты являются ключевыми соединениями на главных путях биосинтеза (глицериновая, мевалоновая, шикимовая, лимонная и др.), пантовая кислота входит в состав кофермента А (рис.1). Простейшая оксикислота гликолевая, НО-СН2-СООН, содержится в незрелом винограде, свекле, сахарном тростнике. Природная яблочная кислота, имеющая конфигурацию, содержится в кислых плодах, таких как незрелые яблоки, крыжовник, рябина, ревень. Лимонная кислота — важный продукт обмена веществ в живых организмах, некоторыми растениями накапливается в значительных количествах — в плодах цитрусовых — 6-8%, в листьях махорки — 8-14%, культуральными жидкостями некоторых бактерий — до 10%.
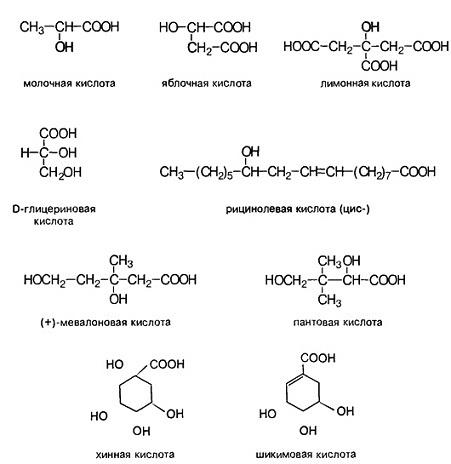 Рис.1.
Оксикислоты
Рис.1.
Оксикислоты
Классификация гидроксикислот построена по общему принципу классификации бифункциональных соединений — согласно взаимному расположению функциональных групп при углеродной цепи и количеству этих функциональных групп (рис.2). Очень многие природные гидроксикислоты имеют тривиальные названия, которые прочно укоренились в химической и биохимической практике.
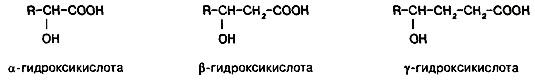 Рис.2.
Функциональные группы при углеродной
цепи
Рис.2.
Функциональные группы при углеродной
цепи
В структурном плане для этих соединений характерно появление молекулярного асимметрического центра, что позволяет присутствовать им в природных источниках в трех формах- -изомера, -изомера и -изомера. К примеру, молочная кислота образуется при молочнокислом брожении лактозы в виде рацемической смеси, тогда как в животном организме в результате гликолиза образуется -О-молочная кислота, которая накапливается в мышцах при интенсивной работе, вызывая характерную мышечную боль (рис.3).
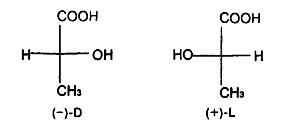 Рис.3.
Молочная кислота
Рис.3.
Молочная кислота
Биологически важные гидроксикислоты.
Гликолиевая кислота HOCH2COOH содержится во многих растениях, например, свекле и винограде.
Молочная кислота (соли лактаты) CH3CH(OH)COOH. Широко распространена в природе, является продуктом молочнокислого брожения углеводов. Содержит асимметрический атом углерода и существует в виде двух энантиомеров. В природе встречаются оба энантиомера молочной кислоты. При молочнокислом брожении образуется рацемическая D,L-молочная кислота. D-молочная (мясо-молочная) кислота образуется при восстановлении пировиногралной кислоты под действием кофермента НАД Н и накапливается в мышцах при интенсивной работе.
|
CH3COCOOH + НАД . Н + Н+ |
® |
СH3CH(OH)COOH + НАД+ |
|
Пировиноградная кислота |
|
D-Молочная кислота |
Яблочная кислота (соли малаты) HOOCCH(OH)CH2COOH Содержится в незрелых яблоках, рябине, фруктовых соках. Является ключевым соединением в цикле трикарбоновых кислот. В организме образуется путем гидратации фумаровой кислоты и далее окисляется коферментом НАД+ до щавелевоуксусной кислоты.
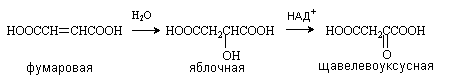
Винная кислота (соли тартраты) HOOCCH(OH)CH(OH)COOH. Содержит два хиральных центра и имеет 3 стереоизомера: D-винную кислоту, L-винную кислоту и оптически неактивную мезовинную кислоту (см. лек. №4). D-винная кислота содержится во многих растения, например, в винограде и рябине. При нагревании D-винной кислоты образуется рацемическая D,L-винная (виноградная) кислота. Мезовинная кислота образуется при кипячении других стереоизомеров в присутствии щелочи и при окислении малеиновой кислоты .
2.2
Общая формула жиров (триглицеридов)

Жиры – сложные эфиры глицерина и высших карбоновых кислот. Общее название таких соединений – триглицериды.
Животные жиры содержат главным образом глицериды предельных кислот и являются твердыми веществами. Растительные жиры, часто называемые маслами, содержат глицериды непредельных карбоновых кислот. Это, например, жидкие подсолнечное, конопляное и льняное масла.
Природные жиры содержат следующие жирные кислоты
|
Насыщенные: стеариновая (C17H35COOH) пальмитиновая (C15H31COOH) Масляная (C3H7COOH) |
В СОСТАВЕ ЖИВОТНЫХ ЖИРОВ |
|
Ненасыщенные: олеиновая (C17H33COOH, 1 двойная связь) линолевая (C17H31COOH, 2 двойные связи) линоленовая (C17H29COOH, 3 двойные связи) арахидоновая (C19H31COOH, 4 двойные связи, реже встречается) |
В СОСТАВЕ РАСТИТЕЛЬНЫХ ЖИРОВ |
Жиры содержатся во всех растениях и животных. Они представляют собой смеси полных сложных эфиров глицерина и не имеют чётко выраженной температуры плавления.
Физические свойства жиров
Животные жиры (бараний, свиной, говяжий и т.п.), как правило, являются твердыми веществами с невысокой температурой плавления (исключение – рыбий жир). В твёрдых жирах преобладают остаткинасыщенных кислот.
Растительные жиры – масла (подсолнечное, соевое, хлопковое и др.) – жидкости (исключение – кокосовое масло, масло какао-бобов). Масла содержат в основном остатки ненасыщенных (непредельных)кислот.
Химические свойства жиров
1. Гидролиз, или омыление, жиров происходит под действием воды, с участием ферментов или кислотных катализаторов (обратимо) , при этом образуются спирт - глицерин и смесь карбоновых кислот:
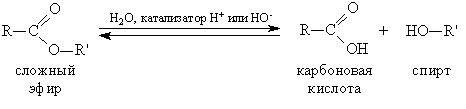
или щелочей (необратимо). При щелочном гидролизе образуются соли высших жирных кислот, называемые мылами. Мыла получаются при гидролизе жиров в присутствии щелочей:
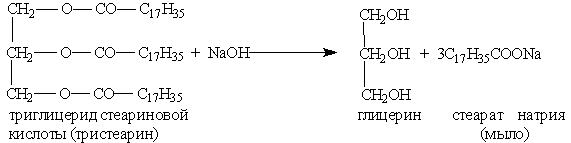
Мыла — это соли высших карбоновых кислот.
2.Гидрирование жиров – превращение жидких растительных масел в твердые жиры – имеет большое значение для пищевых целей. Продукт гидрогенизации масел – твердый жир (искусственное сало, саломас). Маргарин – пищевой жир, состоит из смеси гидрогенизированных масел (подсолнечного, кукурузного, хлопкого и др.), животных жиров, молока и вкусовых добавок (соли, сахара, витаминов и др.).
Так в промышленности получают маргарин:
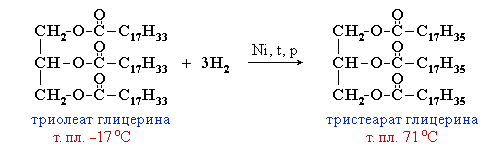
В условиях процесса гидрогенизации масел (высокая температура, металлический катализатор) происходит изомеризация части кислотных остатков, содержащих цис-связи С=С, в более устойчивые транс-изомеры. Повышенное содержание в маргарине (особенно, в дешевых сортах) остатков транс-ненасыщенных кислот увеличивает опасность атеросклероза, сердечно-сосудистых и других заболеваний.
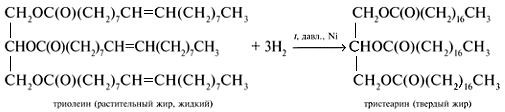
Реакция получения жиров (этерификация)
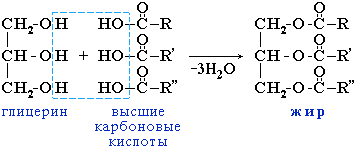
Жиры – одна из основных групп веществ, входящих, наряду с белками и углеводами, в состав всех растительных и животных клеток. В организме животных различают запасные и плазматические жиры. Запасные жиры откладываются в подкожной клетчатке и в сальниках и являются источником энергии. Плазматические жиры структурно связаны с белками и углеводами и входят в состав большинства мембран. Жиры обладают высокой энергетической ценностью: при полном окислении в живом организме 1 г жира выделяется 37,7 кДж, что в два раза больше, чем при окислении 1 г белка или углевода. Благодаря низкой теплопроводности жиры играют важную роль в теплорегуляции животных организмов, предохраняя животных, особенно морских, от переохлаждения. Вследствие своей эластичности жирыиграют защитную роль в коже позвоночных и в наружном скелете насекомых. Жиры – необходимая составная часть пищи. Норма потребления взрослым человеком – 80-100 г/сут.
3.2
Гетероциклические соединения — органические соединения, содержащие в своих молекулах циклы, в образовании которых принимают участие неуглеродные атомы (гетероатомы). Гетероциклические соединения классифицируют по числу атомов в цикле и по типу гетероатома. В данной главе мы рассмотрим только некоторые азотсодержащие гетероциклы, производные которых имеют важное биохимическое значение.
Шестичленные гетероциклы
Пиридин C5H5N - простейший шестичленный ароматический гетероцикл с одним атомом азота. Его можно рассматривать как аналог бензола, в котором одна группа СН заменена на атом азота:
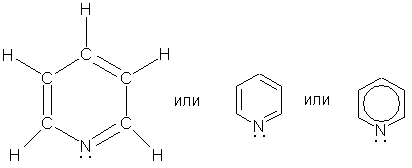
Строение. По электронному строению пиридин напоминает бензол. Все атомы углерода и атом азота находятся в состоянии sp2-гибридизации. Шесть электронов (по одному от каждого атома), находящихся на негибридных орбиталях, образуют p-электронную ароматическую систему. Из трех гибридных орбиталей атома азота две вступают в образование σ-связей C-N, а третья содержит неподеленную пару электронов .
Физические свойства. Пиридин — бесцветная жидкость, немного легче воды, с характерным неприятным запахом; с водой смешивается в любых отношениях.
Получение. Пиридин выделяют из каменноугольной смолы, в которой его содержание 0,08%. В лабораторных условиях пиридин можно синтезировать из синильной кислоты и ацетилена:
2HC≡CH + HC≡N ![]() C5H5N.
C5H5N.
Химические свойства пиридина определяются наличием ароматической системы и атома азота с неподеленной электронной парой.
1. Основные свойства. Пиридин — более слабое основание, чем алифатические амины (Кb = 1,7.10-9). Его водный раствор окрашивает лакмус в синий цвет:
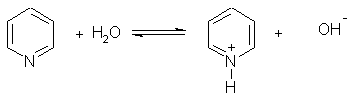
При взаимодействии пиридина с сильными кислотами образуются соли пиридиния:

2. Ароматические свойства. Подобно бензолу, пиридин вступает в реакции электрофильного замещения, однако его активность в этих реакциях ниже, чем бензола, из-за большой электроотрицательности атома азота. Пиридин нитруется при 300 °С с низким выходом:
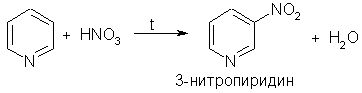
Атом азота в реакциях электрофильного замещения ведет себя как заместитель 2-го рода, поэтому электрофильное замещение происходит в мета-положение.
В отличие от бензола, пиридин способен вступать в реакции нуклеофильного замещения, поскольку атом азота оттягивает на себя электронную плотность из ароматической системы, и орто-пара-положения по отношению к атому азота обеднены электронами. Так, пиридин может реагировать с амидом натрия, образуя смесь орто- и пара-аминопиридинов (реакция Чичибабина):

3. При гидрировании пиридина образуется пиперидин, который представляет собой циклический вторичный амин и является гораздо более сильным основанием, чем пиридин:
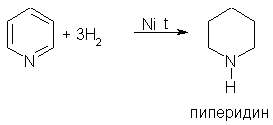
4. Гомологи пиридина по свойствам похожи на гомологи бензола. Так, при окислении боковых цепей образуются соответствующие карбоновые кислоты:
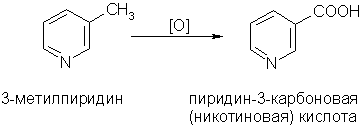
Никотиновая кислота и ее амид — важные лекарственные препараты
4.1
ДИКАРБОНИЛЬНЫЕ
СОЕДИНЕНИЯ,
орг. соед., содержащие в молекуле две
карбонильные группы С=О. К ним относятся
диальдегиды, дикетоны,
кетоальдегиды, альдегидо- и кетокислоты (и
их производные) и т. п. Помимо св-в,
характерных для карбонильных соед.,
дикарбонильные соединения проявляют
специфич. св-ва, зависящие от взаимного
расположения групп СО.
a-Дикарбонильные
соединения (1,2-дикарбонильные соединения)
RCOCOR'. Карбонильные
группы обычно обнаруживают ярко
выраженную электроф. реакц. способность.
Для них характерна циклизация при
действии бифункциональных нуклеофилов
(напр., ур-ние 1) и соед. 3-валентного Р
(2). Связь С—С между группами СО обычно
сравнительно легко расщепляется, напр.,
при фотолизе (3)
или действии нуклеофилов (4). Для a-диальдегида
(глиоксаля)и a-кетоальдегидов
характерна внутримол. Канниццаро
реакция,
для ароматич. a-дикетонов
(бензилов)
- бензиловая
перегруппировка.
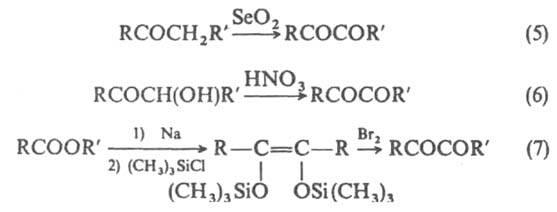
 Осн.
способы получения a-дикарбонильных
соединений - окисление монокарбонильных
соед. (5) или их a-замещенных
производных, напр. ацилоинов (6),
производных ендиолов (7), гликолей и
др.; ароматич. a-дикетоны
получают также из ароматич. соед. и
оксалилхлорида по р-ции Фриделя -
Крафтса.
Осн.
способы получения a-дикарбонильных
соединений - окисление монокарбонильных
соед. (5) или их a-замещенных
производных, напр. ацилоинов (6),
производных ендиолов (7), гликолей и
др.; ароматич. a-дикетоны
получают также из ароматич. соед. и
оксалилхлорида по р-ции Фриделя -
Крафтса.
 Нек-рые a-дикарбонильные
соединения, напр., метилглиоксаль
СН3СОСНО,
пировиноградная к-та СН3СОСООН,
участвуют в обмене в-в в
живых организмах. Диацетил обусловливает
запах сливочного масла;
его производное -диметилглиоксим применяется
как аналит. реагент. a-Дикарбонильные
соединения используют в орг. синтезе
для получения гетероциклич.
соед.
b-Дикарбонильные
соединения (1,3-дикарбонильные соединения)
RCOC(R:R':)COR'. Соед.
с R: и(или)
R': =
Н - сравнительно сильные СН-кислоты. Для
них характерна легкая енолизация с
образованием цис-енолов (в хелатной
форме с внутримол. водородной
связью),
реже -транс-енолов (см. Таутомерия):
Нек-рые a-дикарбонильные
соединения, напр., метилглиоксаль
СН3СОСНО,
пировиноградная к-та СН3СОСООН,
участвуют в обмене в-в в
живых организмах. Диацетил обусловливает
запах сливочного масла;
его производное -диметилглиоксим применяется
как аналит. реагент. a-Дикарбонильные
соединения используют в орг. синтезе
для получения гетероциклич.
соед.
b-Дикарбонильные
соединения (1,3-дикарбонильные соединения)
RCOC(R:R':)COR'. Соед.
с R: и(или)
R': =
Н - сравнительно сильные СН-кислоты. Для
них характерна легкая енолизация с
образованием цис-енолов (в хелатной
форме с внутримол. водородной
связью),
реже -транс-енолов (см. Таутомерия):
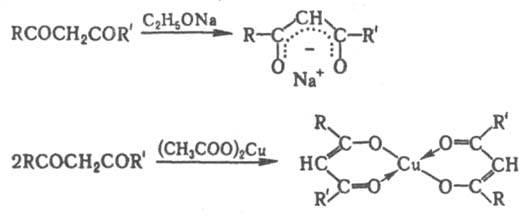
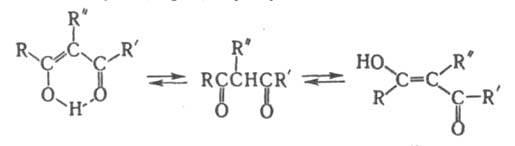 Наличие
электроноакцепторных заместителей,
напр., в случае полифтор-b-дикетонов,
увеличивает кислотность кетоформы и
способствует енолизации, а введение
объемистых заместителей затрудняет
ее. b-Дикарбонильные
соединения легко образуют еноляты щелочных
металлов,
а с солями двух-
и поливалентных металлов -
прочные внутрикомплексные еноляты,
содержащие хелатный цикл
(см. b-Дикетонаты металлов),
напр.:
Наличие
электроноакцепторных заместителей,
напр., в случае полифтор-b-дикетонов,
увеличивает кислотность кетоформы и
способствует енолизации, а введение
объемистых заместителей затрудняет
ее. b-Дикарбонильные
соединения легко образуют еноляты щелочных
металлов,
а с солями двух-
и поливалентных металлов -
прочные внутрикомплексные еноляты,
содержащие хелатный цикл
(см. b-Дикетонаты металлов),
напр.:
 Благодаря
образованию енолятов b-дикарбонильные
соединения в присут. оснований вступают
в конденсации типа
альдольной, р-ции Кнёвенагеля, Михаэля
и т. п., легко алкилируются и ацилируются
с образованием С- или О-производных
(соотношение продуктов зависит от
строения b-дикарбонильного
соединения, природы основания иреагента,
полярности р-рителя), напр.:
Благодаря
образованию енолятов b-дикарбонильные
соединения в присут. оснований вступают
в конденсации типа
альдольной, р-ции Кнёвенагеля, Михаэля
и т. п., легко алкилируются и ацилируются
с образованием С- или О-производных
(соотношение продуктов зависит от
строения b-дикарбонильного
соединения, природы основания иреагента,
полярности р-рителя), напр.:
 При
действии избытка сильного основания на
1,3-дикарбонильные соединения, у к-рых
имеются a-
и g-атомы
Н, образуются соли,
содержащие дианионы этих дикарбонильных
соединений; в этом случае атака электрофила
направляется на g-атом
С, напр.:
При
действии избытка сильного основания на
1,3-дикарбонильные соединения, у к-рых
имеются a-
и g-атомы
Н, образуются соли,
содержащие дианионы этих дикарбонильных
соединений; в этом случае атака электрофила
направляется на g-атом
С, напр.:
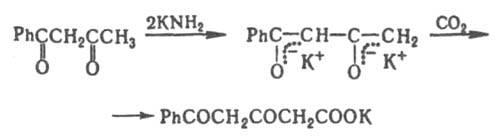 Под
действием сильных оснований в
жестких условиях расщепляется связь
С—С ("кислотное расщепление"ацетоуксусного
эфира).
Взаимод. b-дикарбонильных
соединений с бифункциональными
нуклеофилами получают пяти-, шести- или
семичленные гетероциклы,
напр.:
Под
действием сильных оснований в
жестких условиях расщепляется связь
С—С ("кислотное расщепление"ацетоуксусного
эфира).
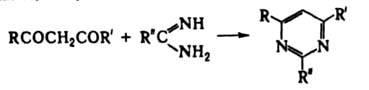
Взаимод. b-дикарбонильных
соединений с бифункциональными
нуклеофилами получают пяти-, шести- или
семичленные гетероциклы,
напр.:
 b-Дикарбонильные
соединения получают гл. обр. Клайзена
конденсацией,
а также аналогичными р-циями из
производных енолов,
напр.:
b-Дикарбонильные
соединения получают гл. обр. Клайзена
конденсацией,
а также аналогичными р-циями из
производных енолов,
напр.:
 b-Дикарбонильные
соединения широко применяют в орг.
синтезе (см., напр., Ацетоуксусный
эфир)
для получения лек. ср-в, красителей и
др. b-Дикетоны
используют для разделения и анализа
РЗЭ и актиноидов.
См. такжеАцетилацетон, Гексафторацетилацетон, Индандионы,
Теноилтрифторацетон, Трифторацетилацетон.
b-Дикарбонильные
соединения широко применяют в орг.
синтезе (см., напр., Ацетоуксусный
эфир)
для получения лек. ср-в, красителей и
др. b-Дикетоны
используют для разделения и анализа
РЗЭ и актиноидов.
См. такжеАцетилацетон, Гексафторацетилацетон, Индандионы,
Теноилтрифторацетон, Трифторацетилацетон.
4.2
