
- •Лекция №1
- •Классификация месторождений природного газа
- •Этапы разработки газовых и газоконденсатных месторождений
- •Режимы разработки месторождений природных газов
- •Особенности разработки газоконденсатных месторождений
- •Особенности притока газа к забою газовой скважины
- •Лекция 3
- •Состав и физико-химические свойства природных газов. Классификация природных газов
- •Газовые смеси. Плотность газов
- •Состав газовой смеси
- •Так появились уравнения состояния Битти - Бриджмена с пятью константами, Бенедикта – Вебба - Рубина с восемью константами и др.
- •Вязкость газов
- •Термодинамические характеристики газа
- •Классификация газовых топлив
- •Требования к качеству газового топлива
- •Опасные свойства природных газов
- •Взрывы газовоздушных смесей
- •Жидкие смеси. Состав и характеристика жидкой смеси
- •Объём паров после испарения жидкости
- •Фазовые состояния углеводородных систем. Словия равновесия двухфазной системы
- •Количественное решение двухфазной системы заключается в количественном распределении на паровую и жидкую фазы всех компонентов этой смеси при заданных давлении и температуре.
- •Упругость насыщенных паров
- •Термодинамические характеристики газа
- •Эффект Джоуля – Томсона
- •Эффект Ранка
- •Лекция №7
- •Лекция № 8
- •Состояние призабойной зоны пласта
- •Проницаемость призабойной зоны пласта
- •Классификация дисперсных систем по межфазному взаимодействию
- •Фильтрация дисперсных систем через пористые среды
- •Определение диаметра фонтанных труб газовой скважины
- •Принцип работы газлифта
- •Системы и конструкции газлифтных подъёмников
- •Разновидности газлифта, их технологические схемы
- •Преимущества и недостатки газлифтного способа добычи нефти
- •Оборудование газлифтных скважин
- •Пусковое давление
- •Методы снижения пускового давления
- •Газлифтные клапан
- •Тарировка газлифтных клапанов
- •Спуск и подъём съёмных клапанов, используемый инструмент
- •Торпедная перфорация
- •Сверлящая перфорация
- •3.Свабирование
- •4. Имплозия
- •Приборы для измерения давления
- •Устройства для измерения температуры
- •Устройства для измерения расхода природного газа
- •Подготовка скважины к газогидродинамическим исследованиям
- •Технология проведения исследований
- •Определение коэффициентов фильтрационного сопротивления "а" и "в"
- •Обработка результатов исследований газовой скважины на стационарных режимах
- •Пожары и фонтаны на нефтяных и газовых скважинах
- •Лекция №22
- •Средства и методы борьбы с пескопроявлением скважин
- •Лекция 23
- •Основные мероприятия по предупреждению и ликвидации обводнения газовых скважин
- •Классификация методов восстановления производительности обводняющихся скважин
- •Лекция №24
- •Лекция №25
- •8М-136 н2о или же м-17 н2о.
- •I – с4н817н2о,
- •Лекция №26
- •Основы ингибирования процесса гидратообразования
- •Ликвидация гидратов природных газов в газопроводах
- •Метод снижения давления в газопроводе
- •Метод устранения гидратов повышением их температуры
- •Устранение гидратных пробок с использованием ингибиторов гидратообразования
- •Метод сублимации гидрата
Термодинамические характеристики газа
В технологических расчётах добычи и транспорта газа часто пользуются основными термодинамическими характеристиками природного газа: теплоёмкостью, энтропией, энтальпией, теплотой сгорания, теплообменом, теплопроводностью.
Теплоёмкость. Теплоёмкостью называют количество теплоты, необходимое для нагревания единицы массы или объёма вещества на 1°С.
Отношение теплоёмкости в массе системы М называется удельной теплоёмкостью:
с = С/М, (31)
а отношение теплоёмкости к количеству вещества – молярной теплоемкостью:
 (27)
(27)
где Рат- атмосферное давление;
Ткип- температура кипения компонента при атмосферном давлении.
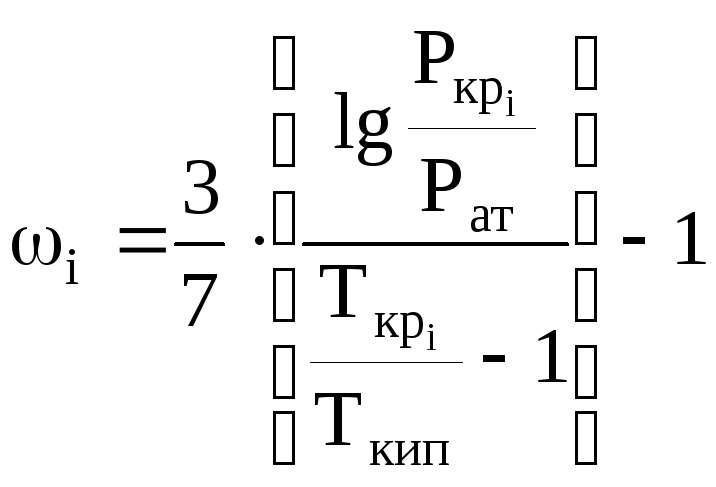
Ацентрический фактор для многих веществ изменяется от 0,0 до 0,4. Отношение абсолютной критической температуры компонента к абсолютной температуре кипения (при нормальных физических условиях) зависит от типа углеводородов - парафиновых, нафтеновых или ароматических. Для углеводородов парафинового ряда это отношение можно определить, например, по корреляционной зависимости Г. Р. Гуревича
![]() (28)
(28)
![]() . (32)
. (32)
Единицей количества теплоты, работы, энергии в системе СИ является джоуль (Дж). Джоуль -работа силы 1Н при перемещении ею тела на расстоянии 1м в направлении действия силы:
![]()
Теплоёмкость выражается в Дж/К, удельная теплоёмкость – в Дж/(кг·K), молярная теплоёмкость – в Дж/(моль К).
Теплоёмкость природных газов зависит от химического состава и состояния, а также от процесса сообщения им теплоты. В адиабатическом процессе С = 0, в изобарическомС = Ср, в изохорическомС = Сv .
Для газов обычно различают теплоёмкости при постоянном объёме Сvи постоянном давленииСр.
![]()
![]() (33)
(33)
где Р = const и V = const.
Сv связана с процессом, характеризующимся тем, что при неизменности объёма вся энергия, сообщаемая газу в форме теплоты, затрачивается на увеличение внутренней энергии газа. Срсвязана с процессом, характеризующимся тем, что, нагревая тело, предоставляют ему возможность расширяться при неизменном давлении. Таким образом, часть сообщенной телу теплоты идет на производство работы расширения. ПоэтомуСр > Сv.
Для идеальных газов между СриСv существует следующее соотношение в [кал/моль·°С]:
![]() (34)
(34)
где R- газовая постоянная.
В области давлений, где газы считаются идеальными, значения теплоёмкостей постоянны. Однако для реальных газов значения теплоёмкости изменяются в зависимости от давления . Для смеси газов теплоёмкость определяется по сумме теплоемкости входящих компонентов по формуле
![]() (35)
(35)
где С1, С2…Сn -теплоёмкости отдельных компонентов смеси;
х1,
х2…![]() содержание компонентов в долях единицы.
содержание компонентов в долях единицы.
Отношение теплоёмкости
![]() называют
показателем адиабаты.
называют
показателем адиабаты.
Для сравнительной характеристики различного вида топлива используется понятие удельной теплоты сгорания.
Удельной теплотой сгорания газового топлива называется количество теплоты, которое выделяется при полном сгорании 1 н.м3или 1 кг газа. Теплоту сгорания газообразного топлива обычно измеряют в ккал/м3при температуре 0 или 200С и давлении 760 мм. рт. ст. расчётным путём по известному химическому составу газа или же с помощью калориметров.
Различают низшую теплоту сгорания Qни высшую теплоту сгорания Qв.
Высшая теплота сгорания газового топлива соответствует условию, при котором водяные пары продуктов сгорания доводятся до жидкого состояния. В реальных условиях сжигания газа водяные пары не конденсируются, а находятся в парообразном состоянии. Понятие низшей теплоты сгорания относится только к тем газам, которые при сгорании выделяют водяные пары. Разница между Qви Qнсоставляет порядка 600 ккал на каждый килограмм водяных паров, т.е. 6 ккал на каждый процент влаги, содержащейся в топливе или образующийся при сгорании водорода, входящего в состав горючего газа.
ЛЕКЦИЯ №4
Физико-химические свойства топлива, его классификация, вредные и балластные примеси. Состав газовых топлив. Классификация газовых топлив. Требования к качеству газового топлива. Опасные и вредные свойства природных углеводородов.
Большинство органических и неорганических веществ способно при определенных условиях вступать во взаимодействие с кислородом воздуха, то есть окисляться. В результате этого процесса происходит выделение большого количество тепла, нагревающего продукты окисления до высоких температур, такой процесс носит название горение.
Однако не все вещества способные гореть, следует относить к топливу. К топливу следует относить только те горючие вещества, которые при горении выделяют большое количество тепла на единицу массы или объёма, не теряют своих тепловых свойств, и при этом не выделяют при горении вредных веществ.
Топливо может, находится в трех агрегатных состояниях – твердом, жидком и газообразном.
По происхождению оно разделяется на естественное, или натуральное (добываемое в готовом виде), и искусственное, получаемое при переработке естественного топлива или в результате переработки других веществ, в первоначально виде не относящееся к нему (таблица 1).
Рассмотрим основные свойства и состав газообразного топлива.
Газообразное топливо представляет собой смесь горючих и негорючих газов, содержащую некоторое количество примесей.
Горючая часть топлива, или органическая масса, включает в себя сложные органические соединения – углерод С, водород Н, кислород О, азот Nи сераS. Следует отметить, что часть серы, входящей в минеральные примеси, образующие при горении топлива, относятся к негорючей массе.
Негорючая часть топлива состоит из влаги W и золы A – минеральных (неорганических) веществ.
Чем выше содержание в топливе горючих элементов (С, Н, S), тем выше его теплота сгорания.
Таблица 1. Классификация топлива по происхождению агрегатному состоянию
|
Натуральное (естественное) топливо |
Искусственное топливо | ||||
|
твердое |
жидкое |
газообразное |
твердое |
жидкое |
Газо- бразное |
|
Растительное (дрова, солома, кора, лузга и т.д.) |
Ископае- мое (нефть) |
Природный (естественный) горючий газ. Попутный нефтяной газ |
Полученное термохимической переработкой натурального топлива (древесный уголь, торфяной и угольный полукокс, кокс торфяной, угольный и нефтяной |
Полученное при термической переработке нефти и смол (бензин, лигролин, керосин, соляровое масло, мазут) |
Полученное при термическом разложении нефти (нефтяные газы) |
|
Ископаемое (торф, бурый уголь, каменный уголь, антрацит, горючие сланцы и т.д.) |
|
|
Полученное механической обработкой натурального топлива (брикеты из древесных опилок, торфа, угля и др. материалов |
Полученное при химической переработке натурального топлива (бензин, лигролин, дизтопливо, мазут, спирт, бензол, толуол, коллоидное топливо) |
Полученное при химической переработке твердого топлива (генераторный газ, водяной, первичный (полукоксовый), коксовые газы гидро-генизации). |
На рисунке 1 приведен состав рабочего топлива, т.е. топлива каким оно добывается из недр земли.
|
Органическая масса топлива
Со + Но + Оо + Nо + Sо = 100 % |
Внешний балласт +W | |||||||
|
C |
H |
O |
N |
S |
A |
W | ||
|
|
внутренний балласт |
| ||||||
|
Горючая масса топлива Сг + Нг + Ог + Nг + Sг = 100% |
| |||||||
|
Сухая масса топлива Сс + Нс + Ос + Nс + Sс +Ас = 100% |
| |||||||
|
Состав рабочего топлива Ср + Нр + Ор + Nр + Sр +Ар + Wр= 100 | ||||||||
Рисунок 1. Схема состава топлива
Содержащийся в топливе кислород, как известно, сам не горит, но вместе с кислородом воздуха способствует сгоранию горючих элементов топлива. Азот является инертным элементом и при сжигании топлива он в свободном состоянии выделяется и уносится с дымовыми газами.
Кислород и азот составляют т.н. внутренний балласт, в отличие от внешнего балласта, к которому относятся зола (минеральные примеси) и влага топлива. Исходя из вышеизложенного, следует, что чем больше объём внутреннего и внешнего балласта, тем ниже теплота сгорания и тем хуже его качество. Балласт газообразного топлива включает в себя, углекислый газ СО2, водяные пары Н2О и азотN2.
Внешний балласт при сгорании горючих материалов, отбирает значительное количество тепла для своего нагревания. Это обстоятельство ведет к значительным затратам на его транспортировку, износу аппаратуры и расходу энергии на перемещение топлива по аппаратам при его химической переработке.
Топливо, в зависимости от его поведения при нагревании может быть разделено на теплостойкое, переходящее при нагревании из одного агрегатного состояние в другое без разложения, и нетеплостойкое, которое при нагревании разлагается. Большая часть жидких горючих веществ относится к теплостойкому топливу, т.к. при нагревании они переходят в парообразное (газообразное) состояние. Твердые виды топлив, как правило, относятся к нетеплостойкому топливу.
Улучшение качества топлива достигают путем его осушки - получают, таким образом, сухую массу топлива. Если из последней удалить золу – получим состав условной горючей массы топлива, которая обозначается индексом ''Г''. Следует отметить, что сравнение различных видов топлива проводят не по составу рабочего топлива, а по составу их органической или условно горючей массы. Составляющие элементы органической массы топлива обозначают индексом ''О''. Органическая масса отличается от условной горючей массы на величину негорючей части серы.
По известному составу рабочего топлива, можно произвести перерасчёт на сухое топливо по уравнению
![]() . (1)
. (1)
Пересчёт состава топлива на горючую массу через сухую массу и рабочее топливо может быть выполнен по уравнению следующего вида
![]() . (2)
. (2)
Пересчёт содержания элементов топлива с условной горючей массы на сухую массу и рабочее топливо осуществляют по уравнениям следующего вида
![]() . (3)
. (3)
![]() . (4)
. (4)
где Кр, Кс, Кг,Wр, Ар, Ас – процентное содержание элементов (К), влаги (W) и золы (А) – соответственно в рабочем и сухом топливе и в его горючей массе.
Поскольку все виды топлива состоят из органических соединений, основе которых находится углерод, то он и является основным горючим элементом топлива, или, иначе говоря – источником потенциального тепла.
Вторым по значению горючим элементом топлива является водород. Способность водорода выделять тепло зависит от того, с каким элементом, входящим в молекулу органического вещества этого топлива он химически связан. Если водород органической массы топлива связан непосредственно с углеродом, то при сгорании топлива, возможно, получить всё топливо, соответствующее сгоранию свободного водорода. В случае если водород органического вещества топлива связан с атомами углерода не непосредственно, а через кислород , то при сгорании топлива будет выделяться меньше тепла.
По соотношению величины С/Н можно судить о пригодности того или иного топлива для разных целей. Если это соотношение имеет значительную величину, то, например твердое топливо, горит без пламени или с коротким пламенем. Если же соотношение не велико (увеличение содержания водорода в топливе) – отмечается выделение значительного количества смолистых летучих веществ, дающих коптящее пламя.
Состав газовых топлив
Газовое топливо, используемое на практике, обычно является смесью нескольких различных газов (компонентов), которые могут смешиваться между собой в любых количественных соотношениях. Те из газов, которые способны гореть, образуют горючую часть, а те, которые гореть не могут, представляют собой балластную часть газового топлива.
Горючая часть газового топлива состоит из водорода (Н2), метана (С Н4), этана (С2 Н6), пропана (С3 Н8), бутанов (С4 Н10), окиси углерода (С О) и некоторых других углеводородов. Балластом газового топлива являются азот (N2), углекислота (С О2), водяные пары (Н2 О), сероводород (Н2 S). Кроме того, в состав некоторых видов газового топлива входит небольшое количество кислорода, который хотя и. поддерживает горение, но является вредной примесью газа. Сероводород при горении выделяет крайне вредный сернистый газ (S О2), поэтому его нужно, тщательно удалять из газового топлива, особенно когда оно используется для бытового газоснабжения. Как и для других топлив, для газа справедливо положение: чем меньше при прочих равных условиях содержится в нем балластных составных частей, тем лучше топливо.
