
- •Лекция №1
- •Классификация месторождений природного газа
- •Этапы разработки газовых и газоконденсатных месторождений
- •Режимы разработки месторождений природных газов
- •Особенности разработки газоконденсатных месторождений
- •Особенности притока газа к забою газовой скважины
- •Лекция 3
- •Состав и физико-химические свойства природных газов. Классификация природных газов
- •Газовые смеси. Плотность газов
- •Состав газовой смеси
- •Так появились уравнения состояния Битти - Бриджмена с пятью константами, Бенедикта – Вебба - Рубина с восемью константами и др.
- •Вязкость газов
- •Термодинамические характеристики газа
- •Классификация газовых топлив
- •Требования к качеству газового топлива
- •Опасные свойства природных газов
- •Взрывы газовоздушных смесей
- •Жидкие смеси. Состав и характеристика жидкой смеси
- •Объём паров после испарения жидкости
- •Фазовые состояния углеводородных систем. Словия равновесия двухфазной системы
- •Количественное решение двухфазной системы заключается в количественном распределении на паровую и жидкую фазы всех компонентов этой смеси при заданных давлении и температуре.
- •Упругость насыщенных паров
- •Термодинамические характеристики газа
- •Эффект Джоуля – Томсона
- •Эффект Ранка
- •Лекция №7
- •Лекция № 8
- •Состояние призабойной зоны пласта
- •Проницаемость призабойной зоны пласта
- •Классификация дисперсных систем по межфазному взаимодействию
- •Фильтрация дисперсных систем через пористые среды
- •Определение диаметра фонтанных труб газовой скважины
- •Принцип работы газлифта
- •Системы и конструкции газлифтных подъёмников
- •Разновидности газлифта, их технологические схемы
- •Преимущества и недостатки газлифтного способа добычи нефти
- •Оборудование газлифтных скважин
- •Пусковое давление
- •Методы снижения пускового давления
- •Газлифтные клапан
- •Тарировка газлифтных клапанов
- •Спуск и подъём съёмных клапанов, используемый инструмент
- •Торпедная перфорация
- •Сверлящая перфорация
- •3.Свабирование
- •4. Имплозия
- •Приборы для измерения давления
- •Устройства для измерения температуры
- •Устройства для измерения расхода природного газа
- •Подготовка скважины к газогидродинамическим исследованиям
- •Технология проведения исследований
- •Определение коэффициентов фильтрационного сопротивления "а" и "в"
- •Обработка результатов исследований газовой скважины на стационарных режимах
- •Пожары и фонтаны на нефтяных и газовых скважинах
- •Лекция №22
- •Средства и методы борьбы с пескопроявлением скважин
- •Лекция 23
- •Основные мероприятия по предупреждению и ликвидации обводнения газовых скважин
- •Классификация методов восстановления производительности обводняющихся скважин
- •Лекция №24
- •Лекция №25
- •8М-136 н2о или же м-17 н2о.
- •I – с4н817н2о,
- •Лекция №26
- •Основы ингибирования процесса гидратообразования
- •Ликвидация гидратов природных газов в газопроводах
- •Метод снижения давления в газопроводе
- •Метод устранения гидратов повышением их температуры
- •Устранение гидратных пробок с использованием ингибиторов гидратообразования
- •Метод сублимации гидрата
Количественное решение двухфазной системы заключается в количественном распределении на паровую и жидкую фазы всех компонентов этой смеси при заданных давлении и температуре.
Уравнение общего баланса распределения компонентов имеет следующий вид

![]() (9)
(9)
где 100 – число молей первоначальной смеси;
L– число молей образовавшейся жидкой фазы;
V– число молей паровой фазы.
Материальный баланс по каждому компоненту
A=x·L+y·V(10)
где А – число молей в первоначальной смеси;
х – молярная концентрация этого компонента в жидкой фазе;
у – молярная концентрация его в паровой фазе.
Для получения уравнения параметров жидкой фазы в уравнении (Ж) следует заменить параметры паровой фазы параметрами жидкой:
![]()
![]()
Затем получаем
![]()
Решая уравнение (13) относительно х, получаем
![]()
Уравнение (14) называется уравнением концентраций, так как учитывает концентрацию любого компонента в жидкой фазе при заданных значениях давления и температуры.
Аналогично получается уравнение
концентраций для паровой фазы
![]()
![]()
![]()
![]()
![]()
Для n компонентов первоначальной смеси будет n уравнений + одно уравнение
х1+ х2+…+xn= 1 (19)
y1+ у2+…уn= 1 (20)
Исходя из вышеизложенного для n +1 неизвестных будет столько же уравнений.
Окончательное уравнение для определения параметров жидкой фазы имеет вид:
![]()
Упругость насыщенных паров
Пар какого-либо вещества будет насыщенным только в том случае, если вместе с ним в системе имеется свободная жидкость. Смесь летучей жидкости с её насыщенным паром представляет моновариантную систему, состояние которой характеризуется или давлением, или температурой.
Если поддерживать заданную температуру в двухфазной системе, то давление пара будет строго определенным. Если же поддерживать определенное давление пара, то одновременное существование жидкости и пара будет возможно только при определенной температуре. Для всех летучих жидкостей зависимость давления насыщенного пара от температуры в координатах р и t(кривая испарения) имеет примерно одинаковую форму -выпуклостью обращена к оси температуры (рис. 4).

Рисунок 4 - Кривая испарения
Рассмотрим зависимость объёма от давления для системы, состоящей из жидкости и пара (например, для пропана) при его изотермическом сжатии (рис. 5,а).

Рисунок 5 - Зависимость давления от объёма и температуры (а) и кривая упругости насыщенных паров (б):
Температура, К: 1 - 283; 2 - 293; 3 - 303; 4 - 313; 5 - 323
При сжатии от точки М до А существует один ненасыщенный(перегретый) пар и кривая имеет форму гиперболы. В этом случае произведение давления на удельный объём в первом приближении является постоянной величиной. В точке А пар становится насыщенным и при дальнейшем сжатии переходит в жидкость (участок АВ), давление же системы не изменяется, так объём её уменьшается из-за перехода пара в жидкое состояние. В точке В заканчивается переход пара в жидкость, и при дальнейшем сжатии объём её уменьшается незначительно, при резком возрастании давления. Горизонтальный участок АВ соответствует неизменности давления в процессе конденсации паровой фазы в жидкую фазу. Величина такого давления называется упругостью насыщенных паров (Q) природного газа при заданной температуре. Следует заметить, что чем ближе температура к критической, тем меньше этот горизонтальный участок.
Обычно такие опыты проводят при различных температурах. Чем ближе температура к критической, тем короче горизонтальный участок, выражающий упругость насыпанных паров. Далее строят кривую в осях давление - температура по данным упругости насыщенных паров и таким образом, получают кривую испарения или кривую упругости паров данного вещества (рис. 5,б).
Для различных углеводородов кривые упругости насыщенных паров приведены на рис. 6.
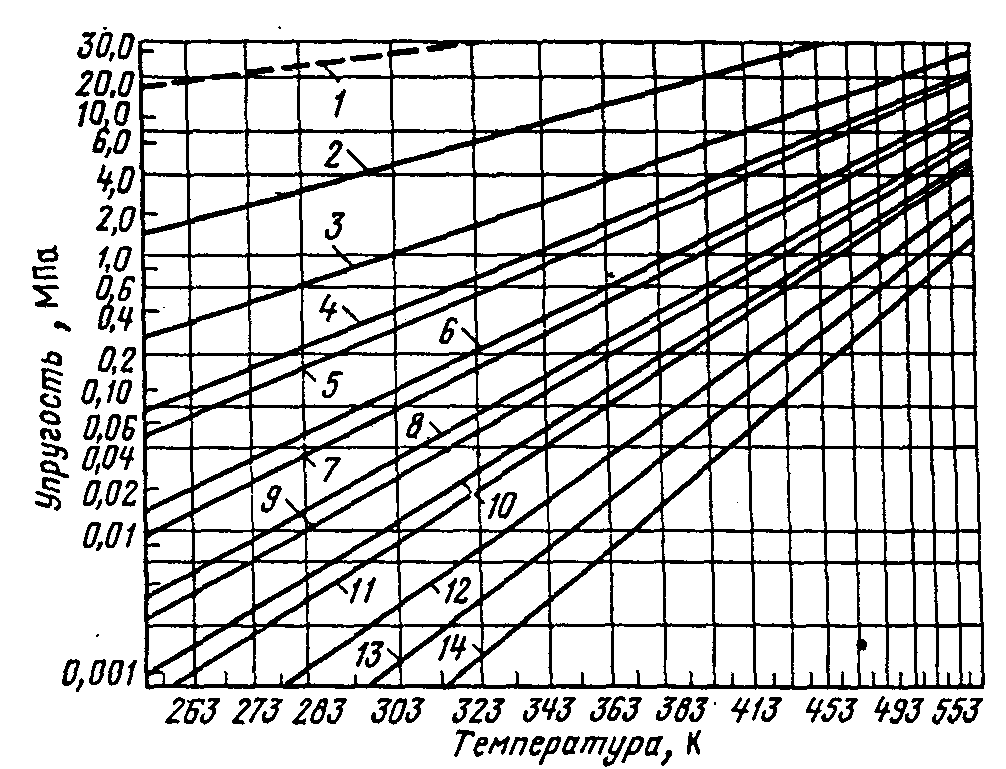
Рисунок 6 - Кривые упругости насыщенных паров чистых углеводородов:
1 - метан; 2 - этан: 3 - пропан; 4 - изобутан; 5 - бутан; 6 - изопентан; 7 - пентан; 8 - изогексан; 9 - гексан; 10 - изогептан; 11 - гептан; 12 - октан; 13 -нонан 14 - декан
Для чистых углеводородов упругость насыщенных паров Qзависит только от температуры, т. е. Q =f (t).При таких условиях упругость насыщенного пара равна общему давлению на поверхности жидкости; при данной температуре это давление не может увеличиваться или уменьшаться.
Общее давление для смеси углеводородов складывается из парциальных давлений всех компонентов. В этом случае упругость насыщенных паров любого компонента не остается постоянной при данной температуре, а является функцией также и общего давления, т.е. Q = f(t,p). Так как, в данном случае имеются три переменные (давление, температура и упругость паров), то вводится так называемая константа равновесия К (коэффициент распределения), представляющая отношение упругости паров Qк общему давлению Рсм
![]()
В результате можно построить график для определения константы равновесия (а значит, и для упругости паров). Например, при низких давлениях константа равновесия изменяется почти по прямой линии, так как упругость паров почти постоянная. При высоких давлениях увеличение упругости паров с повышением общего давления становится значительным. Это выражается переходом прямой линии в кривую (см. рис. 7).
При дальнейшем росте давления кривая приближается к точке инверсии, в которой увеличение упругости равно повышению общего давления. Далее упругость паров увеличивается значительнее повышения давления, и в этой области константа равновесия К с повышением давления возрастает, что обусловлено повышением летучести жидкости. Такое обстоятельство показывает двузначность изменения величины константы равновесия с изменением давления.
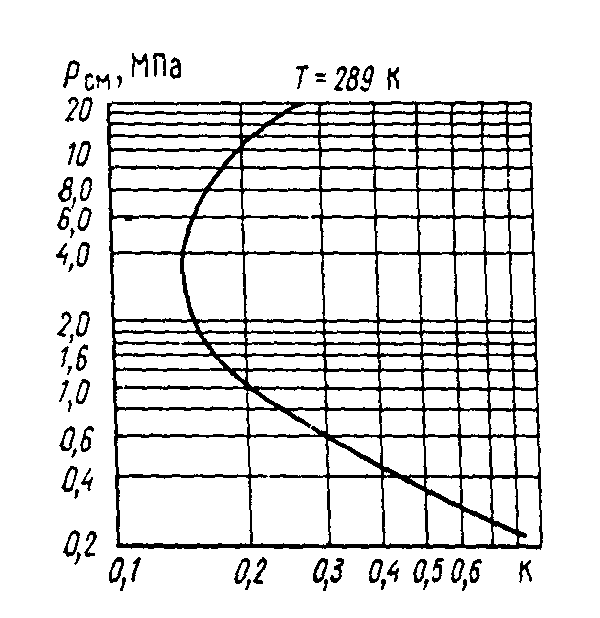
Рис.7 - Зависимость константы равновесия н-бутана при 289 К от общего давления
Явления обратной конденсации и испарения
Если пар, находящийся в ёмкости под давлением продолжать сжимать, то через некоторое время он становится насыщенным. При дальнейшем повышении давления будет происходить конденсация пара и вследствие этого уменьшение его объёма. Когда весь пар перейдет в жидкость, то при дальнейшем повышении давления эта жидкость будет сжиматься на такую ничтожную величину, что ею часто можно пренебречь. Следовательно, повышение давления способствует конденсации. Снижение же давления, наоборот, - испарению. Это - прямые процессы.
Но в зоне высоких давлений и при других определенных условиях происходят обратные процессы, т.е. при повышении давления происходят испарение, а при понижении давления -конденсация. Такие процессы называют обратными.
Месторождения, образовавшиеся в результате таких обратных процессов, называются газоконденсатными. Существование газоконденсатных месторождений объясняется тем, что углеводородные смеси при давлении, начиная с 3,0 - 4,0 МПа, перестают подчиняться законам упругости паров и равновесных соотношений.
Константы равновесия углеводородов с ростом давления также возрастают, т. е. жидкости становятся более летучими. В результате смесь может оказаться в газообразном состоянии. Все это происходит при температуре выше критической. Практическое же значение имеет явление обратной конденсации и испарения при давлении обычно более 15,0 МПа.
Рассмотрим диаграмму фазовых состояний одного вещества (рис 8)
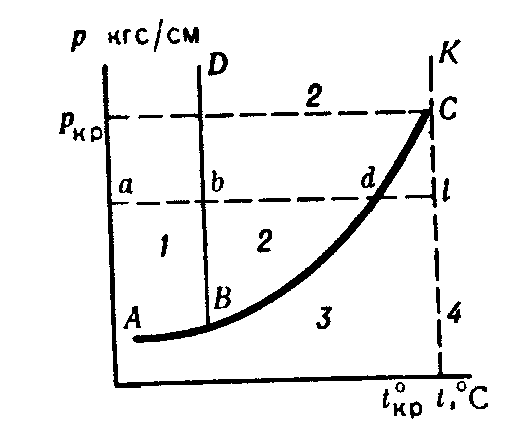
Рисунок 8 - Диаграмма зависимости давления и температуры для индивидуального компонента:
1 – твердое состояние;
2 – жидкое состояние;
3 – парообразное состояние;
4 – газообразное состояние.
Здесь АВ -граница твердого состояния и пара (линия сублимации);BD -граница твердого и жидкого состояний (линия плавления); ВС -линия жидкого и парообразного состояний (линия испарения), точка С -критическая. При достижении температуры в этой точке исчезает граница между жидким и газообразным состояниями вещества. Выше такой температуры вещество представляет собой газ, который не превращается в жидкость при любом давлении. В точке В (тройной) при строго определенных параметрах существуют все три фазы.
Из диаграммы видно, что в интервале ab, т. е. в области твердого состояния вещества, данному давлению соответствуют ряд значений температур и изменяющийся удельный объём. В интервалеbd, т. е. в области жидкой фазы, то же самое. В точкеdдавления, т.е. в зоне существования двух фаз может быть свободно выбран только один параметр. Между точками dи lсуществует одна паровая фаза. Начиная от точки lи далее, т. е. выше критической температуры, вещество находится в газообразном состоянии. В крайней точке С кривой ВС температура критическая, до которой возможно существование жидкой фазы данного вещества. Выше этой точки существует только чисто газовая фаза данного вещества. Этой критической температуре соответствует определенное критическое давление Ркрявляющееся вторичным параметром критического состояния вещества.
Вертикальная линия СК, соответствующая критической температуре tкрявляется границей перехода вещества из одного состояния в другое; линия КС -скачкообразного перехода из жидкого состояния в газообразное, точка С -перехода из парообразного состояния в газообразное.
При условиях, близких к tкр, сглаживается разница в физических свойствах жидкости и пара, исчезающая при критической температуре.
Рассмотрим диаграмму для двухкомпонентной системы (рис. 9.).В области, расположенной выше температуры, соответствующей точке СR, существование жидкой фазы данной смеси невозможно. Точку СR, обычно называют точкой критической температуры конденсации, а точку СХ -критической температурой многокомпонентной смеси. Обычно в этой точке в двухфазное состояние из этой смеси переходит примерно 50 %жидкости. Для чистого же компонента в точке СR, состояние жидкой фазы предельное. Выше этой точки жидкость переходит в пар. Этим различаются критические температуры смеси и чистого компонента.
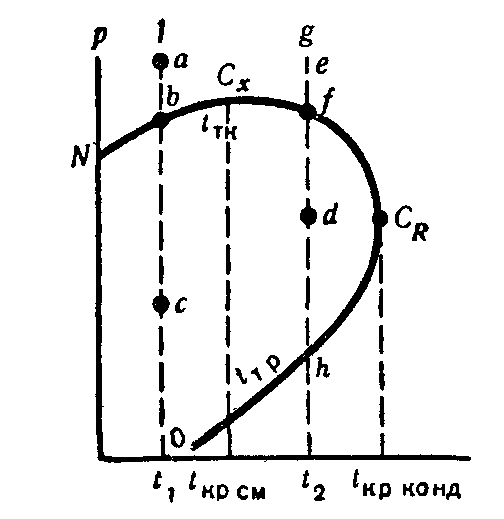
Рисунок 9. Диаграмма давления и температуры для двух компонентой системы:
tкр– кривая точек кипения;tтр– кривая точек росы.
Рассмотрим два варианта изменения состояния смеси со снижением давления: первый -при температуре ниже критической в точкеСХ, а второй -выше нее, но нижеСR.
Изменение состояния смеси по линии abcпри температуре t1<tкр.см. В точкеа существует одна жидкая фаза. Снижение в нтервалеаbне вызывает образования паровой фазы. В точкеbначинается испарение. ЛинияNbCХявляется линией кипения или испарения. Количество паровой фазы по мере снижения давления будет увеличиваться. В данном случае процесс проходит обычным путем, т. е. это прямой процесс испарения при снижении давления над смесью.
2.Изменение состояния смеси по линииefdhпри температуре t2, линия efdhрасположена между критическими температурами, т. е. tкр.см<t2<tкон.смВ точкеесуществует только газовая фаза, сохраняющаяся и при понижении давления в интервале еf. В точке fпоявляется жидкость (криваяCХfCRhO- кривая конденсации или точек росы). При дальнейшем снижении давления ниже точки f количество жидкости будет увеличиваться, но только до известного предела (до точкиd), а затем уменьшаться, и в точкеhбудет опять только газовая фаза. В данном случае в интервалеfdнаблюдается явление обратной конденсации -образование конденсата при снижении давления. В интервалеdhпротекает прямой процесс - испарение жидкости при снижении давления. Если процесс вести снизу, то в этом интервале будет также прямой процесс -образование конденсата при повышении давления, а в интервалеdf - обратный процесс, т. е. испарение жидкости при повышении давления. Таким образом, процесс обратной конденсации или испарения может протекать только в зоне между критической температурой данной смеси и критической температурой ее конденсации, т. е. в температурном интервале от линия efdhрасположена между критическими температурами, т. е. от tкр.смдо tкон.см(между точкамиСХиСR).
Рассмотрим изотермы конденсации для трех температур (рисунок 10.).

Рисунок 10. Изотермы конденсации
Из рисунка 10 видно, что каждой изотерме соответствует определенное давление, при котором образуется наибольшее количество конденсата. Это давление называют давлением максимальной конденсации. Также видим, что при более низкой температуре получается значительно больше конденсата. Для получения большего количества конденсата при эксплуатации газоконденсатного месторождения газ охлаждают.
Растворимость газов в жидкостях
Растворимость газов в жидкостях определяется по закону Генри устанавливающего зависимость между молярной концентрацией растворенного вещества и парциальным давлением пара под растворителем при постоянной температуре
![]()
где N – весовая концентрация газа растворенного в жидкости;
р – давление;
К – коэффициент растворимости зависящей от температуры;
х – количество растворенного газа.
Для многокомпонентных газов растворимость каждого отдельного компонента пропорциональна его парциальному давлению
![]()
где хi – количество компонента растворенного в жидкости;
Ni, Ki, pi – соответственно концентрация в растворе, коэффициент растворимости и парциальное давление в газовой фазе компонента.
Закон Генри не распространяется на газы и жидкости химически взаимодействующие. С ростом давления наблюдается отклонение от закона Генри т.к. в этом случае коэффициент растворимости уменьшается в значительной степени.
ЛЕКЦИЯ № 6
Термодинамические характеристики газа. Эффект Джоуля – Томпсона. Способы определения дифференциального и интегрального дроссель эффекта. Эффект Ранка.
