
- •Лекция №1
- •Классификация месторождений природного газа
- •Этапы разработки газовых и газоконденсатных месторождений
- •Режимы разработки месторождений природных газов
- •Особенности разработки газоконденсатных месторождений
- •Особенности притока газа к забою газовой скважины
- •Лекция 3
- •Состав и физико-химические свойства природных газов. Классификация природных газов
- •Газовые смеси. Плотность газов
- •Состав газовой смеси
- •Так появились уравнения состояния Битти - Бриджмена с пятью константами, Бенедикта – Вебба - Рубина с восемью константами и др.
- •Вязкость газов
- •Термодинамические характеристики газа
- •Классификация газовых топлив
- •Требования к качеству газового топлива
- •Опасные свойства природных газов
- •Взрывы газовоздушных смесей
- •Жидкие смеси. Состав и характеристика жидкой смеси
- •Объём паров после испарения жидкости
- •Фазовые состояния углеводородных систем. Словия равновесия двухфазной системы
- •Количественное решение двухфазной системы заключается в количественном распределении на паровую и жидкую фазы всех компонентов этой смеси при заданных давлении и температуре.
- •Упругость насыщенных паров
- •Термодинамические характеристики газа
- •Эффект Джоуля – Томсона
- •Эффект Ранка
- •Лекция №7
- •Лекция № 8
- •Состояние призабойной зоны пласта
- •Проницаемость призабойной зоны пласта
- •Классификация дисперсных систем по межфазному взаимодействию
- •Фильтрация дисперсных систем через пористые среды
- •Определение диаметра фонтанных труб газовой скважины
- •Принцип работы газлифта
- •Системы и конструкции газлифтных подъёмников
- •Разновидности газлифта, их технологические схемы
- •Преимущества и недостатки газлифтного способа добычи нефти
- •Оборудование газлифтных скважин
- •Пусковое давление
- •Методы снижения пускового давления
- •Газлифтные клапан
- •Тарировка газлифтных клапанов
- •Спуск и подъём съёмных клапанов, используемый инструмент
- •Торпедная перфорация
- •Сверлящая перфорация
- •3.Свабирование
- •4. Имплозия
- •Приборы для измерения давления
- •Устройства для измерения температуры
- •Устройства для измерения расхода природного газа
- •Подготовка скважины к газогидродинамическим исследованиям
- •Технология проведения исследований
- •Определение коэффициентов фильтрационного сопротивления "а" и "в"
- •Обработка результатов исследований газовой скважины на стационарных режимах
- •Пожары и фонтаны на нефтяных и газовых скважинах
- •Лекция №22
- •Средства и методы борьбы с пескопроявлением скважин
- •Лекция 23
- •Основные мероприятия по предупреждению и ликвидации обводнения газовых скважин
- •Классификация методов восстановления производительности обводняющихся скважин
- •Лекция №24
- •Лекция №25
- •8М-136 н2о или же м-17 н2о.
- •I – с4н817н2о,
- •Лекция №26
- •Основы ингибирования процесса гидратообразования
- •Ликвидация гидратов природных газов в газопроводах
- •Метод снижения давления в газопроводе
- •Метод устранения гидратов повышением их температуры
- •Устранение гидратных пробок с использованием ингибиторов гидратообразования
- •Метод сублимации гидрата
Лекция №26
Предупреждение и борьба с образованием гидратов природных газов. Основы ингибирования процесса гидратообразования. Физико-химические свойства ингибиторов гидратообразования. Методы ликвидации гидратных пробок
Применяемые в промысловой практике мероприятия по предупреждению и борьбе с образованием гидратов природного газа основаны на изменении энергетических соотношений молекул газа - гидратообразователя и воды. Для предупреждения и ликвидации гидратов природного газа в промысловой практике используются следующие методы:
- осушка газового потока от влаги методами сорбции или низкотемпературной сепарации с понижением точки росы по воде ниже минимальной температуры в технологическом процессе;
- ввод в газоводяной поток ингибиторов гидратообразования – спиртов и электролитов;
- поддержание температуры газового протока выше температуры гидратообразования;
- поддержание давления в газовом потоке выше давления гидратообразования.
Применение того или иного метода, их сочетания определяется технологическими возможностями и технико-экономическими расчётами. Наименьшее распространение в промысловой практике нашёл четвертый метод, поскольку в большинстве случаев нецелесообразно поддержание давления ниже равновесного из-за резкого снижения расхода газа. В основном он применяется при удалении образовавшихся гидратов в стволе скважины – путем продувки скважины в атмосферу.
Третий метод устранения гидратов наиболее эффективен при образовании их на дроссельных устройствах, в шлейфах и т.п. Он используется также и при прокладке шлейфов в грунтах с высоким коэффициентом теплопроводности (наличие малых депрессий между равновесной и технологической температурами) – используется теплоизоляция шлейфов. Второй метод реализуется, когда в стволе скважины, в промысловых коммуникациях при больших перепадах температур образуются гидраты. В этом случае применяют ввод ингибиторов (спиртов и электролитов) по замкнутому циклу с последующей их регенерацией.
Первый метод наиболее приемлем для условий магистрального транспорта природного газа. В частности, для газов с малым конденсатным фактором рациональнее использовать сорбционные методы осушки. Для понижения точки росы до минус 15 – 25 0С применяются жидкие сорбенты, а для более глубокой – твердые сорбенты. Если в газе повышенное содержание тяжелых углеводородов целесообразнее использование методов низкотемпературной сепарации с подачей ингибиторов гидратообразования и последующей их регенерацией.
Основы ингибирования процесса гидратообразования
Для предупреждения и борьбы с гидратами в промысловой практике широкое применение нашли растворы спиртов, электролитов и их смеси. Подача ингибитора в поток природного газа изменяет структурные параметры воды, снижая давление паров воды, и тем самым вызывает изменение равновесных условий гидратообразования.
Физическая сущность предотвращения образования гидратов путем осушки природного газа от влаги заключается в том, что удаляется один из компонентов реакции – жидкая вода. Химический потенциал молекул воды, содержащийся в газе, понижается настолько, что они не могут вступать в соединение с молекулами природного газа и образовать гидраты. При этом для ингибирования процесса гидратообразования в систему "газ – вода" вводится третий активный компонент, в результате чего изменяются условия термодинамического равновесия между молекулами воды и газа. Существует четкая зависимость между концентрацией раствора ингибитора – вода и температурой гидратообразования. Раствор природного газа в воде является раствором неполярного вещества в сильнополярном растворителе. Взаимодействие между молекулами газа и воды незначительно и обуславливается слабыми Ван-дер-Ваальсовыми силами. В пустотах, образованных структурой жидкой воды находятся молекулы газа. Введение ингибитора резко уменьшает растворимость газа в воде.
Применяемые в промысловой практике ингибиторы подразделяются на два основных класса: неорганические и органические вещества.
Неорганические вещества – это электролиты, водный раствор которых содержит не отдельные молекулы, а ионы, причем степень диссоциации, определена.
Неорганическое вещество (твердая соль или её концентрированный раствор), поступая в водный раствор газа, ионизируется, образуя при этом ионы с положительным и отрицательным зарядами, которые притягивают к себе диполи воды, окружая при этом ионы. Молекулярная структура раствора при высоких концентрациях соли, постепенно приближается к структуре кристаллогидрата соли. Взаимодействие между диполями воды и ионами ингибитора носит электростатический характер, обладая при этом более сильным взаимодействием между молекулами газа и воды. Существующая при этом квазикристаллическая структура воды нарушается, и растворимость газа падает. Данное явление называется высаливанием и проявляется, когда полярности компонентов раствора отличаются.
Органические вещества, используемые в качестве ингибиторов гидратообразования, представлены в основном метанолом и гликолями. Механизм действия органических веществ аналогичен вышеуказанному – они растворяют в себе воду, снижая её содержание в потоке газа. В результате это нарушаются благоприятные условия образования гидратов.
Физико-химические свойства ингибиторов
гидратообразования
Хлористый кальций- применяется 30 – 35 -ной % концентрации. Химическая формула хлористого кальция CаСL2. Молекулярная масса равна 111. Безводный хлористый кальций представляет собой кристаллы кубической формы белого цвета, сильно гигроскопические. Плотность хлористого кальция составляет 2,15 г/см3, температура плавления равна 7720С. Основные характеристики хлористого кальция приведены в таблице 6.
Метанол или метиловый спирт. Химическая формула СН3ОН, молекулярная масса32,04. Метанол - это низший одноатомный спирт, представляющий собой бесцветную жидкость со специфическим запахом, смешивающийся с водой в любых пропорциях. Общая характеристика метанола при нормальных условиях приведена в таблице 7.
Тройная точка метанола характеризуется следующими показателями: температура 97,56 0С, давление 0,00137 мм рт. ст. Показатель преломления при температуре 200С составляет n20= 1,3286. В таблице 8 приведены сведения об изменении плотности и вязкости метанола при отрицательных температурах.
Таблица 6. Свойства растворов хлористого кальция
|
Концентрация, % |
Плотность, г/см3 |
Температура, 0С |
Концентрация, % |
Плотность, г/см3 |
Температура, 0С | ||
|
замерзания |
кипения |
замерзания |
кипения | ||||
|
0,1 |
1,0 |
0,0 |
- |
27,5 |
1,26 |
минус 36,8 |
108,8 |
|
5,9 |
1,05 |
минус 3,0 |
- |
28,4 |
1,27 |
минус 43,6 |
109,4 |
|
11,5 |
1,10 |
минус 7,1 |
102,3 |
29,4 |
1,28 |
минус 50,1 |
110,0 |
|
16,8 |
1,15 |
минус 12,7 |
103,8 |
30,0 |
1,286 |
минус 55,0 |
110,3 |
|
21,9 |
1,20 |
минус 21,2 |
105,8 |
35,0 |
1,336 |
минус 20,0 |
114,4 |
|
26,6 |
1,25 |
минус 34,6 |
108,3 |
40,0 |
1,386 |
0 |
119,1 |
Таблица 7. Основные физические параметры метанола
|
Показатели |
Единицы измерения |
Значение |
|
Плотность |
г/см3 |
0,8100 |
|
Вязкость |
мПа·с |
0,8170 |
|
Температура : - вспышки - самовоспламенения |
0С |
8 464 |
|
Диэлектрическая проницаемость |
|
32,63 |
|
Пределы взрываемости паров с воздухом: - нижний - верхний |
Объёмный процент |
6,0 34,8 |
|
Температура: - кипения - плавления |
0С |
64,5 минус 97,5 |
|
Критические параметры: - давление - температура - плотность |
МПа 0С г/см3 |
7,87 240,0 0,272 |
Таблица 8. Плотность и вязкость метанола при отрицательных температурах
|
Температура, 0С |
Плотность, г/см3 |
Вязкость жидкости, мПа·с | |
|
жидкости |
пара | ||
|
0 |
0,8100 |
5,620·10-5 |
0,82 |
|
минус 10 |
0,8190 |
4,151·10-5 |
0,97 |
|
минус 20 |
0,8290 |
2,535·10-5 |
1,16 |
|
минус 30 |
0,8390 |
1,535·10-5 |
1,39 |
|
минус 40 |
0,8470 |
9,517·10-6 |
1,75 |
|
минус 50 |
0,8580 |
6,235·10-6 |
2,26 |
|
минус 60 |
0,8670 |
3,819·10-6 |
2,98 |
|
минус 70 |
0,8760 |
2,430·10-6 |
4,02 |
|
минус 80 |
0,8860 |
1,501·10-6 |
5,70 |
С ростом температуры поверхностное натяжение метанола уменьшается (таблица 9).
Таблица 9. Изменение поверхностного натяжения метанола от температуры
|
Температура, 0С |
0 |
10 |
20 |
30 |
40 |
50 |
60 |
|
Поверхностное натяжение, σ 10 -3Дж/м2 |
24,5 |
23,5 |
22,6 |
21,8 |
20,9 |
20,1 |
19,3 |
Зависимость температуры замерзания растворов метанола от его концентрации представлена в таблице 10.
Таблица 10. Температура замерзания раствора метанола при изменении его концентрации
|
Показатели |
Концентрация метанола, массовый процент | |||||||||||
|
10 |
20 |
30 |
40 |
50 |
70 |
80 |
85 |
90 |
95 |
97,5 |
100 | |
|
Температура замерзания, 0С (минус): начало конец |
7,5 8,0 |
18,5 20,3 |
31,5 35,0 |
40,7 54,0 |
72,5 96,0 |
87,0 116,0 |
102,5 122,0 |
115,0 137,0 |
128,0 137,0 |
121,8 132,0 |
109,0 113,0 |
97,8 97,8 |
Коэффициент объёмного расширения метанола при температуре 20 0С составляет β = 1,199·10-3К– 1, и его изменение в интервале температур от 0 до 600С определяют по уравнению следующего вида:
β= 1,1342·10 –3+ 1,13635·10–5 t+ 0,8741·10–8 t2, (41)
где t– температура метанола,0С.
Изменение молярной теплоёмкости жидкого метанола в интервале температур от 0 до 50 0С определяют по уравнению
Cp= 18,224 + 0,04486t, (42)
где Cp– молярная теплоёмкость метанола.
Метанол-сырец и метанольная фракция – технические сорта метанола, получаемые в качестве побочных продуктов при производстве метанола (1-й сорт) и на гидролизных заводах при очистке этилового спирта-сырца (2-й сорт или метанол-сырец). Основные свойства метанола-сырца приведены в таблице 11.
Таблица 14.11.Свойства метанола – сырца
|
Показатели |
1 сорт |
2 сорт |
|
Внешний вид |
Бесцветная жидкость |
Бесцветная или слабожелтая жидкость |
|
Плотность при 15 0С, г/см3 |
0,793 |
0,830 |
|
Содержание метанола, объёмные проценты (не менее) |
84,0 |
84,0 |
|
Содержание воды, объёмные проценты (не менее) |
1,5 |
12,0 |
Гликоли – в качестве ингибиторов гидратообразования в газовой промышленности применяют: этиленгликоль (ЭГ), диэтиленгликоль (ДЭГ) и триэтиленгликоль (ТЭГ). Данные абсорбенты используются в основном в качестве сорбентов влаги при осушке природного газа.
Этиленгликоль – химическая формула С2Н4(ОН)2, молекулярная масса 62,07; бесцветная, вязкая жидкость без запаха, трудно загорается, горит спокойным голубым пламенем, хорошо растворяется в воде, низших спиртах, ацетоне. Упругость паров этиленгликоля рассчитывается по уравнению следующего вида:
![]() (43)
(43)
где Т – абсолютная температура,
К; А и В – константы, значения которых в зависимости от температуры приведены в таблице 12.
Таблица 12. Изменение коэффициентов А и В от температуры
|
Интервал изменения температуры, К |
Коэффициент А |
Коэффициент В |
|
363 - 403 |
9,7423 |
3193,6 |
|
403 - 470 |
9,2477 |
2994,2 |
Диэтиленгликоль. Химическая формула (СН2ОНСН2)2·О, молекулярная масса 106,12, бесцветная вязкая жидкость, легко смешивающаяся с водой, низшими спиртами и этиленгликолем.
Зависимость вязкости ДЭГ от давления определяется по уравнению вида:
μр= μо·(1 + α·Р), (44)
где μри μо– вязкость при избыточном и атмосферном давлении соответственно;
α·- коэффициент, являющийся функцией давления, температуры и концентрации,
Р – давление.
В интервале температур от минус 17 до 50 0С и давлений от 0 до 13 МПа значения коэффициента α приведены в таблице13.
Таблица 13. Изменения коэффициента α в зависимости от концентрации ДЭГ
|
Показатель |
Концентрация ДЭГ, объёмные проценты | ||
|
100 |
80 |
60 | |
|
α ·103 |
0,98 |
0,95 |
0,92 |
Вязкость растворов ДЭГ с понижением температуры значительно увеличивается.
Триэтиленгликоль. Химическая формула (СН2ОСН2СН2ОН)2, молекулярная масса 150,17; прозрачная бледно-желтая жидкость со слабым запахом. ТЭГ менее летуч, чем ДЭГ. Основные свойства гликолей приведены в таблице 14.
Таблица 14. Основные физико-химические свойства ЭГ, ДЭГ и ТЭГ
|
Показатели |
ЭГ |
ДЭГ |
ТЭГ |
|
Молекулярная масса |
62,07 |
106,20 |
150,17 |
|
Температура кипения, 0С при давлении: - 0,1000 МПа - 0,0650 МПа - 0,0013 МПа |
198 123 91 |
245 164 128 |
287 198 162 |
|
Температура замерзания 0С |
минус 12,6 |
минус 9,0 |
минус 7,6 |
|
Плотность при 20 0С, г/см3 |
1,110 |
1,116 |
1,126 |
|
Температурные пределы кипения при давлении 0,1МПа, 0С: - начало кипения - конец кипения |
193 200 |
240 250 |
275 284 |
|
Вязкость при температуре 20 0С, мПас |
20,9 |
35,7 |
47,8 |
|
Коэффициент рефракции при 20 0С |
1,4316 |
1,4472 |
1,4559 |
|
Удельная теплоёмкость при 20 0С, кДж/кг |
2,34 |
2,10 |
2,20 |
|
Поверхностное натяжение при 20 0С, 10-3 Дж/м2 |
46,49 |
48,50 |
45,20 |
|
Скрытая теплота парообразования при 0,1 МПа, кДж/кг |
798 |
627 |
416 |
|
Температура воспламенения, 0С: - в открытом тигле - в закрытом тигле - на воздухе |
115,0 111,1 — |
143,0 123,9 350,5 |
165,5 155,1 173,9 |
С увеличением молекулярной массы гликолей их вязкость возрастает.
Этилкарбитол (ЭК) - побочный продукт производства гликолей, представляющий собой прозрачную, бесцветную или слегка темноватую жидкость с температурой замерзания минус 60 0С. Осредненный состав и основные физические свойства этилкарбитола приведены в таблице 15.
Таблица 15. Основные характеристики этилкарбитола
|
Показатели |
Размерность |
Значение |
|
Состав этилкарбитола : - моноэтиловый эфир ДЭГ - этиленгликоль - диэтиленгликоль - этилцеллозоль - пропиленгликоль |
массовый процент |
51,40 46,15 1,13 0,18 0,94 |
|
Плотность при температуре 20 0С |
г/см3 |
0,9898 |
|
Температура кипения при давлении: - 0,1000 МПа - 0,0650 МПа - 0,0013 МПа |
0С |
201,9 121,0 87,0 |
|
Вязкость при температуре 20 0С |
мПа·c |
4,5 |
|
Коэффициент рефракции при температуре 20 0С |
б/з |
1,4273 |
|
Удельная теплоёмкость при температуре 20 0С |
кДж/(кг·0С) |
2,3 |
|
Температура вспышки в открытом тигле |
0С |
90 |
Эфироальдегидная фракция (ЭАФ) – побочный продукт производства синтетического этанола из этилена, нетоксичен. Состав ЭАФ включает в себя следующие компоненты, массовый процент: этиловый спирт - 63,0; диэтиловый спирт - 33,0; ацетальдегид - 0,7; вода – 3,3.
Снижение равновесной температуры гидратообразования при использовании ЭАФ ( в пределах 5 – 20 %) можно определить по уравнению вида
Δt = 0,47·C1,06 , (45)
где C – массовая концентрация водного раствора ЭАФ, %.
Гликоли являются веществами с относительно низкой токсичностью. Из-за малой летучести гликолей при комнатной температуре опасности острого отравления при вдыхании их паров не существует. Попадая в организм через органы дыхания, гликоли представляют большую опасность, поскольку воздействуют на центральную нервную систему.
Определение потребного количества ингибитора
Для определения потребного количества нелетучего ингибитора гидратообразования требуются следующие исходные данные:
- количество воды, содержащийся в жидком состоянии и конденсирующейся на участке шлейфа, где существуют условия гидратообразования (mв);
- значения равновесной температуры гидратообразования (tр);
- знание фактической температуры газа в шлейфе (tг).
Гидратообразование возможно только при выполнении условия, что tг≤ tр. Необходимое снижение температуры гидратообразования определяется из условия Δt = tр- tг. По полученному значению Δt с использованием зависимостей, приведенных на рисунке 18, приближенно определяется потребная концентрация ингибиторов в водном растворе, обеспечивающая необходимое снижение температуры образования гидратов при заданной массовой концентрации выводимого раствора ингибитора.
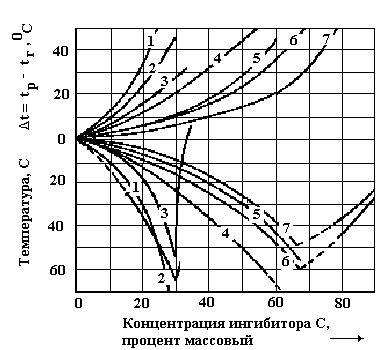
Рисунок 18. Влияние массовой концентрации ингибиторов на понижение температуры гидратообразования и замерзании их водных растворов:
1 -
![]() ;
2 -
;
2 -![]() ;
;
3 -
![]() ;
4 -
;
4 -![]() ;
5 – ЭК; 6 - ЭГ; 7 – ДЭГ
;
5 – ЭК; 6 - ЭГ; 7 – ДЭГ
Удельный расход нелетучего ингибитора расход нелетучего ингибитора определяют исходя из материального баланса по уравнению следующего вида:
![]() ,
(46)
,
(46)
где W1– влагосодержание природного газа, поступающего в шлейф, г/м3;
W2– влагосодержание природного газа из шлейфа в точке гидратообразования, г/м3;
С1и С2– массовая концентрация вводимого и выводимого растворов ингибитора, %.
При определении влагосодержания газа, поступающего в газопровод, следует учитывать не только пары воды, но и жидкую и капельно-пленочную фазы, находящиеся в газопроводе. В случае отрицательных рабочих температур природного газа обязательно осуществлять проверку возможности замерзания раствора ингибитора. При условии, что температура замерзания раствора ингибитора выше температуры газа, потребный объём ингибитора должен быть таким, чтобы не допустить его замерзание. При применении растворов электролитов, необходимо учитывать массу воды, подаваемой в газопровод вместе с ингибитором.
Применение того или иного ингибитора гидратообразования снижает температуру гидратообразования в скважине, снимая тем самым ограничения, обусловленные температурным режимом работы скважины.
Величина понижения равновесной температуры ΔΤ для метанола ЭГ и ДЭГа определяется из выражения следующего вида
![]() (47)
(47)
где G- весовая концентрация отработанного ингибитора,% ;
М – молекулярная масса ингибитора;
К – коэффициент, определяемый экспериментально.
Значения молекулярной массы и экспериментального коэффициента приведены в таблице 16.
Таблица 16. Значения молекулярной массы и экспериментального коэффициента
|
Показатель |
Ингибитор гидратообразования | ||
|
Метанол |
ЭГ |
ДЭГ | |
|
Молекулярная масса |
32 |
62 |
106 |
|
К |
1295 |
1220 |
2430 |
Для хлористого кальция величину понижения температуры ΔΤ определяется из эмпирической формулы следующего вида
![]() (47)
(47)
Количество ингибитора подаваемого в скважину определяется с учётом влагосодержания газа в пластовых и устьевых условиях производительностью скважины и необходимой концентрации ингибитора из выражения:
![]() (48)
(48)
где Qн.и.- расход
летучего ингибитора,![]() ;
;
![]() ,
,![]() - влагосодержание газа до ввода ингибитора
в пластовых и устьевых условиях;
- влагосодержание газа до ввода ингибитора
в пластовых и устьевых условиях;
![]() ,
,![]() - массовые концентрации свежего и
отработанного ингибитора.
- массовые концентрации свежего и
отработанного ингибитора.
Следует отметить, что на установках регенерации получают метанол с концентрацией не свыше 96 %.
Расход ингибитора гидратообразования с учётом влагосодержания газа, концентрации и количества ингибитора, растворенного в конденсате и переходящего в газовую фазу можно вычислить по выражению следующего вида
![]() (49)
(49)
где![]() -
расход ингибитора,
-
расход ингибитора,![]() ;
;
С1, С2– начальная и требующая для предупреждения гидратообразования концентрация ингибитора, процент массовый;
![]() - количество ингибитора переходящего
в газовую фазу и растворенное в
углеводородном конденсате соответственно,
- количество ингибитора переходящего
в газовую фазу и растворенное в
углеводородном конденсате соответственно,![]() .
.
Концентрация ингибитора, обеспечивающая необходимое снижение температуры гидратообразования определяется по графической зависимости приведенной на рисунке 19.

Рисунок 19. Зависимость снижения температуры гидратообразования от концентрации ингибитора
1 – хлористый кальций; 2 – метанол; 3 – ТЭГ; 4 - ДЭГ; 5 – ЭГ
Количество ингибитора переходящего в газовую фазу по выражению следующего вида
![]() (50)
(50)
где α – коэффициент распределения, т.е. отношение содержания метанола в газовой среде, необходимого для насыщения газа, к концентрации метанола в растворе, определяется из выражения следующего вида
![]() (51)
(51)
здесь Р – давление в системе, МПа;
Т – температура, К.
Величина количества ингибитора gкрастворенного в углеводородном конденсате определяется из выражения
![]() (52)
(52)
где Ск– растворимость ингибитора в углеводородном конденсате, процент массовый;
qк– удельный выход нестабильного
конденсата,![]() .
.
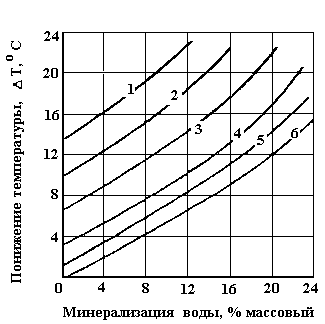
В случае содержания в скважинной продукции, минерализованной пластовой воды, концентрация метанола подбирается такой, при которой не происходит выпадение кристаллической соли из-за ингибирования (см. рисунок 20).
Рисунок 20. Понижение температуры гидратообразования от минерализации воды при различном содержании метанола в пластовой воде
1 6 - соответственно при содержании метанола (СН3ОН) в воде 25, 20, 15, 10, 6 и 0 процентов
Суточный расход ингибитора гидратообразования можно рассчитать по формуле следующего вида
![]() (53)
(53)
где Qг– дебит газовой скважины, тыс.м3/сут.
Следует отметить, что при образовании гидратов в стволе скважины ингибитор гидратообразования следует, вводим из расчёта обеспечения безгидратного режима работы как самой скважины, так её шлейфа.
Подача ингибитора гидратообразования может осушествлятся как раздельно в скважину и шлейф, так и совместно.
В промысловой практике подача ингибитора гидратообразования в большинстве случаев принудительная с помощью дозировочных насосов расположенных на территории УКПГ или СП.
Методы ликвидации гидратных пробок
Выбор метода ликвидации гидратов зависит от места их образования (накопления), количеством и характером гидратной пробки, составом гидрата и имеющимися в наличии средствами их ликвидации.
Требования к проведению работ по ликвидации гидратов
1. Образованию сплошной гидратной пробки, перекрывающей полное сечение аппарата или трубопровода в системе добычи и транспорта природного газа, необходим постоянный контроль за работой технологического оборудования, особенно в пусковой период времени (пониженные участки прокладки шлейфов и газопромысловых коммуникаций; места дросселирования газа; участки с параметрами природного газа, близкими к условиям существования гидратов). Процесс накопления гидратов на каком-либо участке характеризуется основным параметром - ростом перепада давления на нём.
2. После определения места накопления сплошной гидратной пробки следует приступить к нарушению её сплошности либо путем нагрева данного участка шлейфа или газопромысловых коммуникаций, либо путем подачи ингибитора. Разрушение гидратной пробки производят первоначально с её крыльев. Не следует осуществлять подогрев или подачу ингибитора в сплошное тело гидратной пробки. В этом случае произойдет разложение гидрата в замкнутом объёме, что ведет к резкому локальному росту давления и как следствие – разрыву газопровода.
3. При температурах, близких к нулю 0С, снижение давления на участке с гидратной пробкой осуществляют только после подачи определенного количества теплоносителя или ингибитора гидратообразования. Данный технологический приём позволяет избежать снижения температуры до нуля0С, позволяет избежать замерзания воды, выделившейся при разложении гидратов.
4. При всех случаях устранения гидратных пробок, образованных за счёт накопления воды (кроме метода сублимации), первоначально следует удалить воду с нижней части газопровода с минимальной отметкой и только после этого ликвидировать гидраты.
5. Для исключения замерзания воды и растворов ингибиторов в газопроводе в зимний период ликвидацию гидратных пробок следует осуществлять в наикратчайшие сроки.
Устранение гидратов в стволе скважины с использованием твердых химических реагентов
Гидратные пробки, частично перекрывающие сечение скважины, устраняются проточной промывкой ствола скважины метанолом, подогретым раствором хлористого кальция или горячей водой без остановки скважины.
Гидратные пробки, полностью перекрывающие сечение только фонтанных труб или затрубного пространства, устраняются разогревом при подводе тепла через сечение свободное от гидратов, посредством подачи жидких теплоносителей.
Рассмотрим тепловые методы устранения сплошной гидратной пробки в стволе скважины. Наиболее часто используется метод получения тепла, выделяющегося за счёт химической реакции твердого реагента, спускаемого в скважину через лубрикатор и реагирующего при непосредственном контакте с гидратами. Для этих целей в промысловой практике применяют твердый пятихлористый фосфор PCl5и фосфорный ангидрит P2O5, которые помещаются в цилиндрическую капсулу, изготовленную из металлической магниевой фольги. Капсула полностью растворяется в продуктах реакции реагента с водой, появляющейся при разложении гидратов.
Конструкция капсулы в нижней части выполнена с "окном", изготовленным из водорастворимого вещества, в частности, из металлического кальция. Толщина "окна" зависит от скорости его растворения в воде и времени движения капсулы от устьевого лубрикатора до поверхности гидратной пробки, находящейся в стволе скважины. После растворения "окна" реагент вступает в реакцию с водой и развивается экзотермическая реакция с выделением тепла около 3 МДж/кг вещества. Перед спуском капсулы газовую скважину заполняют до устья водой для обеспечения плавного погружения её до поверхности гидратной пробки. В процессе прохождения капсулы по стволу скважины происходит растворение "окна" и в момент достижения ею поверхности гидрата происходит экзотермическая реакция по уравнению вида
РCl5+ 4H2O→H3РО4 + 5НСl + 514 кДж. (54)
Одновременно с этим растворяется магниевый цилиндрический корпус капсулы в образовавшейся фосфорной кислоте:
Mg + H3РО4→ MgHРО4+ Н2↑ (55)
Магний образует со стальной трубой гальваническую пару, в которой он служит катодом. В ходе этого процесса расходуется фосфорная кислота, и он полностью растворяется снижая тем самым коррозионную опасность. Полное растворение капсулы позволяет в последующем повторять этот процесс до полного растворения гидратной пробки.
Тепловой размыв сплошной гидратной пробки
Так отмечалось ранее, размыв сплошной гидратной пробки обычно осуществляется промывкой горячим теплоносителем (пар, вода, раствор хлористого кальция и т.д.). Технологическая схема проведения данной операции приведена на рисунок 21.
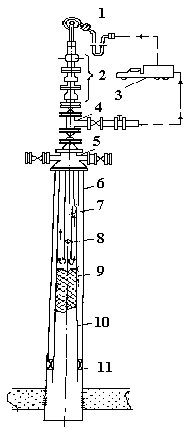
Рисунок 21. Принципиальная схема оборудования скважины при ликвидации сплошной гидратной пробки в НКТ путем закачки теплоносителя:
1 – вертлюг; 2 – противовыбросовая арматура; 3 – пароподогревающая установка; 4 – фонтанная арматура; 5 – колонная головка; 6 – обсадная колонна; 7 – промывочные трубы; 8 – обратный клапан; 9 – гидрат; 10 – насосно-компрессорные трубы; 11 - пакер
Последовательность работ по тепловому размыву сплошной гидратной пробки сводится к следующему. На центральную верхнюю задвижку фонтанной арматуры устанавливают специальную противовыбросовую арматуру. К вертлюгу агрегата А-50 присоединяются промывочные трубы через переводник, внутри которого устанавливают обратный клапан шарикового типа. На первой промывочной трубе снизу колонны устанавливается обратный клапан для предотвращения открытого фонтанирования при прогреве. Поток горячего теплоносителя, поступающий в трубное пространство промывочной колонны, контактируя с гидратами, расплавляет их и выносит на поверхность по межтрубному пространству. По завершению работ по ликвидации гидратной пробки, скважину глушат для извлечения промывочных труб.
В процессе эксплуатации высокотемпературных залежей, расположенных в зоне мерзлых пород, возможно образование гидратов в приустьевой части ствола скважины. Образование гидратов обусловлено значительным температурным перепадом между призабойной и приустьевой зонами скважины. Ликвидация гидратов в данном случае осуществляется за счёт тепла конденсации летучих компонентов (например, пропана). Определенная порция теплоносителя вводится в отсеченное пакером затрубное пространство и далее, попадая в призабойную высокотемпературную зону, пропан вскипает и его пары, поднимаясь в приустьевую охлажденную зону, конденсируются и стекают вниз по поверхности труб, отдавая им тепло конденсации. В результате этого тепло передается через стенки трубы к гидратам, способствуя их разложению.
Применение электронагревателей для ликвидации
гидратов в скважинах
Ликвидация крупных гидратных пробок в скважинах возможна за счёт применения малогабаритных электронагревателей. Основные требования, предъявляемые к выбору электронагревателя, сводятся к следующему:
-наружный диаметр электронагревателя не должен превышать 45 мм;
-оптимальная мощность электронагревателя не должна превышать 10 кВт;
-возможность получения максимально высокой температуры в торцевой части электронагревателя при контакте с гидратной пробкой;
-работоспособность электронагревателя и присоединяемых к нему элементов в условиях высоких давлений (до 30 МПа) в присутствии высокоминерализованной пластовой воды и высокой газонасыщенности.
П ринципиальная
схема малогабаритного электронагревателя
диаметром 38 – 44 мм, длиной 1100 мм, весом
10 кг, мощностью 10 кВт, с рабочим напряжением
110 V и силой тока 30 А приведена на рис.
22.
ринципиальная
схема малогабаритного электронагревателя
диаметром 38 – 44 мм, длиной 1100 мм, весом
10 кг, мощностью 10 кВт, с рабочим напряжением
110 V и силой тока 30 А приведена на рис.
22.
Рисунок 22. Малогабаритный термический электронагреватель:
1 – шайба; 2 – гайка; 3 – текстолитовая шайба; 4 – резиновое уплотнение; 5 – нижний штекер;6, 7, 10, 14 – фарфоровые изоляторы;8 – разъединитель; 9 – фарфоровая шайба;
11 – фарфоровая крошка; 12 – спираль;14 – корпус нагревателя; 15 – стержень
Однофазный трубный электронагреватель состоит из двух основных частей: разделки кабеля с верхним штекерным соединением и собственно нагревателя с нижним штекерным соединением. Его корпус в верхней своей части соединяется с разъединителем, а в нижней заканчивается головкой (концентратором тепла). Базовым нагревательным элементом является спираль из нихрома или ферхали. В нижней части электронагревателя находится специальный стержень, выполненный из материала, обладающего хорошей теплопроводностью – концентратор тепла на рабочей головке, способствующий интенсивной передаче тепла от спирали к головке. Герметичность электронагревателя обеспечивается резиновыми уплотнителями.
Спуск электронагревателя в скважину осуществляют через специальный лубрикатор на кабеле-тросе. Источником электроэнергии служит электрогенератор переменного тока мощностью 30 кВт, смонтированный на передвижном прицепе.
