
- •Лекция №1
- •Классификация месторождений природного газа
- •Этапы разработки газовых и газоконденсатных месторождений
- •Режимы разработки месторождений природных газов
- •Особенности разработки газоконденсатных месторождений
- •Особенности притока газа к забою газовой скважины
- •Лекция 3
- •Состав и физико-химические свойства природных газов. Классификация природных газов
- •Газовые смеси. Плотность газов
- •Состав газовой смеси
- •Так появились уравнения состояния Битти - Бриджмена с пятью константами, Бенедикта – Вебба - Рубина с восемью константами и др.
- •Вязкость газов
- •Термодинамические характеристики газа
- •Классификация газовых топлив
- •Требования к качеству газового топлива
- •Опасные свойства природных газов
- •Взрывы газовоздушных смесей
- •Жидкие смеси. Состав и характеристика жидкой смеси
- •Объём паров после испарения жидкости
- •Фазовые состояния углеводородных систем. Словия равновесия двухфазной системы
- •Количественное решение двухфазной системы заключается в количественном распределении на паровую и жидкую фазы всех компонентов этой смеси при заданных давлении и температуре.
- •Упругость насыщенных паров
- •Термодинамические характеристики газа
- •Эффект Джоуля – Томсона
- •Эффект Ранка
- •Лекция №7
- •Лекция № 8
- •Состояние призабойной зоны пласта
- •Проницаемость призабойной зоны пласта
- •Классификация дисперсных систем по межфазному взаимодействию
- •Фильтрация дисперсных систем через пористые среды
- •Определение диаметра фонтанных труб газовой скважины
- •Принцип работы газлифта
- •Системы и конструкции газлифтных подъёмников
- •Разновидности газлифта, их технологические схемы
- •Преимущества и недостатки газлифтного способа добычи нефти
- •Оборудование газлифтных скважин
- •Пусковое давление
- •Методы снижения пускового давления
- •Газлифтные клапан
- •Тарировка газлифтных клапанов
- •Спуск и подъём съёмных клапанов, используемый инструмент
- •Торпедная перфорация
- •Сверлящая перфорация
- •3.Свабирование
- •4. Имплозия
- •Приборы для измерения давления
- •Устройства для измерения температуры
- •Устройства для измерения расхода природного газа
- •Подготовка скважины к газогидродинамическим исследованиям
- •Технология проведения исследований
- •Определение коэффициентов фильтрационного сопротивления "а" и "в"
- •Обработка результатов исследований газовой скважины на стационарных режимах
- •Пожары и фонтаны на нефтяных и газовых скважинах
- •Лекция №22
- •Средства и методы борьбы с пескопроявлением скважин
- •Лекция 23
- •Основные мероприятия по предупреждению и ликвидации обводнения газовых скважин
- •Классификация методов восстановления производительности обводняющихся скважин
- •Лекция №24
- •Лекция №25
- •8М-136 н2о или же м-17 н2о.
- •I – с4н817н2о,
- •Лекция №26
- •Основы ингибирования процесса гидратообразования
- •Ликвидация гидратов природных газов в газопроводах
- •Метод снижения давления в газопроводе
- •Метод устранения гидратов повышением их температуры
- •Устранение гидратных пробок с использованием ингибиторов гидратообразования
- •Метод сублимации гидрата
Взрывы газовоздушных смесей
Если способная воспламениться горючая газовоздушная смесь находится в замкнутом объёме, например в помещении, аппарате или трубопроводе достаточно большого диаметра, то при появлении в какой-либо точке этого объёма открытого пламени, электрической искры или нагретого тела, температура которого достаточна для воспламенения газа, происходит взрыв. Взрыв представляет собой явление чрезвычайно быстрого воспламенения и сгорания сразу всего объёма имеющейся газовоздушной смеси. Взрываться может не только газообразное топливо. При определенных условиях могут происходить взрывы смесей паров жидких горючих веществ с воздухом и взвешенной в воздухе пыли твердых горючих веществ.
Быстрое сгорание топлива при взрыве сопровождается очень быстрым повышением температуры и, как следствие,
скачкообразным повышением давления нагретых газов. Это практически мгновенное и резкое увеличение давления в замкнутом объеме, который занимала горючая смесь до взрыва, может привести к разрушительным последствиям. Давление, возникающее при взрыве газовоздушных смесей, может доходить до 0,7 - 0,8 МПа, если эти смеси до взрыва находились при нормальном атмосферном давлении. Если газовоздушная смесь до взрыва уже находилась при повышенном давлении, то давление при взрыве будет настолько более высоким, насколько давление смеси было - выше нормального. При взрывах газокислородных смесей давления могут быть значительно более высокими, чем при взрывах газовоздушных смесей.
Величину давления, развивающегося при взрыве газовоздушной смеси, можно определить, пользуясь формулой:
 (7)
(7)
где Рвзр- абсолютное давление при взрыве, МПа;
Рнач - начальное абсолютное давление смеси, МПа;
tвзр- температура, развивающаяся при взрыве, пределом которой являются максимальные величины;
tнач- начальная температура газовоздушной смеси; °С;
m - число объёмов (м3) продуктов сгорания газа с учётом азота воздуха ;
n -число объёмов (м3) газовоздушной смеси до взрыва, также с учётом азота воздуха.
Так как, максимальные температуры горения практически не достигаются, а смесь газа с воздухом лишь случайно может оказаться такой, что в ней не будет ни избытка, ни недостатка воздуха по сравнению с теоретическим количеством, то фактическое давление при взрывах газа будет меньше максимально возможного, т. е. 0,7 – 0,8 МПа. Особенно опасными в отношении взрыва являются газы с более низкими нижними пределами взрываемости, так как в этом случае при прочих равных условиях скорее образуется газовоздушная смесь, способная воспламениться. При близких величинах нижних пределов взрываемости двух газов опаснее тот, у которого шире область взрываемости и ниже температура воспламенения.
Для углеводородных газов Cm·Hnуравнение химической реакции горения их в кислороде имеет вид
![]() (8)
(8)
где m- количество атомов углерода в углеводородном газе;
n – количество атомов водорода в газе;
![]() - количество кислорода необходимое для
полного сгорания газа.
- количество кислорода необходимое для
полного сгорания газа.
Согласно формуле (8) уравнение горения горючих газов будет:
метана СН4 + 2·О2 = СО2 + 2·Н2О
этана С2 Н16 + 3,5·О2 = 2·СО2 + 3·Н2О
бутана С4 Н10 + 6,5·О2 = 4·СО2 + 5·Н2О
пропана С2 Н8 + 5·О2 = 3·СО2 + 4·Н2О
пентана С5 Н12 + 8·О2 = 5·СО2 + 6·Н2О
В практических условиях сжигания газа кислород берется не в чистом виде, а как компонент входящий в состав воздуха.
Поскольку воздух состоит по объёму на 79 % из азота и на 21 % из кислорода то на каждый объём кислорода требуется 100 : 21 = 4,76 объёма воздуха или 79 : 21 = 3,76 объёма азота.
Таким образом, реакцию горения метана в воздухе можно описать уравнением вида
СН4+ 2·О2+2· 3,76·N2= СО2+ 2·Н2О + 7,5·N2.
Из полученного уравнения видно, что для сжигания 1 м3метана потребуется 2 м3 кислорода и 7,52 азота или 2 + 7,52 = 9,52 м3воздуха (см. таблицу 6).
Токсические и удушающие свойства газов
Природные газы (метан, этан, пропан, бутан и др.), кроме тех, которые содержат заметные количества сероводорода, как правило, не токсичны. Однако при больших концентрациях природного газа в воздухе ощущается недостаток кислорода вплоть до удушающего действия. При понижении содержания кислорода во вдыхаемом воздухе наблюдаются следующие физиологические состояния: при 17 % - одышка и сердцебиение, при 12 % - сильно стесненное дыхание, при 9 % - обморочное состояние. Гомологи метана - этан, пропан, бутан, также содержащиеся в природных газах, действуют на человека слегка наркотически.
В продуктах горения любых горючих газов, в том числе и природных и сжиженных, содержащих углеродистые соединения, в случае недостатка воздуха для полного сгорания и при нарушениях условий правильного сжигания появляется окись углерода. Окись углерода - чрезвычайно сильный отравляющий газ. Поэтому продукты сгорания газового топлива, как твердого, так и жидкого, могут быть токсически весьма опасными. Это надо иметь в виду особенно в тех случаях, когда у агрегатов, использующих газовое топливо, продукты сгорания выводятся не во внешнюю атмосферу, а непосредственно в производственное помещение. На добывающих предприятиях работают небольшие печи. и котлы. При сжигании углеводородных топлив при температуре свыше 1500 0С образуются весьма вредные для человека окислы азота. Их содержание в воздухе из-за большой ядовитости должно быть предельно ограничено.
Таблица 6 - Количество кислорода и воздуха при сжигании газов
|
Газы |
Для сжигания 1 м3требуется газа, м3 |
При сжигании 1 м3газа выделяется, м3 |
Теплота сгорания низшая, Qн, кДж/м2 | ||||
|
кислород |
воздух |
Углекислый газ |
Водяные пары |
азот |
всего | ||
|
Водород |
0,5 |
2,38 |
- |
1 |
1,88 |
2,88 |
10806 |
|
Оксид углерода |
0,5 |
2,38 |
1 |
- |
1,88 |
2,88 |
12637 |
|
Метан |
2,0 |
9,52 |
1 |
2 |
7,52 |
10,52 |
35825 |
|
Этан |
3,5 |
16,66 |
2 |
3 |
13,16 |
18,16 |
63797 |
|
Пропан |
5,0 |
23,88 |
3 |
4 |
18,80 |
15,80 |
91310 |
|
Бутан |
6,5 |
20,94 |
4 |
5 |
24,44 |
34,44 |
11874 |
Степень действия некоторых газов характеризуется данными, представленными в таблице 7.
Таблица 7 - Степень действия вредных газов на человека
|
Длительность и характер действия |
Содержание вредных газов в воздухе, объёмн. процент | |||
|
СО |
SO2 |
H2S |
NO2 | |
|
Несколько часов без заметного действия |
0,0100 |
0,0025 |
0,0015 |
0,0008 |
|
Признаки легкого отравления или раздражения слизистой оболочки через 2 – 3 ч. |
0,010 – 0,050 |
0,0050 |
0,005-0,008 |
0,001 |
|
Возможно серьёзное отравление через 30 мин. |
0,200 – 0,300 |
0,008 – 0,015 |
0,02 – 0,03 |
0,005 |
|
Опасно для жизни при кратковременном действии |
0,500 – 0,800 |
0,060 |
0,050 |
0,015 |
В целях предотвращения вредного воздействия окиси углерода и других токсических газов на людей установлены пределы максимального содержания вредных газов в воздухе помещений.
Предельно допустимое содержание газов в воздухе рабочей зоны производственных помещений установлено
Окись углерода .............. 20
Сернистый газ .............. 10
Сероводород ............... 10
Окислы азота
(в пересчёте на NO2) ...... 5
Углеводороды предельные
(в пересчете на С) . . 300
При длительности работы не более 1 ч концентрация окиси углерода может быть до 50 мг/м3, не более 30 мин - до 100 мг/м3.
ЛЕКЦИЯ 5
Универсальное уравнение состояния реальных газов. Методы определения коэффициента сжимаемости газа. Газовые конденсаты. Жидкие смеси. Состав и характеристика жидкой смеси. Объём паров после испарения жидкости. Содержание тяжелых углеводородов в газе. Фазовые состояния углеводородных систем. Условия равновесия двухфазной системы. Количественное решение двухфазной системы .Упругость насыщенных паров. Явления обратной конденсации и испарения. Упругость насыщенных паров. Растворимость газов в жидкостях.
Универсальное уравнение состояния газа мы с Вами рассмотрели в лекции 3. Помимо этого ознакомимся с уравнением состояния газа с вириальными коэффициентами
![]() (1)
(1)
В этом уравнении коэффициент сверхсжимаемости Z приведён в виде степенного ряда. В, С, D – соответственно двойной тройной и четверной вириальные коэффициенты являющиеся функцией только температуры и зависящие в основном от молекулярных взаимодействий, в которых одновременно участвуют соответственно две, три и четыре молекулы газа. Определять вириальные коэффициенты и коэффициенты сверхсжимаемости можно более точно только для газов состоящих из простых молекул, например, кислород азот.
Согласно молекулярно-кинетической теории с помощью коэффициента учитываются силы взаимодействия молекул Z. Причём если Z < 1 то преобладают силы притяжения если же Z > 1 то преобладают силы отталкивания, при Z = 1 состояние молекулярных сил равновесное.
На рисунке 1 представлен характер изменения поведения коэффициента сверхсжимаемости в зависимости от давления при постоянной температуре газа.
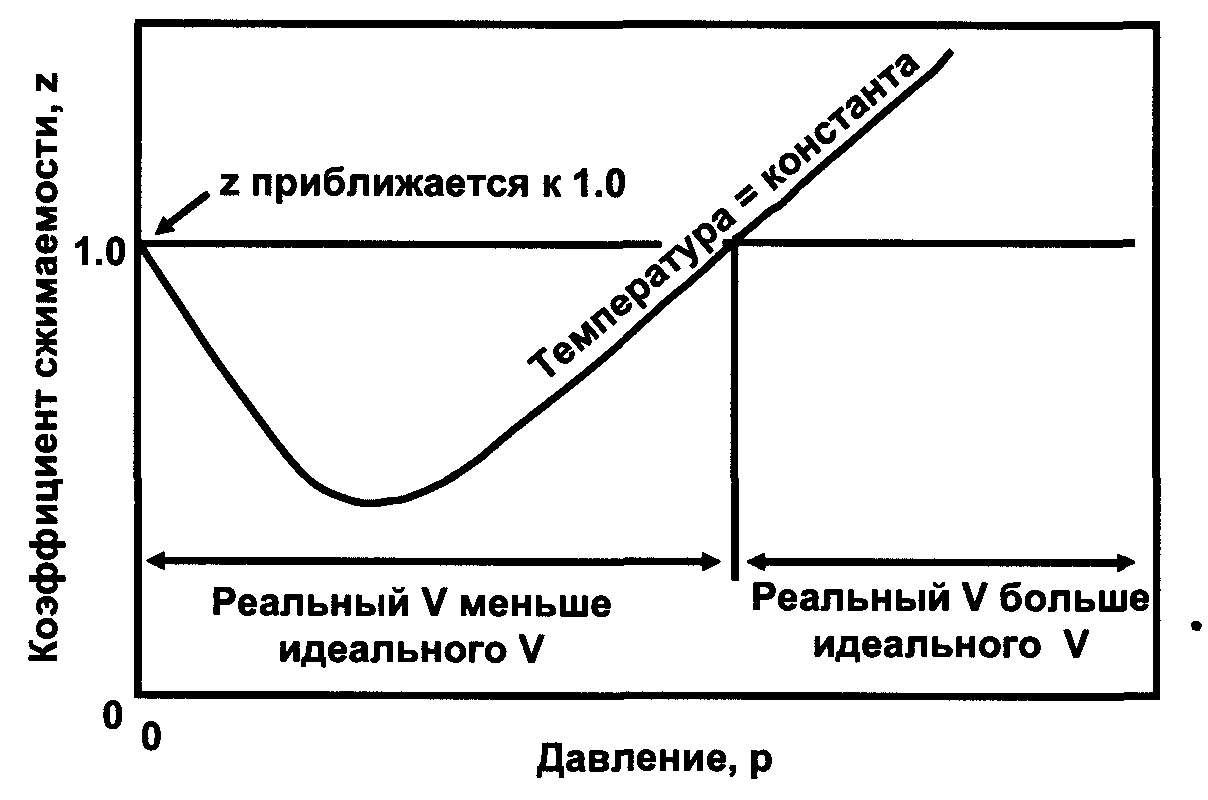
Рисунок 1. Типичный график изменения коэффициента сверхсжимаемости от давления при постоянной температуре
Наибольшее распространение определения коэффициента сверхсжимаемости для газовых смесей месторождений природных газов при давлениях до 70 МПа получил метод его определения по графику, приведенному на рисунке 2. В основе построения этого графика положен принцип соответственных состояний, т.е. при одинаковых значениях приведенных давлений Рпри температур Тпрразличные вещества имеют одинаковые значения коэффициента сверхсжимаемости Z.
.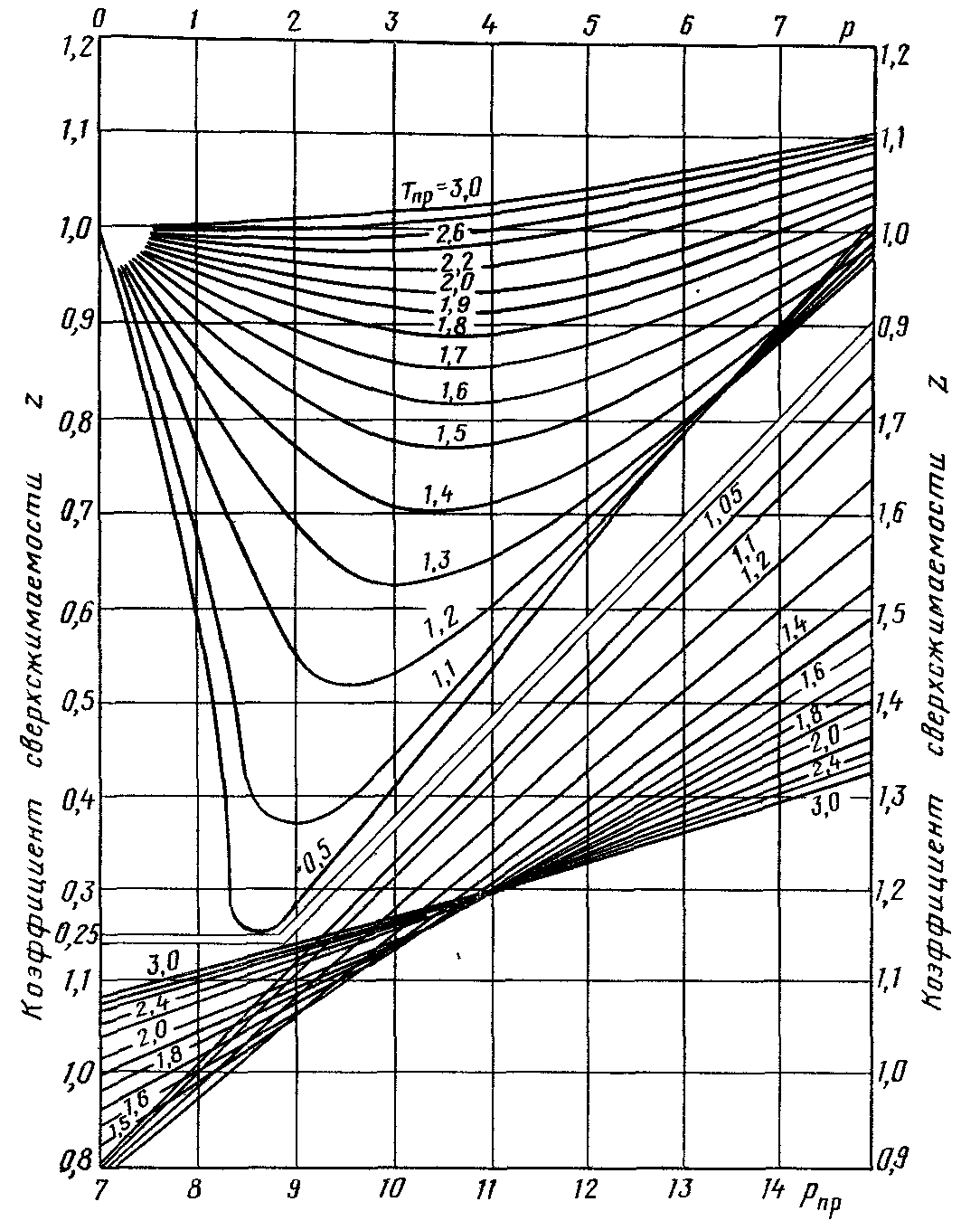
Рисунок 2. Зависимость коэффициента сверхсжимаемости Z природных газов от приведенных давления и температуры.
Методика определения коэффициента сверхсжимаемости Z сводится к следующему. Первоначально по рисункам 2 и 3 или по формуле (2) в зависимости от относительной плотности и состава газа определяют среднекритические давление и температуру, а за тем приведенные давление и температуру.
Среднекритические (псевдокритические) давление и температуру смеси можно рассчитать по формуле (2):

где х1, х2…,хn – объёмные доли компонентов, входящих в состав газа;
Ркр1, Ркр2…, Ркрn – критические давления компонентов;
Тр1, Тр2…, Трn – критические температуры компонентов.
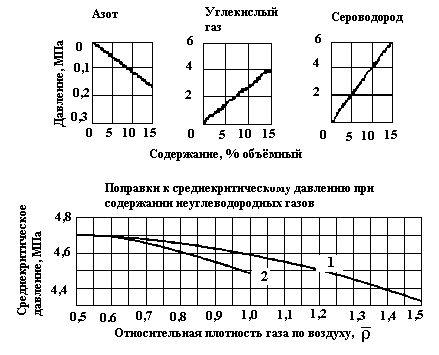
Рисунок 3. Зависимость среднекритического
давления от относительной плотности
газа по воздуху: 1 – газовые месторождения;
2 – газоконденсатные месторождения
(![]() ).
).
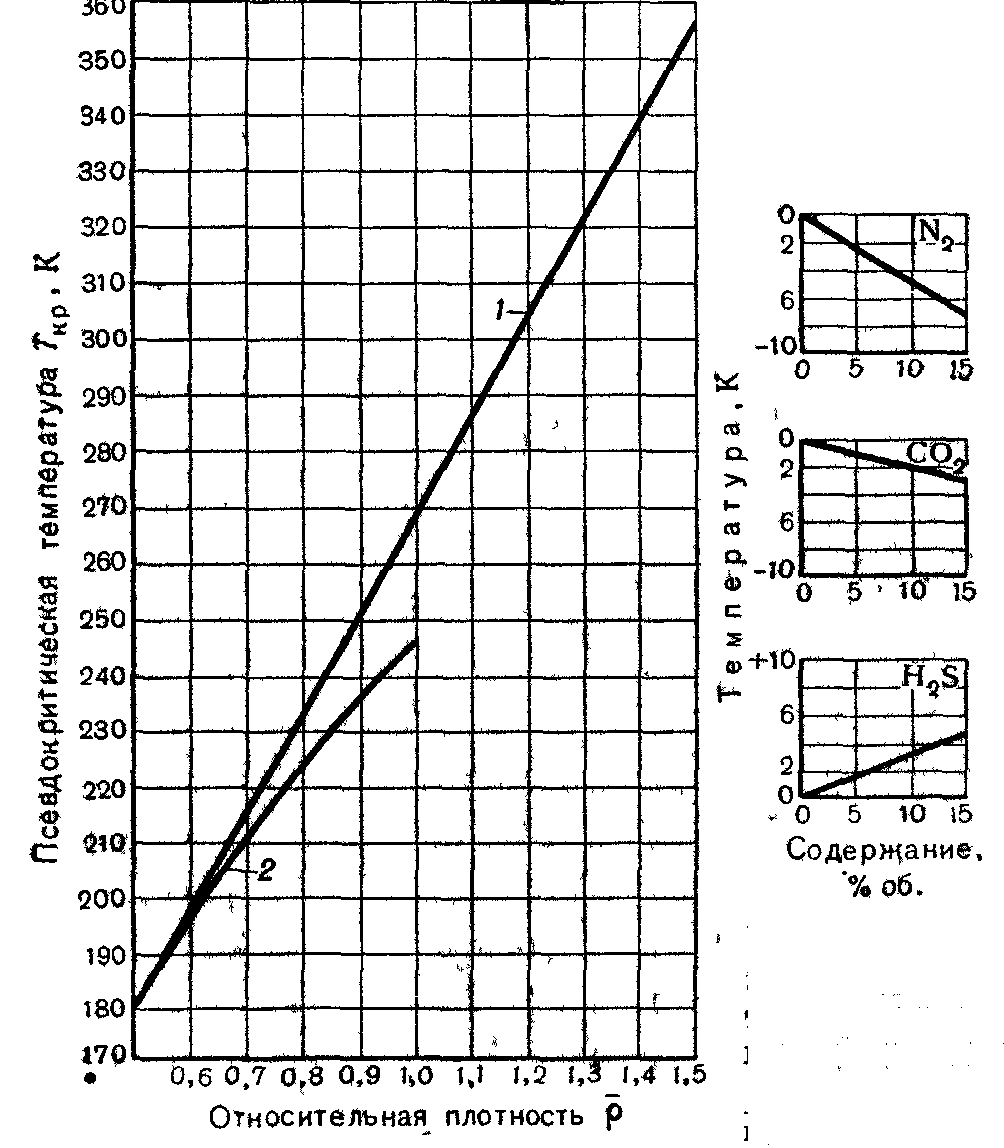
Рисунок 4. Зависимость среднекритической температуры от относительной плотности газа по воздуху:
1 – газовые месторождения;
2 – газоконденсатные месторождения
(![]() ).
).
При содержании в газе N2, СО2 и H2S более 15 % объёмных вместо графиков для определения Ркр и Ткр можно использовать формулу (2).
Далее по зависимости приведенной на рисунке 1 определяют соответствующее Рпр и Тпр и значение коэффициента сверхсжимаемости Z.
В таблице 1 приведены сведения некоторых физико-химических параметрах компонентов, входящих в состав природного газа.
Как говорилось ранее, в пластовых условиях в газоконденсатных месторождениях находятся высококипящие углеводороды (С5Н12+), в составе которых присутствуют бензиновые, керосиновые и масляные фракции, кипящие при температуре до 500оС. Массовая доля этана и пропан - бутановой фракции достигает 25 %
Таблица 1. Основные свойства компонентов природного газа
|
Показа- тели |
СН4 |
С2Н6 |
С3Н8 |
i- С4Н10 |
n- С4Н10 |
i- С4Н10 |
n- С4Н10 |
СО2 |
СО |
Н2S |
N2 |
Пары воды |
Воздух |
|
Молеку-лярная масса |
16,042 |
30,068 |
44,094 |
58,124 |
58,124 |
72,147 |
72,147 |
44,01 |
28,01 |
34,076 |
28,016 |
18,016 |
28,966 |
|
Газовая постоян- ная |
52,90 |
28,22 |
19,26 |
14,60 |
14,60 |
11,76 |
11,76 |
19,14 |
30,26 |
24,89 |
30,13 |
47,10 |
29,27 |
|
Ткр,, 0С |
-82,5 |
33,0 |
96,6 |
134,0 |
152,0 |
187,7 |
197,2 |
31,1 |
-140,2 |
100,4 |
-147,00 |
374,10 |
-140,70 |
|
Ркр, МПа |
4,58 |
4,85 |
4,34 |
3,82 |
3,57 |
3,29 |
3,30 |
7,29 |
3,45 |
8,89 |
3,35 |
21,75 |
3,72 |
|
Плотность по воздуху |
0,554 |
1,038 |
1,523 |
2,007 |
2,007 |
2,4908 |
2,4908 |
1,5291 |
0,968 |
1,1906 |
1,2505 |
0,804 |
1,2930 |
В составе высококипящих углеводородов пластовой газоконденсатной системы содержаться углеводороды трех химических групп: метановые, нафтеновые и ароматические, причём их соотношения весьма различаются для различных газоконденсатных месторождений. В таблице 2 приведена краткая характеристика газового конденсата ряда месторождений СНГ.
Содержание высококипящих углеводородов тем выше,
чем выше пластовые давления и температура. Следует отметить, что условия формирования месторождения могут существенно повлиять на такую закономерность.
В этой связи в природе могут встречаться три типа газоконденсатных залежей - насыщенные, недонасыщенные и перегретые. Для последних типов залежей свойственно, что пластовая температура выше критической температуры конденсации пластовой системы.
Насыщенные газоконденсатные системы образуются, если в процессе формирования залежей имеются источники снабжения газовой фазы высококипящими углеводородами (нефтяная оторочка или вблизи лежащие нефтяные месторождения).
Таблица 2. Качественная характеристика конденсатов
|
Месторождение |
Содержание углеводородов, % массовый |
Молекулярный вес |
Плот ность, г/см3 |
Вязкость, сст | ||
|
Ароматические |
Нафте-новые |
Мета-новые | ||||
|
Шебелинское |
14,10 |
33,20 |
52,70 |
120 |
0,7665 |
1,4290 |
|
Крестищенское |
14,20 |
30,20 |
55,60 |
141 |
0,7864 |
1,6250 |
|
Кегичевское |
17,60 |
44,20 |
38,20 |
124 |
0,7724 |
1,0210 |
|
Южно-Советское |
40,00 |
30,00 |
30,00 |
140 |
0,7950 |
1,2000 |
|
Староминское |
12,96 |
22,39 |
64,55 |
- |
0,7070 |
0,9787 |
|
Некрасовское |
44,50 |
19,20 |
36,30 |
- |
0,8115 |
1,0000 |
|
Березанское |
45,00 |
25,00 |
30,00 |
- |
0,8020 |
1,2210 |
|
Шатлыкское |
8,70 |
9,40 |
80,90 |
- |
0,7578 |
1,6700 |
|
Ачакское |
20,50 |
35,30 |
63,20 |
122 |
0,7652 |
1,3900 |
|
Наипское |
26,30 |
29,60 |
44,10 |
116 |
0,7817 |
1,2900 |
|
Гугуртли |
29,60 |
32,30 |
38,20 |
128 |
0,7866 |
1,2900 |
|
Беурдешек |
20,4 |
33,40 |
46,20 |
127 |
0,7739 |
1,2000 |
|
Оренбургское |
21,30 |
22,50 |
56,20 |
90 |
0,6970 |
- |
|
Игримское |
4,75 |
63,15 |
32,10 |
97 |
0,7718 |
1,0006 |
|
Пунгинское |
6,00 |
56,00 |
38,00 |
111 |
0,7410 |
0,9810 |
|
Средне-Вилюйское |
25,20 |
44,40 |
30,40 |
- |
0,7430 |
1,3500 |
|
Южно Мубарекское |
10,00 |
9,00 |
81,00 |
103 |
0,7314 |
0,7700 |
|
Газлинское |
29,00 |
30,00 |
41,00 |
117 |
0,7545 |
- |
|
Вуктыльское |
12,00 |
18,00 |
70,00 |
114 |
0,7283 |
- |
|
Уренгойское |
18,30 |
40,00 |
41,70 |
- |
0,8141 |
1,5900 |
В пережатых пластовых системах даже при высоком содержании углеводородов С5+высв пластовых газах давление начала конденсации всегда ниже пластового.
Следует отметить, что характерной особенностью газоконденсатных газов является уменьшение концентрации от этана к пропану, и от пропана по отношению к бутанам, тогда как в нефтяных газах указанная закономерность отсутствует.
В газах, растворенных в нефтях, содержание этана всегда меньше содержания пропана, т.е. коэффициент отношения этана к пропануС2/С3 < 1.
В газах газоконденсатных месторождений эта величина составляет 2 – 6. Отношение метана к сумме тяжелых углеводородов С1/С2+в а газах газоконденсатных месторождений составляет порядка 10, а в газах, растворенных в нефти до 13.
Газовые конденсаты можно подразделить три основные категории:
- малосернистые и малоароматизированные;
- высокоароматизированные с содержанием более 20% ароматических углеводородов;
- сернистые и высокосернистые содержанием серы более 0,2 %.
Первая категория имеет несколько групп, различающихся по фракционному составу. В первую группу входят конденсаты, имеющий фракционный состав, аналогичный бензинам. Во вторую группу входят конденсаты, близкие по характеристикам к реактивным топливам. Третья группа содержит конденсаты, которые соответствуют по фракционному составу реактивным (фракция 145 – 285 0С) или дизельным топливам (фракция 145 – 3500С).
