
- •Лекция №1
- •Классификация месторождений природного газа
- •Этапы разработки газовых и газоконденсатных месторождений
- •Режимы разработки месторождений природных газов
- •Особенности разработки газоконденсатных месторождений
- •Особенности притока газа к забою газовой скважины
- •Лекция 3
- •Состав и физико-химические свойства природных газов. Классификация природных газов
- •Газовые смеси. Плотность газов
- •Состав газовой смеси
- •Так появились уравнения состояния Битти - Бриджмена с пятью константами, Бенедикта – Вебба - Рубина с восемью константами и др.
- •Вязкость газов
- •Термодинамические характеристики газа
- •Классификация газовых топлив
- •Требования к качеству газового топлива
- •Опасные свойства природных газов
- •Взрывы газовоздушных смесей
- •Жидкие смеси. Состав и характеристика жидкой смеси
- •Объём паров после испарения жидкости
- •Фазовые состояния углеводородных систем. Словия равновесия двухфазной системы
- •Количественное решение двухфазной системы заключается в количественном распределении на паровую и жидкую фазы всех компонентов этой смеси при заданных давлении и температуре.
- •Упругость насыщенных паров
- •Термодинамические характеристики газа
- •Эффект Джоуля – Томсона
- •Эффект Ранка
- •Лекция №7
- •Лекция № 8
- •Состояние призабойной зоны пласта
- •Проницаемость призабойной зоны пласта
- •Классификация дисперсных систем по межфазному взаимодействию
- •Фильтрация дисперсных систем через пористые среды
- •Определение диаметра фонтанных труб газовой скважины
- •Принцип работы газлифта
- •Системы и конструкции газлифтных подъёмников
- •Разновидности газлифта, их технологические схемы
- •Преимущества и недостатки газлифтного способа добычи нефти
- •Оборудование газлифтных скважин
- •Пусковое давление
- •Методы снижения пускового давления
- •Газлифтные клапан
- •Тарировка газлифтных клапанов
- •Спуск и подъём съёмных клапанов, используемый инструмент
- •Торпедная перфорация
- •Сверлящая перфорация
- •3.Свабирование
- •4. Имплозия
- •Приборы для измерения давления
- •Устройства для измерения температуры
- •Устройства для измерения расхода природного газа
- •Подготовка скважины к газогидродинамическим исследованиям
- •Технология проведения исследований
- •Определение коэффициентов фильтрационного сопротивления "а" и "в"
- •Обработка результатов исследований газовой скважины на стационарных режимах
- •Пожары и фонтаны на нефтяных и газовых скважинах
- •Лекция №22
- •Средства и методы борьбы с пескопроявлением скважин
- •Лекция 23
- •Основные мероприятия по предупреждению и ликвидации обводнения газовых скважин
- •Классификация методов восстановления производительности обводняющихся скважин
- •Лекция №24
- •Лекция №25
- •8М-136 н2о или же м-17 н2о.
- •I – с4н817н2о,
- •Лекция №26
- •Основы ингибирования процесса гидратообразования
- •Ликвидация гидратов природных газов в газопроводах
- •Метод снижения давления в газопроводе
- •Метод устранения гидратов повышением их температуры
- •Устранение гидратных пробок с использованием ингибиторов гидратообразования
- •Метод сублимации гидрата
Термодинамические характеристики газа
В технологических расчётах добычи и транспорта газа часто пользуются основными термодинамическими характеристиками природного газа: теплоемкостью, энтропией, энтальпией, теплотой сгорания, теплообменом, теплопроводностью.
Теплоёмкость. Теплоёмкостью называют количество теплоты, необходимое для нагревания единицы массы или объёма вещества на 1° С.
Отношение теплоёмкости в массе системы М называется удельной теплоёмкостью: с = С/М, а отношение теплоемкости к количеству вещества – молярной теплоёмкостью:
![]() . (1)
. (1)
Единицей количества теплоты, работы, энергии в системе СИ является джоуль (Дж). Джоуль - работа силы 1 Н при перемещении ею тела на расстоянии 1 м в направлении действия силы:
![]()
Теплоёмкость выражается в Дж/К, удельная теплоёмкость – в Дж/(кг·K), молярная теплоёмкость – в Дж/(моль К).
Теплоёмкость природных газов зависит от химического состава и состояния, а также от процесса сообщения им теплоты. В адиабатическом процессе С = 0, в изобарическом С = Ср, в изохорическом С = Сv.
Для газов обычно различают теплоёмкости при постоянном объёме Сv и постоянном давлении Ср.
![]()
![]() (2)
(2)
где Р = const и V = const.
Теплоёмкости при постоянном объёме Сv связана с процессом, характеризующимся тем, что при неизменности объёма вся энергия, сообщаемая газу в форме теплоты, затрачивается на увеличение внутренней энергии газа. Срсвязана с процессом, характеризующимся тем, что, нагревая тело, предоставляют ему возможность расширяться при неизменном давлении. Таким образом, часть сообщенной телу теплоты идет на производство работы расширения. ПоэтомуСр > Сv.
Для идеальных газов между СриСv существует следующее соотношение в [кал/моль·°С]:
![]() (3)
(3)
где R- газовая постоянная.
В области давлений, где газы считаются идеальными, значения теплоёмкостей постоянны. Однако для реальных газов значения теплоёмкости изменяются в зависимости от давления и температуры.
Для смеси газов теплоёмкость определяется по сумме теплоемкости входящих компонентов по формуле
![]() (4)
(4)
где С1, С2…Сn- теплоёмкости отдельных компонентов смеси;
х1,
х2…![]() содержание компонентов в долях единицы.
содержание компонентов в долях единицы.
Отношение теплоёмкости
![]() называют
показателем адиабаты.
называют
показателем адиабаты.
Для практических целей с достаточной точностью можно использовать формулу следующего вида:
![]()
где Ср– изобарная теплоёмкость;
Ср ат– теплоёмкость при атмосферном давлении и заданной температуре, определяемая из рисунка 1 и расчётным путём.
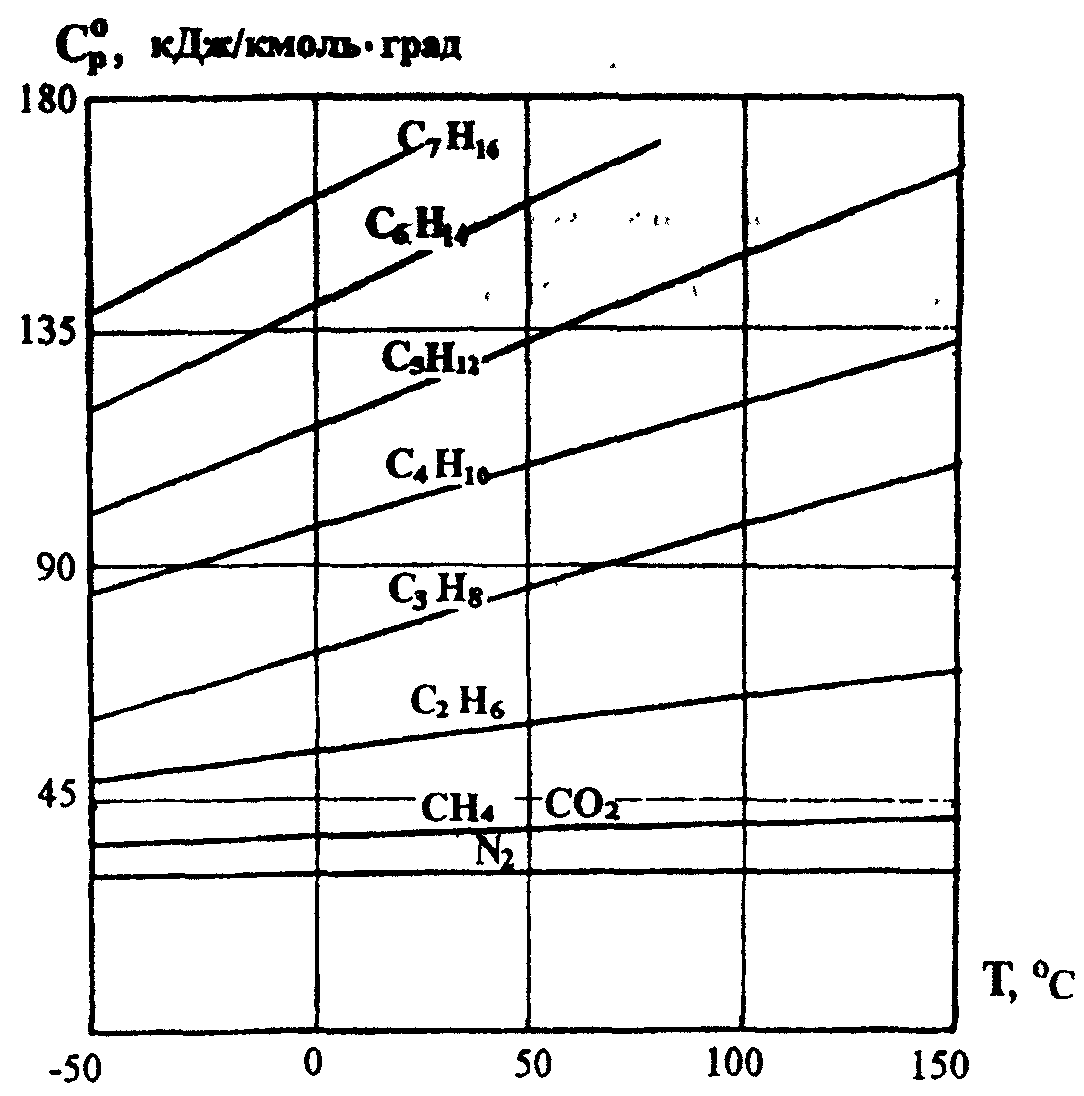
Рисунок 1. Зависимость изобарной молярной
теплоёмкости природных газов
![]() от температуры при давлении Р = 0,1 МПа
от температуры при давлении Р = 0,1 МПа
Аналитически Ср атопределяется по формуле следующего вида
![]()
где Еi, Fi, Hi, Ni– коэффициенты, определяемые из таблицы 1;
n= Т/100;
Т – температура, при которой
определяется
![]() .
.
Изотермическая поправка на давление ΔСрможет быть определена как графическим путем, так и расчётным, например, по формуле следующего вида
![]()
где R – газовая постоянная, равная R = 1,986 ккал/моль;
М – молекулярная масса газа;
![]() - поправки на теплоёмкость, зависящие
от приведенных давления и температуры,
определяемые по зависимостям, приведенным
на рисунках 2 и 3.
- поправки на теплоёмкость, зависящие
от приведенных давления и температуры,
определяемые по зависимостям, приведенным
на рисунках 2 и 3.

Рисунок 2. Зависимость поправочной
![]() от приведенных давления и температуры
от приведенных давления и температуры
Величина
![]() может быть определена и без учёта фактора
ацентричности ω по графической зависимости
приведенной на рисунке 4.
может быть определена и без учёта фактора
ацентричности ω по графической зависимости
приведенной на рисунке 4.

Рисунок 3. Зависимость поправочной
величины
![]() т приведенных давления и температуры
т приведенных давления и температуры
Фактор ацентричности молекул газа ω определяется аналогично, как и при определении коэффициента сверхсжимаемости Z.
Величину Ср(Р, Т) можно рассчитать по формуле вида
 (8)
(8)
где Т - температура газа, 0С;
М – молекулярная масса газа.
Таблица 1. Значения коэффициентов для
зависимости (6)![]()
|
Компоненты |
Молек. масса
|
|
|
|
|
|
|
Метан |
16,04 |
0 |
58522,25 |
15215,04 |
- 2947,67 |
18575,95 |
|
Этан |
30,07 |
0 |
62557,49 |
25663,79 |
36001,45 |
3343,11 |
|
Пропан |
44,09 |
0 |
66328,12 |
32767,24 |
62295,40 |
- 782,07 |
|
Бутан |
58,12 |
0 |
65812,73 |
33182,44 |
33182,44 |
3,8610 |
|
Изобутан |
- |
0 |
68152,31 |
36790,16 |
75903,33 |
- 1685,56 |
|
Пентан |
72,15 |
0 |
65762,49 |
33814,98 |
66951,12 |
- 112,122 |
|
Изопентан |
- |
0 |
66838,91 |
34687,09 |
69556,98 |
- 1530,40 |
|
Гексан |
86,16 |
0 |
66060,17 |
34773,68 |
70914,34 |
- 456,22 |
|
Гептан |
100,20 |
0 |
66040,07 |
35091,50 |
31839,23 |
- 503,65 |
|
Октан |
114,22 |
0 |
66094,50 |
35466,84 |
73861,01 |
- 561,57 |
|
Нонан |
128,26 |
0 |
65986,06 |
35489,58 |
74039,37 |
- 522,39 |
|
Декан |
142,29 |
0 |
65991,50 |
- 35677,77 |
74788,39 |
- 549,49 |
|
Кислород |
32,00 |
0 |
21621,09 |
16458,14 |
49445,62 |
125051,12 |
|
Водород |
2,02 |
0 |
330368,33 |
294527,51 |
14165,32 |
200717,79 |
|
Вода |
18,02 |
0 |
40147,27 |
27801,52 |
79225,56 |
26409,75 |
|
Гелий |
4,00 |
5191,632 |
0 |
0 |
0 |
0 |
|
Аргон |
39,95 |
520,712 |
0 |
0 |
0 |
0 |
|
Криптон |
83,80 |
248,696 |
0 |
0 |
0 |
0 |
|
Хлористый водород |
36,46 |
741,248 |
1447,19 |
187,48 |
51,33 |
313,63 |
|
Сероводород |
64,86 |
0 |
19097,88 |
154,95 |
43953,78 |
5109,53 |
|
Двуокись серы |
34,08 |
0 |
24379,36 |
16676,57 |
45818,66 |
11682,30 |
|
Азот |
28,01 |
0 |
21745,15 |
16129,31 |
45183,53 |
15429,99 |
|
Двуокись углерода |
44,01 |
0 |
25745,76 |
19428,01 |
53589,36 |
6924,42 |
|
Окись углерода |
28,01 |
0 |
22065,65 |
16193,91 |
44592,35 |
15197,54 |
Энтропия. ЭнтропияSтела - величина, изменение которой равно отношению изменения количества теплоты к абсолютной температуре тела:
![]() (9)
(9)
где ∆S- изменение энтропии системы, если ей сообщается теплота∆Qпри температуре T.
Единицей измерения энтропии является джоуль на Кельвин (Дж/К).
Удельная энтропия в Дж/К
![]() (10)
(10)
где m - масса тела.
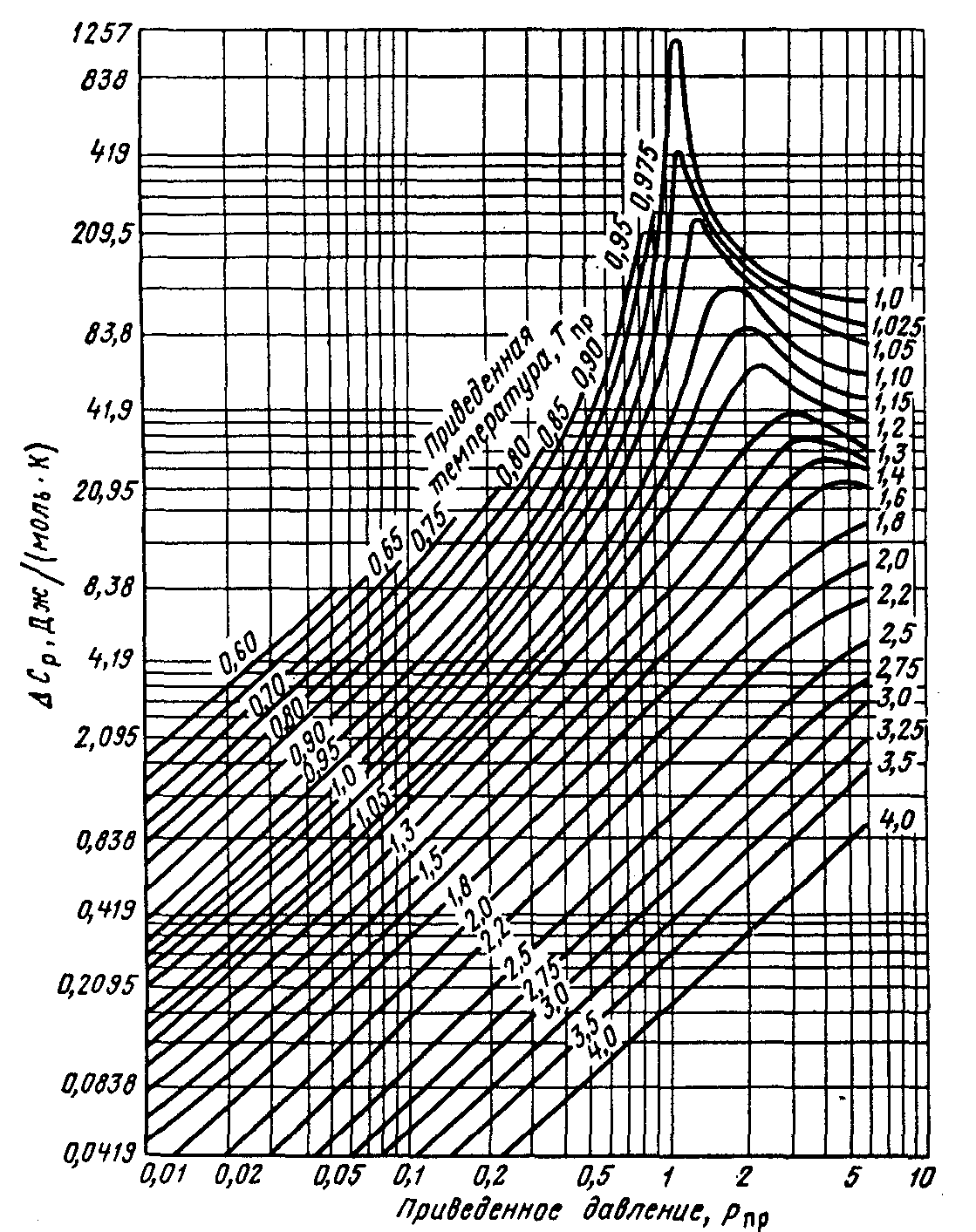
Рисунок 4 Зависимость
изотермической поправки изобарной
молярной теплоёмкости ![]() от приведенных абсолютных давления Рпр
и температуры Тпр
от приведенных абсолютных давления Рпр
и температуры Тпр
Энтальпия. Свойство вещества, которое позволяет судить о количестве теплоты, требующейся для изменения его температуры, называется энтальпией Н.
Иными словами, энтальпия - это функция состояния вещества, определяемая равенством:
![]() (11)
(11)
где u - внутренняя энергия, рассчитанная на единицу массы вещества;
Р - давление;
ν - удельный объём.
В термодинамике различают два процесса, в которых подведенное тепло равно разности энтальпий:
- расширение при постоянном давлении;
- скорость процесса небольшая, поэтому изменением кинетической энергии можно пренебречь.
Изменение энтальпии от температуры для однофазного состояния вещества выражается удельной теплоёмкостью при постоянном давлении Ср:
![]() (12).
(12).
Влияние давления выражается следующим образом
![]() (13)
(13)
где V – объём газа.
Для идеальных газов изменение энтальпии с изменением давления выражается как
![]() .
.
Для реальных газов изменение энтальпии с изменением давления выражается, как известно через коэффициент сжимаемости z:
![]() (14)
(14)
Внутренняя энергия идеального газа зависит только от температуры. Зависимость внутренней энергии реального газа от объёма и давления была выяснена Джоулем и Томсоном.
На рисунке 5 приведена графическая зависимость позволяющая оценивать влияние давления и температуры на энтальпию природного газа.
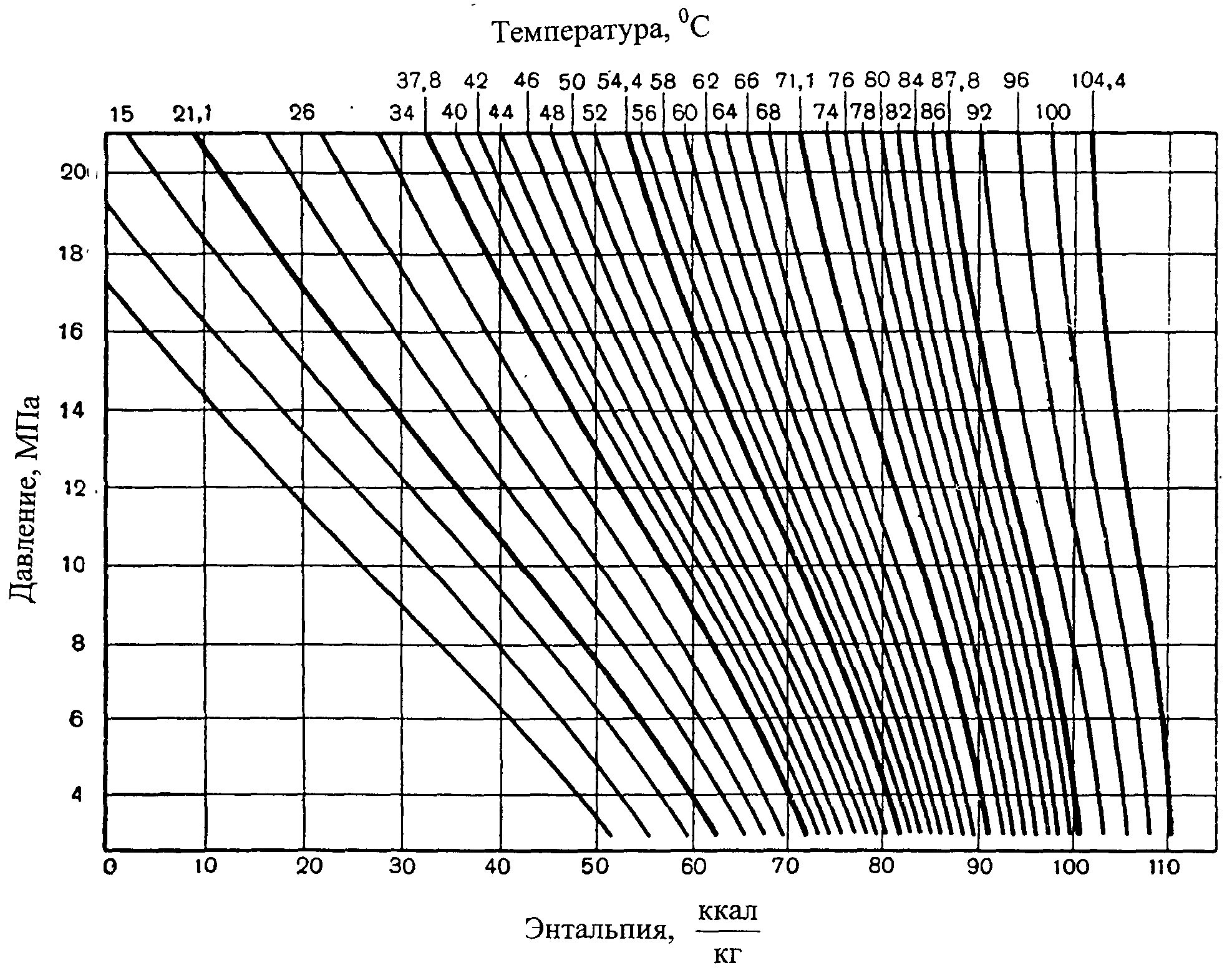
Рисунок 5 - Энтальпийная диаграмма природного газа
