
- •РЕФЕРАТ
- •СПИСКИ ОБОЗНАЧЕНИЙ, СОКРАЩЕНИЙ И ТЕРМИНОВ
- •Список используемых обозначений
- •Список используемых сокращений биологических терминов
- •ВВЕДЕНИЕ
- •Мутации и мутагены
- •Мутация. Классификация мутаций
- •Типы мутагенов
- •Цитогенетические эффекты воздействия физических мутагенов
- •Ионизирующие лучи
- •Ультрафиолетовые лучи
- •Электромагнитное излучение
- •Природа электромагнитного излучения
- •Гамма-лучи
- •Рентгеновские лучи
- •Ультрафиолетовые волны
- •Видимый свет
- •Инфракрасное излучение
- •Микроволновые лучи
- •Радиоволны (исследуемый фактор)
- •Понятие электромагнитного излучения (ЭМИ) и поля (ЭМП)
- •Радиосвязь
- •Радиорелейная связь
- •Спутниковая связь
- •Сотовая связь
- •Мобильный радиотелефон
- •Значимые события из истории мобильной связи
- •Электромагнитное излучение сотовых телефонов как фактор окружающей среды
- •Существуют ли средства защиты от излучения мобильного телефона?
- •Выводы и рекомендации для пользователей мобильной связью
- •Механизмы биологических эффектов УВЧ излучения GSM диапазона
- •Методы исследования
- •Drosophila melanogaster как тест-объект в генетической токсикологии
- •Allium cepa как тест-объект в генетической токсикологии
- •Преимущества растительных тест систем
- •Метод ана-телофазного анализа хромосомных аберраций
- •Микроядерный тест
- •Материалы исследований
- •Методы исследования
- •Статистическая обработка результатов
- •Интегральная оценка мутагенного эффекта
- •Исследование зависимости эффектов от времени экспозиции (серия экспериментов №1)
- •Исследование эффективности экранирования излучения (серия экспериментов №2)
- •Исследование влияния на животный организм (серия экспериментов №3)
- •Серия экспериментов № 1
- •Результаты
- •Выводы
- •Серия экспериментов № 2
- •Результаты
- •Выводы
- •Серия экспериментов № 3
- •Результаты
- •Выводы
- •ВЫВОДЫ
- •СПИСОК ИСПОЛЬЗОВАННЫХ ИСТОЧНИКОВ
- •ПРИЛОЖЕНИЯ
- •Приложение 1 Сводные таблицы по индексам
- •Приложение 2 Генетические нарушения
- •Приложение 3 Микроядра

а) |
б) |
Рис. 8 Внешний вид тест-организмов |
|
а) Allium cepa (сорт Штутгартен-Ризен) |
|
б)женской и мужской особей Drosophila melanogaster |
|
2.2.Методы исследования
2.2.1.Проведение экспериментов с использованием Allium cepa
Для проведения опыта отбирался выровненный материал: все подобранные луковицы типичны для используемого сорта и одинаковы по размеру ~3,5 г.
В условиях опыта луковицы помещались в стеклянные ѐмкости с дистиллированной водой, которая добавлялась в емкости, так чтобы донце луковиц всегда соприкасалось с водой. Луковицы оставлялись на сутки до появления корешков.
Затем они делились на группы:
опытных, которые подвергались воздействию исследуемого фактора и интактного контроля.
В течении эксперимента луковицы проращивались еще 3 дня.
По завершении эксперимента проводилось срезание корешков с каждой луковицы опытных и контрольной групп и промывание их водой. Предварительно измерялась и записывалась длина корешков.
Срезанные корешки помещали на 72 часа в фиксатор Кларка (96% этиловый спирт и ледяная уксусная кислота в соотношении 3:1). После фиксации материала, для долговременного хранения, его поместили в 70% этиловый спирт. Перед окрашиванием корешки отмывались от фиксатора в дистиллированной воде, и помещались в тигель с красителем. Окраска корешков производилась 2% ацетоорсеином (1г орсеина растворяли в 50 мл горячей уксусной кислоты, доводили до кипения, фильтровали) в
фарфоровых тиглях. Тигель нагревался над пламенем спиртовки до появления паров на покровном стекле (начало тайного кипения) (Прохорова И.М., 2003).
Готовили временные давленые препараты корневых меристем. Окрашенные корешки отмывали от красителя в 45% уксусной кислоте. Лезвием отрезали кончик корешка длинной 2-3 мм, помещали на предметное стекло в каплю 45% уксусной
51
кислоты, накрывали покровным стеклом и с помощью спички раздавливали до получения монослоя клеток.
Препараты анализировали под микроскопом МИКРОМЕД-1 при увеличении
12,5х1,5х40. На препаратах рассматривали мелкие, округло-квадратной формы клетки с
хорошо прокрашенными ядрами и неповрежденными клеточными стенками.
Мутагенную активность УВЧ излучения сотовых телефонов оценивали по
предложенной нами |
модификации |
методики «Alium test» (Песня Д.С. и |
Романовский А.В., 2010). |
Применялся |
ана-телофазный метод учѐта хромосомных |
аберраций и микроядерного теста.
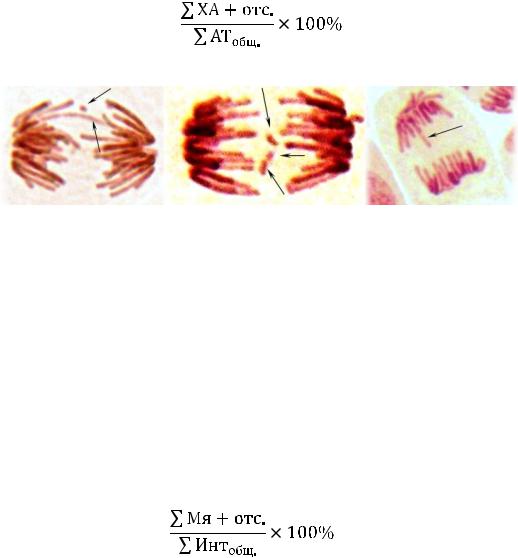
Отмечались следующие типы хромосомных аберраций: мосты (рис. 9 – а) и
фрагменты (рис. 9 – б). Также отмечались отставания хромосом (рис. 9 – в) (Прохорова И.М., 2003). Анателофазный анализ позволяет изучать частоту мутаций путѐм учѐта суммы хромосомных аберраций (ХА) и отставаний (отс.) на стадиях анафазы и телофазы к общей сумме анателофаз на препарате, (1) (Прохорова И.М., 2003):
(1)
Рис. 9 Микропрепараты клеток лука с мутациями кр. ацеторсеин; ув. 12,5х40
а-мост и фрагмент, б-тройной фрагмент, в-отставание
На одном и том же препарате изучалась частота появления микроядер (рис. 10 –
а, б) в интерфазных клетках. При этом велся учѐт микроядер в интерфазных клетках к общей сумме интерфаз на препарате (Мя, %), (2). Также регистрировалась деструкции интерфазного хроматина (рис. 10 – в), то есть образование микроядер наблюдалось ещѐ до деления клеток (Калаев В.Н, 2004). Микроядерный тест позволяет расширить диапазон изучаемых клеток, что делает метод ещѐ более оперативным и экономичным (Песня Д.С. и Романовский А.В., 2010). Расчѐт Мя, % ведѐтся по формуле:
(2)
52

а) б) в) Рис. 10 Микропрепараты клеток лука с мутациями кр. ацеторсеин; ув. 12,5х40
а, б-микроядра; в-деструкция интерфазного хроматина
Оценку митозмодифицирующей активности проводили на тех же временных препаратах. Просматривали около 600 клеток. Подсчитывали общее количество делящихся клеток и отдельно клетки на разных стадиях митоза. Нарушения регистрировали на всех фазах (рис. 11).
а) б) в) г)
Рис. 11 Фазы митоза
а-профаза; б-метафаза; в-анафаза; г-телофаза
Показателем уровня митотической активности является митотический индекс
(MI, %, формула 3) - показывает соотношение числа клеток, находящихся в митозе, к
общему числу проанализированных клеток, исследованных на препарате изучаемой:
(3)
где, (P+M+A+T) - сумма клеток, находящихся на стадии профазы, метафазы, ана- и
телофазы, N - общее число проанализированных клеток.
Индекс может говорить о нормальном протекании митоза, об угнетении процесса деления клеток или, напротив, усилении митотической активности тканей. На основании этого делается заключение о митозмодифицирующем действии изучаемого фактора. Увеличение MI может быть обусловлено как усилением пролиферации клеток так и изменением продолжительности различных фаз, то есть задержкой клеток на определенных фазах митоза.
Чтобы вскрыть причины изменений MI подсчитывали фазные индексы (ПИ,% -
профазный индекс; МИ, % - метафазный индекс; А-ТИ, % - ана-телофазный индекс) -
процент клеток в различных стадиях митоза от общего количества делящихся клеток:
53

(4)
(5)
(6)
где П- количество клеток в профазе, М - количество клеток в метафазе, А-ТИ -
количество к леток в ана-телофазе.
2.2.2. Проведение экспериментов с использованием
Drosophila melanogaster
Для постановки опыта использовалась линия дрозофилы дикого типа D-32,
полученная на кафедре генетики МГУ им. Ломоносова. Линия D-32 отличается очень низкой спонтанной мутагенностью в отношении мутаций типа ДЛМ (доминантные летальные мутации), что делает ее очень удобной для опытов, имеющих целью выяснение различий эффектов индуцированного мутагенеза (Глембоцкий, 1967).
Метод учѐта частоты ДЛМ – один из самых простых и экономичных методов выявления мутагенного эффекта, как индивидуальных загрязнителей, так и суммарной мутагенной активности (СМА) природных тел (Прохорова И.М., 2003). Доминантные летальные мутации, которые индуцируются факторами в сперматозоидах, приводят к гибели зиготы или за счѐт возникновения в эмбриогенезе, в результате хромосомных аберраций, дефицита в геноме, или за счѐт различных повреждений, приводящих к блоку редупликации. ПЭЛ (поздние эмбриональные летали) и РЭЛ (ранние эмбриональные летали) – это два класса ДЛМ, которые хорошо определяются визуально. Яйца с ПЭЛ коричневого, палевого или жѐлтого цвета (рис. 12 – г), а с РЭЛ
– белого цвета, и внутри них видны остановившиеся этапы сегрегации эмбриона – белые непрозрачные уплотнения (рис. 12 – в). Подсчѐт ведѐтся на стадии яйца, т.е.
считается количество развившихся из яйца личинок (рис. 12 – а) (по оболочкам от яиц рис. 12 – б) и количество неразвившихся яиц. Также при воздействии на мух мутагенами имеется определѐнная вероятность откладки неоплодотворѐнных яиц
(физиологические повреждения сперматозоидов или снижение половой активности самцов) (рис. 12 – в) (Изюмов Ю.Г., 1974).
(7)
54

где частота ДЛМ (%) определялась как отношение общего числа отложенных яиц (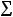
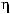 )
)
к числу яиц с ПЭЛ и РЭЛ (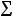
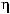
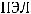
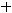
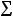
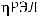 ).
).
а) б) в) г)
Рис. 12 Drosophila melanogaster D32(ув. 8х5х1,5)
а- вылупившаяся личинка, б- пустая оболочка яйца, из которого вылупилась личинка,
в- невылупившиеся яйца: слева неоплодотворѐнное, справа РЭЛ, г- ПЭЛ
В качестве корма для мух готовилась среда следующего состава:
вода |
– 800 мл; |
крупа манная |
– 25 г; |
песок сахарный |
– 95 г; |
дрожжи |
– 75 г; |
агар |
– 9 г. |
В качестве консерванта была использована пропионовая кислота (2 мл).
культура содержалась в термостате, при температуре 22°С.
Постановка экспериментов осуществлялась по следующей методике. В
стаканчик наливали 5 мл питательной среды. На нее высаживали трехдневных самцов.
Далее самцы скрещивались с интактными виргинными самками.
Скрещивание проводили в чашках Петри, дно которых предварительно заливали
средой:
вода |
– 700 мл; |
агар-агар |
– 9 г; |
сахарный песок |
– 25 г. |
При помощи марли делали на поверхности среды «шероховатую поверхность».
В чашках мухи находились трое суток. Через сутки отсаживали самцов, через двое суток – самок.
Нами использовалась общепринятая методика учета ДЛМ у
Drosophila melanogaster в модификации М.Ю. Хромых (1977).
После, чашки Петри с отложенными яйцами ставились в термостат на пять суток для выхода личинок из яиц. По истечении этого времени проводился подсчет яиц под микроскопом МБС-2, как описано выше.
55
